Chronisches Nierenversagen
Beim chronischen Nierenversagen (auch chronische Niereninsuffizienz, chronische Nierenkrankheit oder chronische Nierenerkrankung; in der Fachliteratur auch englisch Chronic Kidney Disease, CKD) handelt es sich um einen langsamen, über Monate oder Jahre voranschreitenden Verlust der Nierenfunktion. Im engeren Sinn der aktuellen Leitlinien bezeichnet der Begriff chronisches Nierenversagen das Terminal- oder Endstadium einer chronischen Nierenkrankheit, das gekennzeichnet ist durch eine Nierenleistung von 15 % der Norm oder darunter (entsprechend einer glomerulären Filtrationsrate von unter 15 ml/min) und durch die Notwendigkeit einer Nierenersatztherapie in Form von Dialysebehandlung oder Nierentransplantation.
| Klassifikation nach ICD-10 | |
|---|---|
| N18.1 | Chronische Nierenkrankheit, Stadium 1 – Nierenschaden mit normaler oder erhöhter glomeruläre Filtrationsrate (GFR 90 ml/min oder höher) |
| N18.2 | Chronische Nierenkrankheit, Stadium 2 – Nierenschaden mit leicht verminderter glomeruläre Filtrationsrate (GFR 60 bis unter 90 ml/min) |
| N18.3 | Chronische Nierenkrankheit, Stadium 3 – Nierenschaden mit mäßig verminderter glomeruläre Filtrationsrate (GFR 30 bis unter 60 ml/min) |
| N18.4 | Chronische Nierenkrankheit, Stadium 4 – Nierenschaden mit stark verminderter glomerulärer Filtrationsrate (GFR 15 bis unter 30 ml/min) |
| N18.5 | Chronische Nierenkrankheit, Stadium 5 – chronische Urämie, terminale Nierenkrankheit |
| N18.9 | Chronische Niereninsuffizienz, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
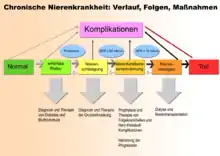
Dieser Artikel behandelt die chronische Niereninsuffizienz in allen Stadien inklusive des Terminalstadiums. Dabei gilt das chronische Nierenversagen im Gegensatz zum akuten Nierenversagen als nicht mehr reversibel. Die Terminologie ist hinsichtlich Krankheitsdauer, Schweregrad und Reversibilität jedoch nicht einheitlich, zumal die Aussagekraft der glomerulären Filtrationsrate besonders bei Vorliegen einer Herzinsuffizienz begrenzt ist.
Schlüssel-Fakten zur chronischen Nierenkrankheit
- Das Maß für die Nierenfunktion ist die glomeruläre Filtrationsrate. Eine chronische Nierenkrankheit liegt vor, wenn die glomeruläre Filtrationsrate unter einen bestimmten Wert (60 ml/min) abgesunken ist oder wenn im Urin Eiweiß ausgeschieden wird. Diese Funktionsstörungen müssen seit mindestens drei Monaten bestehen.
- Weltweit leiden mehr als 500 Mio. Menschen an chronischer Nierenkrankheit, dies entspricht einem von zehn Erwachsenen.
- Weltweit die häufigsten Ursachen sind Entzündungen und Infektionen der Nieren, Verengungen der ableitenden Harnwege und angeborene Nierenkrankheiten. In den Industrienationen sind Diabetes mellitus Typ 2 und Bluthochdruck aufgrund von Bewegungsmangel und Fehlernährung die häufigsten Ursachen. In den Entwicklungsländern steigt die Häufigkeit von Nierenkrankheiten aufgrund Diabetes und Bluthochdruck stark an.
- Eine chronische Nierenkrankheit wird durch eine einfache Blut- und Urinuntersuchung festgestellt. Im Blut wird die Konzentration der Markersubstanz Kreatinin bestimmt, daraus wird die Nierenfunktion berechnet (MDRD-Formel). Im Urin wird die Eiweißkonzentration gemessen.
- Konsequenzen einer nicht erkannten Nierenerkrankung sind der fortschreitende Verlust der Nierenfunktion, möglicherweise bis zur Notwendigkeit von Dialyse und Transplantation, sowie Herz-Kreislauf-Komplikationen. Chronisch Nierenkranke haben ein mindestens 10-fach erhöhtes Risiko, vorzeitig an einer Herz-Kreislauf-Erkrankung (Koronare Herzkrankheit, Herzversagen, Durchblutungsstörungen des Gehirns und der Arterien) zu versterben.
Mehr als 80 % der Menschen, die eine Nierenersatztherapie erhalten, leben in Industrienationen. In Entwicklungsländern ist diese Behandlung weitgehend unerschwinglich. In Ländern wie Indien und Pakistan erhalten weniger als 10 % derer, die eine Behandlung benötigen, eine Nierenersatztherapie. In vielen afrikanischen Staaten wird eine Nierenersatztherapie in der Regel nicht angeboten, was bedeutet, dass viele Menschen einfach sterben. Für Entwicklungsländer wiegt die ökonomische Belastung besonders schwer, weil chronische Nierenkrankheiten dort in einem früheren Lebensalter auftreten.
- Im Frühstadium wird eine chronische Nierenkrankheit meist nicht erkannt, insbesondere in Entwicklungsländern. Durch Früherkennung wird jedoch eine Behandlung noch vor dem Auftreten von Komplikationen ermöglicht.
- Menschen mit erhöhtem Risiko sollten an Früherkennungsmaßnahmen teilnehmen, insbesondere
- Patienten mit Diabetes oder Bluthochdruck,
- Menschen mit Übergewicht,
- Raucher,
- über 50-Jährige,
- bei familiärer Vorbelastung mit Diabetes, Bluthochdruck oder Nierenkrankheiten.
- Eine Behandlung sollte bereits im Frühstadium begonnen werden. Empfohlen werden
- Kontrolle des Körpergewichts,
- regelmäßige körperliche Betätigung,
- Raucherentwöhnung,
- medikamentöse Senkung des Blutdrucks,
- Korrektur von erhöhtem Blutzucker, erhöhten Blutfetten und Blutarmut.
- Eine frühzeitige Behandlung kann den Verlust der Nierenfunktion verlangsamen und das Auftreten von Herz-Kreislauf-Komplikationen hinauszögern.
Quelle: Statement zum Welt-Nieren-Tag 2007, Internationale Gesellschaft für Nephrologie, Internationaler Dachverband der Nierenstiftungen.[1]
Aufgaben der Niere
Neben der Entfernung von Stoffwechselgiften aus dem Körper hat eine gesunde Niere eine Reihe weiterer lebensnotwendiger Aufgaben.
- Regelung des Flüssigkeitshaushaltes durch Steuerung der Wasserausscheidung.
- Regelung des Elektrolythaushaltes durch Steuerung der Konzentration von Ionen wie Natrium, Kalium, Calcium und Phosphat in den Körperflüssigkeiten.
- Regelung des Säure-Basen-Haushaltes durch Steuerung der Säureausscheidung.
- Entfernung von Medikamenten und Giften aus dem Körper.
- Abgabe von Hormonen in das Blut, welche den
- Blutdruck (Renin),
- die Bildung roter Blutkörperchen (Erythropoetin (EPO)) und den
- Knochenstoffwechsel (Vitamin D3) regulieren.
Bei Menschen mit chronischer Nierenkrankheit sind eine oder mehrere dieser Funktionen der Niere gestört.
Definition und Klassifikation
| Definition |
|---|
|
Chronische Nierenkrankheit ist definiert durch
Die Klassifikation der chronischen Nierenkrankheit beruht auf
|
Eine chronische Nierenkrankheit liegt nach der Definition der KDIGO vor, wenn Abweichungen von der normalen Struktur oder Funktion der Nieren mit negativen Auswirkungen auf den Gesundheitszustand länger als 3 Monate bestehen.[2]
Klassifiziert wird die chronische Nierenerkrankung durch Angabe der Grunderkrankung, der glomerulären Filtrationsrate und der Albuminausscheidung.
Grunderkrankung
Zu einer chronischen Nierenkrankheit können sowohl primäre Erkrankungen der Niere führen als auch Systemerkrankungen, welche sekundäre Erkrankungen der Nieren nach sich ziehen. Beispiele für primäre Nierenkrankheiten sind die Glomerulonephritiden (Entzündungen der Nierenkörperchen) oder tubulo-interstitielle Nephritiden (Entzündungen von Nierenkanälchen und Nieren-Bindegewebe). Beispiele für sekundäre Nierenschäden und zugleich die häufigsten Nierenerkrankungen in den Industrienationen sind diabetische Nephropathie (Nierenschädigung bei Diabetes mellitus) und Nephrosklerose (Nierenschädigung bei Bluthochdruck). Auch systemische entzündliche Erkrankungen (z. B. Lupus erythematodes) oder genetische Erkrankungen (z. B. Zystennieren) können eine chronische Nierenkrankheit hervorrufen. Im Gegensatz dazu sind einfache Nierenzysten zwar strukturelle Norm-Abweichungen. Sie haben aber keine Auswirkungen auf den Gesundheitszustand und rechtfertigen daher nicht die Diagnose einer chronischen Nierenkrankheit.
Glomeruläre Filtrationsrate
Die glomeruläre Filtrationsrate (GFR) ist das wichtigste Maß für die Ausscheidungsfunktion der Nieren. Sie kann mit Hilfe von Näherungsformeln aus einem Blutwert, zum Beispiel aus der Kreatinin-Konzentration, berechnet werden. Kreatinin ist ein Abfallprodukt des Muskelstoffwechsels. Die Kreatinin-Konzentration kann leicht im Blut bestimmt werden. Sinkt die Ausscheidungsfunktion der Niere ab, steigt die Kreatinin-Konzentration im Blut an. Bei jungen gesunden Erwachsenen liegt die glomeruläre Filtrationsrate bei ca. 125 ml/min. Eine chronische Nierenkrankheit liegt vor, wenn die glomeruläre Filtrationsrate unter 60 ml/min gesunken ist.
Albuminausscheidung
Bei einer Schädigung der Blut-Harn-Schranke im Nierenkörperchen kommt es zum Übertritt von Proteinen aus dem Blut in den Urin. Albumin ist ein Plasmaprotein, welches beim Gesunden in Spuren im Urin nachgewiesen werden kann. Dazu wird die Albumin-Konzentration im Urin bestimmt und auf die gleichzeitig gemessene Kreatinin-Konzentration im Urin bezogen. Bei chronischen Nierenkrankheiten steigt die Albuminausscheidung häufig an. Eine chronische Nierenkrankheit liegt vor, wenn der Albumin-Kreatinin-Quotient im Urin mehr als 30 mg/g beträgt. Diese abnormal gesteigerte Albuminausscheidung wird als Albuminurie bezeichnet. Eine Albuminurie kann im Verlauf einer chronischen Nierenerkrankung der Einschränkung der glomerulären Filtrationsrate vorangehen.
CGA-Klassifizierung
Die CGA-Klassifizierung der chronischen Nierenkrankheiten erfolgt nach Grunderkrankung (Causa), glomerulärer Filtrationsrate und Albuminurie. Die glomeruläre Filtrationsrate wird in sechs Kategorien (G1–5) eingeteilt, die Albuminurie in drei (A1–3).
| Chronische Nierenkrankheit
Kategorien der glomerulären Filtrationsrate (GFR) und der Albuminausscheidung KDIGO 2012[2] |
Albuminurie Kategorien | |||||
| A1 | A2 | A3 | ||||
|---|---|---|---|---|---|---|
| Normal bis leicht erhöht | Moderat erhöht | Stark erhöht | ||||
| <30 mg/g | 30–300 mg/g | >300 mg/g | ||||
| GFR-Kategorien
(ml/min/1,73 m²) |
G1 | Normal oder hoch | ≥90 | 55,6 | 1,9 | 0,4 |
| G2 | Mild eingeschränkt | 60–89 | 32,9 | 2,2 | 0,3 | |
| G3a | Mild bis moderat eingeschränkt | 45–59 | 3,6 | 0,8 | 0,2 | |
| G3b | Moderat bis schwer eingeschränkt | 30–44 | 1,0 | 0,4 | 0,2 | |
| G4 | Schwer eingeschränkt | 15–29 | 0,2 | 0,1 | 0,1 | |
| G5 | Nierenversagen | <15 | 0,0 | 0,0 | 0,1 | |
| Grün: Niedriges Risiko; wenn keine zusätzlichen krankheitsrelevanten Auffälligkeiten in Struktur oder Funktion der Nieren vorliegen, besteht kein Anhalt für das Vorliegen einer chronischen Nierenkrankheit. Gelb: Moderat erhöhtes Risiko. Orange: Hohes Risiko. Rot: Sehr hohes Risiko. Die Ziffern in den Feldern geben den prozentualen Anteil an der erwachsenen US-Bevölkerung an, für Deutschland existieren keine vergleichbaren Zahlen. | ||||||
Glomeruläre Filtrationsrate und Albuminurie sind voneinander unabhängige prognostische Parameter, d. h., mit abnehmender glomerulärer Filtrationsrate und zunehmender Albuminausscheidung steigt das Risiko, dass die chronische Nierenerkrankung einen ungünstigen Verlauf nimmt und dass Komplikationen, insbesondere im Bereich des Herz-Kreislauf-Systems, auftreten.
Ursachen von chronischem Nierenversagen
Die häufigsten Ursachen eines chronischen Nierenversagens sind Diabetes und Bluthochdruck. In Deutschland wurden zwischen 1994 und 2007 durch das Projekt QuaSi-Niere (Qualitätssicherung in der Nierenersatztherapie) statistische Daten von Patienten erhoben, die mit einer chronischen Nierenersatztherapie (Dialyse bzw. Nierentransplantation) behandelt werden. Seit 1997 wurden jährlich die Ursachen erfasst, die bei diesen Patienten zum chronischen Nierenversagen geführt haben. Im Erfassungszeitraum waren dabei deutliche Verschiebungen zu beobachten.
| Prozentuale Diagnosenverteilung bei Beginn einer Nierenersatz-Therapie in Deutschland[3] | |||||||||
| Jahr | 1996 | 1997 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 |
|---|---|---|---|---|---|---|---|---|---|
| Diabetes mellitus Typ 2 | 24 | 29 | 30 | 31 | 32 | 32 | 33 | 31 | 32 |
| Nephrosklerose (Hochdruck) | 14 | 16 | 16 | 15 | 17 | 18 | 20 | 22 | 23 |
| Glomerulonephritis | 16 | 15 | 14 | 15 | 14 | 14 | 14 | 12 | 13 |
| Interstitielle Nephritis | 13 | 11 | 11 | 10 | 9 | 9 | 8 | 8 | 8 |
| unbekannte Genese | 11 | 9 | 10 | 9 | 10 | 9 | 9 | 9 | 8 |
| Zystennieren | 6 | 6 | 6 | 6 | 6 | 5 | 5 | 5 | 4 |
| Systemerkrankungen* | 4 | 4 | 4 | 4 | 3 | 4 | 4 | 4 | 4 |
| Verschiedenes | 4 | 4 | 3 | 4 | 4 | 4 | 4 | 4 | 4 |
| Diabetes mellitus Typ 1 | 7 | 6 | 6 | 5 | 4 | 4 | 3 | 3 | 3 |
| angeborene Krankheiten | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| *) Unter Systemerkrankungen mit Nierenbeteiligung werden zusammengefasst:
Lupusnephritis, Goodpasture-Syndrom, Monoklonale Gammopathien, Amyloidose, Vaskulitiden (Mikroskopische Polyangiitis, Granulomatose mit Polyangiitis, Churg-Strauss-Syndrom), Antiphospholipid-Syndrom, Hämolytisch-urämisches Syndrom, Thrombotisch-thrombozytopenische Purpura. | |||||||||
Die Tabelle zeigt: Angeborene Nierenerkrankungen, Glomerulonephritis, interstitielle Nephritis und Systemerkrankungen sind nur selten Ursache einer dialysepflichtigen Niereninsuffizienz, ihr Anteil nimmt aufgrund immer besserer Behandlungsmöglichkeiten ab. Nierenschäden durch Diabetes mellitus Typ 2 und Bluthochdruck nehmen dagegen zu. So ist bei Menschen mit metabolischem Syndrom, einer Kombination aus Übergewicht, Fettstoffwechselstörung, gestörter Glukoseverwertung und Bluthochdruck, das Risiko einer chronischen Nierenerkrankung deutlich erhöht.[4]
Eine seltene Ursache einer chronischen Niereninsuffizienz ist das nur teilweise Mitwachsen eines Spenderherzens, das einem Kleinkind implantiert wurde; das im Alter relativ zu kleine Herz verursacht eine Herz- und damit eine Niereninsuffizienz im Sinne eines kardiorenalen Syndroms. Als Risikofaktor angesehen wird auch eine zu hohe Fluoridbelastung.[5]
Das British Medical Journal berichtet über einen Einzelfall einer hypothetischen Herz- und Niereninsuffizienz nach übermäßigem Genuss von Energydrinks über zwei Jahre. Eine angedachte Doppeltransplantation von Herz und Niere war nach Umstellung des Trinkverhaltens nicht erforderlich.[6]
Epidemiologie und volkswirtschaftliche Bedeutung
| Stadium | GFR | Prävalenz (USA) |
|---|---|---|
| 1 | > 89 | 1,8 % |
| 2 | 60–89 | 3,2 % |
| 3 | 30–59 | 7,7 % |
| 4 | 15–29 | 0,4 % |
Die Prävalenz der chronischen Nierenerkrankung betrug in den USA im Zeitraum von 1988 bis 1994 bei Erwachsenen 10 % und stieg 1999–2004 auf 13,1 % an. 1999–2004 lag bei den 20- bis 39-Jährigen die Prävalenz der Stadien 1 und 2 bei 3 %, die der Stadien 3 und 4 bei 0,7 %. Mit zunehmendem Lebensalter stieg die Prävalenz der chronischen Nierenkrankheit massiv an und lag bei den über 70-Jährigen im Stadium 1 und 2 bei 10 %, im Stadium 3 und 4 bei 38 % (Abb.[7]). Neben dem Alter sind Diabetes und Bluthochdruck die wichtigsten Risikofaktoren für eine chronische Nierenerkrankung. In der Gruppe der 20- bis 59-Jährigen betrug die Prävalenz der chronischen Nierenkrankheit 8,2 %, wenn weder Diabetes noch Bluthochdruck vorlagen; 15,2 %, wenn nur Bluthochdruck bestand; 33,8 %, wenn nur Diabetes vorlag; und 43 % bei Patienten, die sowohl an Diabetes als auch an Bluthochdruck litten.[8]
Im Stadium 3 war nur 12 % der Männer und 6 % der Frauen bewusst, dass sie an einer Nierenkrankheit litten, im Stadium 4 wussten nur 42 % der Betroffenen von ihrer Erkrankung.[9]
In Deutschland gibt die QuaSi-Niere für das Jahr 2005 eine Prävalenz von 769 Dialysepatienten und 288 Nierentransplantierten pro Million Einwohner an, dies entspricht 63.427 Dialysepatienten und 23.724 Nierentransplantierten. Seit 1995 ist die Zahl der Dialysepatienten um 53 % gestiegen, die der Nierentransplantierten um 78 %. Dieser Anstieg ist ausschließlich in der Altersklasse der über 65-Jährigen erfolgt. In der Altersklasse der unter 65-Jährigen sind Inzidenz und Prävalenz der chronischen Nierenersatztherapie stabil geblieben. Es gibt in Deutschland keine Zahlen zur Prävalenz der Stadien 1–4 einer chronischen Nierenkrankheit.
Durch die hohe Rate an Herz-Kreislauf-Komplikationen und durch die Notwendigkeit von teuren Nierenersatzverfahren (Dialyse und Nierentransplantation) im Stadium 5 entstehen durch das chronische Nierenversagen hohe Kosten für das Gesundheitssystem. Wenn man annimmt, dass die Dialysebehandlung im Jahr ca. 50.000–60.000 Euro pro Patient kostet, wurden in Deutschland im Jahr 2005 allein für die Dialysebehandlung über 3 Milliarden Euro ausgegeben. Über die Folgekosten der Stadien 1–4 gibt es keine Zahlen. Aufgrund des demographischen Wandels wird es in den kommenden Jahren zu einer erheblichen Zunahme an alten nierenkranken Menschen kommen, die an einer Vielzahl gravierender Begleit- und Folgeerkrankungen leiden und die Gesundheitssysteme vor erhebliche Herausforderungen stellen werden.[10]
Natürlicher Verlauf, Folgekrankheiten und Komplikationen
Der Normalwert der glomerulären Filtrationsrate (GFR) hängt ab von Alter, Geschlecht und Körpergröße. Beim jungen Erwachsenen liegt der Normalwert der GFR zwischen 120 und 130 ml/min. Bei Frauen ist die GFR um ca. 8 % niedriger als bei Männern. Ab dem 20. bis 30. Lebensjahr nimmt die GFR jährlich um ca. 1 ml/min ab. Im Alter von 70 Jahren liegt der Normalwert der GFR im Mittel bei ca. 70 ml/min mit einem breiten Schwankungsbereich.
Bei den meisten Patienten mit chronischer Nierenkrankheit nimmt die Nierenfunktion im Lauf der Zeit ab. Die Mehrheit der Personen mit chronischer Nierenkrankheit sind ältere Personen mit frühen Stadien der Nierenfunktionseinschränkung.[11] Nur 2–3 % dieser Personen werden ein terminales Nierenversagen entwickeln.[12] Der Verlauf einer chronischen Nierenkrankheit hängt ab
- von der GFR zum Zeitpunkt der Diagnose und
- vom Abfall der GFR über die Zeit, der Progression. Das Maß der Progression ist der jährliche Abfall der GFR, ausgedrückt in ml/min pro Jahr.
Die Progression einer Nierenkrankheit ist für einen individuellen Patienten über die Zeit meist relativ konstant, kann zwischen verschiedenen Patienten aber stark schwanken. Ein langsam progressiver Verlauf kann sich über Jahrzehnte erstrecken, ein rasch progressiver Verlauf kann innerhalb von Monaten zum Endstadium des dialysepflichtigen Nierenversagens führen.
Die Progression hängt ab
- von der Grunderkrankung: Bei diabetischer Nephropathie, Glomerulonephritis, Zystennierenerkrankung und Nierenerkrankung bei Transplantatempfängern ist die Progression rascher als bei Nierenerkrankung durch Bluthochdruck und bei interstitieller Nephritis.
- von nicht beeinflussbaren Faktoren: Bei Menschen mit schwarzer Hautfarbe, schlechterer Nierenfunktion zum Zeitpunkt der Diagnose, Männern und älteren Patienten ist die Progression rascher.
- von beeinflussbaren Faktoren: Eine raschere Progression findet sich bei hoher Eiweißausscheidung im Urin (Proteinurie), niedrigem Albumin im Serum, hohem Blutdruck, schlechter Blutzuckereinstellung bei Diabetikern und bei Rauchern.
- Der Einfluss von erhöhten Blutfetten und Blutarmut auf die Progression ist nicht geklärt.
| GFR | Herz-Kreislauf-Komplikationen | Sterblichkeit |
|---|---|---|
| >60 | 2,11 | 0,76 |
| 45–59 | 3,65 | 1,08 |
| 30–44 | 11,29 | 4,76 |
| 15–29 | 21,80 | 11,36 |
| <15 | 36,60 | 14,14 |
| ml/min | pro 100 Personen-Jahre[13] | |
Mit zunehmender Einschränkung der Nierenfunktion treten Folgekrankheiten in mehreren Organsystemen auf:
- Bluthochdruck. Etwa 55–75 % aller Menschen mit einer eingeschränkten Nierenfunktion leiden an Bluthochdruck. Ein vorbestehender Bluthochdruck kann Ursache der Nierenfunktionseinschränkung sein. Die eingeschränkte Nierenfunktion führt ebenfalls zu Bluthochdruck, Ursachen sind eine Flüssigkeitsüberladung, eine Aktivierung des Renin-Angiotensin-Aldosteron-Systems, eine Aktivierung des sympathischen Nervensystems, eine Verkalkung des arteriellen Gefäßsystems incl. der Nierengefäße sowie Störungen im Stoffwechsel mit einer Vielzahl weiterer Faktoren (Prostaglandine, Bradykinine, Endothelin, Stickstoffmonoxid). Bluthochdruck ist eine wichtige Ursache für das bei Nierenkranken erheblich erhöhte Herz-Kreislauf-Risiko.
- Störungen des Knochenstoffwechsels. Ursache sind Veränderungen des Vitamin-D-Stoffwechsels, eine verminderte Aufnahme von Calcium über den Darm und eine verminderte Ausscheidung von Phosphat über die Niere. Folgen sind verminderte Calcium- und Vitamin-D-Spiegel im Blut, erhöhte Spiegel von Phosphat und Parathormon, ein vermehrter Knochenumbau sowie Weichteilverkalkungen, die auch die Koronargefäße und Herzklappen betreffen.
- Störungen der Blutbildung. Eine verminderte Produktion des Hormons Erythropoetin durch die Niere führt zu Anämie infolge verminderter Bildung von roten Blutkörperchen im Knochenmark.
- Störungen des Elektrolythaushaltes. Bei fortgeschrittener Nierenfunktionseinschränkung kann es zu einem Anstieg des Kalium-Spiegels im Blut infolge verminderter Ausscheidung kommen. Im Extremfall kann dies zu tödlichen Herzrhythmusstörungen führen.
- Störungen des Säure-Basen-Haushaltes. Die verminderte Ausscheidung von Protonen führt zu einer Übersäuerung des Blutes (Azidose). Die Azidose führt zu einem Verlust an Knochensubstanz.
- Überwässerung. Aufgrund einer verminderten Ausscheidung von Wasser kann es zur vermehrten Wassereinlagerung in Geweben (Ödemen) und in der Lunge kommen.
- Auftreten weiterer körperlicher und geistiger Funktionseinschränkungen wie Abnahme der geistigen Leistungsfähigkeit[14][15] und erhöhtes Risiko einer altersabhängigen Makuladegeneration.[16]
- Störungen des Immunsystems: Patienten mit präterminalem oder terminalem Nierenversagen sind von einer Immunschwäche mit multifaktorieller Ursache betroffen: Erstens belastet die chronische Erkrankung das Immunsystem anhaltend, zweitens kommen nach einer Transplantation häufig immunsuppressive Medikamente zum Einsatz, drittens stört die Dialysebehandlung die Immunabwehr zusätzlich und erhöht das Infektionsrisiko. Insgesamt sind die Patienten anfälliger für opportunistische Infektionen, die durch Viren, Bakterien, Pilze oder Parasiten ausgelöst werden. Außerdem gilt: Je geschwächter das Immunsystem der Betroffenen, desto höher die Wahrscheinlichkeit eines schweren bis tödlichen Verlaufs einer solchen Krankheit. Beispielsweise steigt mit zunehmender Nierenfunktionseinschränkung das Risiko, an einer Lungenentzündung zu erkranken bzw. daran zu versterben, bis auf das 15-fache an.[17] Gleichzeitig nimmt die Ansprechrate auf verschiedene Impfungen ab, sodass gegebenenfalls mit Booster-Impfungen ein ausreichender Schutz sichergestellt werden muss.[18][19]
Ab dem Stadium 3 ist das Risiko eines akuten Nierenversagens erhöht, insbesondere wenn zusätzlich Diabetes, Bluthochdruck oder eine erhöhte Eiweißausscheidung vorliegen.[20]
| KDOQI-Stadium | Dialysebeginn | Sterblichkeit | |
|---|---|---|---|
| 2 | 1,1 % | 19,5 % | |
| 3 | 1,3 % | 24,3 % | |
| 4 | 19,9 % | 45,7 % | |
| innerhalb von 5 Jahren[21] | |||
Im Stadium 5 des chronischen Nierenversagens treten zunehmend Komplikationen der Harnvergiftung (Urämie) auf: Gewichtsverlust und Unterernährung aufgrund von Appetitlosigkeit, Übelkeit und Erbrechen, Flüssigkeitsüberladung, Blutungsneigung, Herzbeutelentzündung, Depression, Abnahme der körperlichen Leistungsfähigkeit, Schäden des peripheren Nervensystems, Unfruchtbarkeit und erhöhte Infektanfälligkeit. Auffällig ist der harnartige Mundgeruch (Foetor uraemicus).
Haupttodesursache für alle Patienten mit chronischem Nierenversagen sind Herz-Kreislauf-Krankheiten wie koronare Herzkrankheit, linksventrikuläre Hypertrophie, Gefäßverkalkungen und Herzschwäche. Zweithäufigste Todesursache bei Dialysepatienten sind opportunistische Infektionen, besonders
mit Pneumokokken und Influenza-Viren.[22] Vor allem bei älteren Patienten ist die Wahrscheinlichkeit, an Komplikationen des Herz-Kreislauf-Systems zu versterben, viel höher als die Wahrscheinlichkeit, an die Dialyse zu kommen (Abb.[23]). Die Sterblichkeit (Mortalität) ist bereits bei geringer Einschränkung der Nierenfunktion deutlich erhöht und steigt mit zunehmender Nierenfunktionseinschränkung exponentiell an.[24] Unabhängig vom Grad der Nierenfunktionseinschränkung steigt die Mortalität auch mit zunehmender Urin-Eiweiß-Ausscheidung (Proteinurie).[25] Von besonderer Wichtigkeit ist in allen Stadien einer chronischen Nierenkrankheit daher die Vorbeugung gegen Erkrankungen des Herz-Kreislauf-Systems.
Die erhöhte Erkrankungs- und Sterberate an Herz-Kreislauf-Erkrankungen bei Patienten mit chronischer Nierenkrankheit erklärt sich nur teilweise durch das vermehrte Vorkommen von traditionellen kardiovaskulären Risikofaktoren (Herz-Kreislauf-Risikofaktoren). Zusätzlich treten bei chronischer Nierenkrankheit nicht-traditionelle Risikofaktoren[26] auf, die mit der eingeschränkten Nierenfunktion oder deren Behandlung zusammenhängen.
| Traditionelle Risikofaktoren | Nicht-traditionelle Risikofaktoren | |
|---|---|---|
|
Biochemische Faktoren
Pathologische Prozesse
|
Herzmuskelverdickung begünstigende Faktoren
|
Symptome von chronischem Nierenversagen
In den Stadien 1–4 verläuft eine chronische Nierenkrankheit meist ohne jegliche Symptome. Eine hohe Eiweißausscheidung im Urin kann zum Schäumen des Urins und zu Wassereinlagerungen führen. Eine sehr hohe Ausscheidung von roten Blutkörperchen (Makrohämaturie) kann sich in einer Braunverfärbung des Urins äußern und weist meist auf Erkrankungen der ableitenden Harnwege hin, seltener auf eine Blutung bei Zystennieren oder eine IgA-Nephropathie. Schmerzen in der Nierengegend weisen auf Wirbelsäulen- und Bandscheibenprobleme, Nierensteine, eine Nierenbeckenentzündung, akute Komplikationen einer Zystennierenerkrankung sowie sehr selten auf eine akute Glomerulonephritis hin. Eine chronische Nierenkrankheit verläuft dagegen in der Regel schmerzfrei.
Im fortgeschrittenen Stadium 4 und im Stadium 5 kommt es zu einer zunehmenden Einschränkung der körperlichen und geistigen Leistungsfähigkeit, Appetitlosigkeit, Erbrechen und Übelkeit, Wassereinlagerungen, Atemnot und Hautveränderungen.[27] Bei weit fortgeschrittener Nierenfunktionseinschränkung können Krampfanfälle auftreten.
Therapie
Behandlungsziele bei chronischen Nierenkrankheiten sind
- bei Risikogruppen die Vorbeugung und insbesondere die frühzeitige Erkennung und konsequente Behandlung von Diabetes und Bluthochdruck,
- im Stadium 1 und 2
- die frühzeitige Erkennung einer Nierenerkrankung und
- die Behandlung der unterschiedlichen Grunderkrankungen
- im Stadium 2 bis 4
- die Verhinderung und Behandlung von Herz-Kreislauf-Komplikationen und
- die Hemmung der Progression
- im Stadium 3 bis 5 die Behandlung von Komplikationen und Folgekrankheiten
- im Stadium 5 Dialyse und Nierentransplantation, bzw. supportive Therapie, falls ein Nierenersatzverfahren nicht möglich ist.
Vorbeugung gegen chronisches Nierenversagen
Die Vorbeugung gegen chronische Nierenkrankheiten vermindert möglicherweise die Anzahl potentieller Dialysepatienten und reduziert die Morbidität und Mortalität an Herz-Kreislauf-Komplikationen.[28]
Früherkennung
Chronische Nierenerkrankungen verlaufen in den frühen Stadien ohne Beschwerden. Aus diesem Grund wurden in mehreren Staaten Früherkennungsuntersuchungen durchgeführt, so in den USA (NHANES III), Australien (AusDiab Study), Japan (Okinawa Screening Program), den Niederlanden (PREVEND Study), Island, Indien und Singapur. Als Früherkennungsuntersuchungen eingesetzt wurden der Nachweis von Eiweiß und Albumin im Urin sowie die Kreatinin-Bestimmung im Blut. Durch gesetzlich vorgeschriebene Früherkennungsmaßnahmen konnte in Japan bei jungen Erwachsenen die Häufigkeit fortschreitender entzündlicher Nierenerkrankungen (progressiver Glomerulonephritiden) vermindert werden, das mittlere Alter zum Zeitpunkt des Dialysebeginns hat in Japan im gleichen Zeitraum signifikant zugenommen.[29]
Veränderung von Lebensgewohnheiten
Bluthochdruck und Diabetes sind die häufigsten Ursachen des chronischen Nierenversagens. Gesicherte Allgemeinmaßnahmen zur Vorbeugung sind:
- Reduktion von Übergewicht,
- regelmäßige körperliche Betätigung,
- Reduktion des Kochsalzkonsums,
- Ernährung mit reichlich Früchten und Gemüse sowie wenig gesättigtem Fett,
- Nikotinverzicht[30] und
- Reduktion des Alkoholkonsums.
Im Gegensatz zu einer weit verbreiteten Ansicht kann reichliches Trinken zwar das Risiko für Nierensteine vermindern, es verbessert aber nicht die Nierenfunktion. Es gibt sogar Hinweise, dass das Trinken von großen Flüssigkeitsmengen die Progression chronischer Nierenkrankheiten beschleunigen kann.[31]
Medikamentöse Maßnahmen
Eine frühzeitige Erkennung und konsequente medikamentöse Behandlung von Diabetes und Bluthochdruck können die Entstehung einer chronischen Nierenkrankheit verhindern.
Medikamentöse Therapie
Im August 2021 wurde das orale Antidiabetikum Dapagliflozin auch zur Behandlung der chronischen Niereninsuffizienz Erwachsener unabhängig vom Vorliegen einer Zuckerkrankheit zugelassen. Von der Einnahme wird jedoch abgeraten, wenn die glomeruläre Filtrationsrate kleiner als 25 ml/min ist. „Der Wirkmechanismus bei Niereninsuffizienz ist nicht vollständig geklärt. Er könnte auf Natriurese und Glukose-induzierter osmotischer Diurese mit vermindertem intraglomerulären Druck beruhen.“[32]
Progressionshemmung
Chronische Nierenkrankheiten neigen zur kontinuierlichen Verschlechterung. Ziel der Behandlung ist daher, die Progression zu hemmen, d. h. den jährlichen Nierenfunktionsverlust zu mindern.[33]
Patienten mit chronischer Nierenkrankheit sollten Medikamente meiden, die für die Niere schädlich sein können, dazu zählen z. B.
- nichtsteroidale Antiphlogistika, darunter die am weitesten verbreiteten Schmerzmedikamente wie Diclofenac oder Ibuprofen;
- jodhaltige Röntgenkontrastmittel;
- Aminoglykoside, eine ganz bestimmte Gruppe von Antibiotika.
Eine medikamentöse Senkung des Blutdruckes hemmt die Progression, als Ziel der Blutdruckbehandlung werden Blutdruckwerte unter 130/80 mmHg angegeben. Es gibt Hinweise darauf, dass von dieser intensiven Blutdrucksenkung (gegenüber einem Standard-Zielblutdruck von 140/90 mmHg) nur die Patienten profitieren, bei denen auch eine signifikante Proteinurie (Urin-Eiweiß-Ausscheidung) nachweisbar ist; bislang liegen aber nur Daten zu Amerikanern schwarzafrikanischer Herkunft vor.[34] Meist sind mehrere Hochdruckmedikamente in Kombination erforderlich, um eine intensive Blutdrucksenkung zu erreichen.
Bei Patienten mit diabetischer Nephropathie oder erhöhter Eiweißausscheidung im Urin[35] können ACE-Hemmer oder AT1-Antagonisten, zwei verwandte Klassen blutdrucksenkender Medikamente, die Progression in besonderem Maße hemmen. Ziel der Behandlung ist, die Urin-Eiweiß-Ausscheidung auf Werte unter 500–1000 mg pro Tag zu senken. Um dies zu erreichen, muss unter Umständen ein niedrigerer Zielblutdruck als 130/80 mmHg angestrebt werden. Gelingt es nicht, die Proteinurie ausreichend zu senken, werden ACE-Hemmer und AT1-Antagonisten auch in Kombination[36] oder in sehr hoher Dosierung[37] eingesetzt, ggf. sogar zusätzlich mit Aldosteronantagonisten[38] kombiniert. Da diese Medikamente oftmals nur zur Behandlung des Bluthochdrucks zugelassen wurden, handelt es sich bei der Behandlung häufig um einen sogenannten Off-Label-Use, das heißt, um einen Medikamenteneinsatz außerhalb der eigentlichen Zulassung. Diese Art der Kombinationsbehandlung darf nur bei Erkrankungen mit großer Proteinurie eingesetzt werden und muss engmaschig überwacht werden,[39] in der Routinebehandlung des Bluthochdrucks bringt die Kombination aus ACE-Hemmer und AT1-Antagonist keinen zusätzlichen Nutzen und ist sogar mit erhöhten Komplikationsraten behaftet.[40]
Die Eiweißzufuhr mit der Nahrung (siehe Ernährung bei Niereninsuffizienz) sollte moderat eingeschränkt werden. Empfohlen wird, am Tag 0,8–1 g Eiweiß pro Kilogramm Körpergewicht zu sich zu nehmen. Eine strenge Einschränkung der Proteinzufuhr bringt keinen zusätzlichen Nutzen.[41]
Es gibt Hinweise darauf, dass eine medikamentöse Senkung der Blutfette[42] und eine Behandlung der Übersäuerung mit Natron[43] die Progression hemmen können.
Für alle Maßnahmen gilt, je früher im Verlauf einer Nierenkrankheit damit begonnen wird, desto größer ist die Aussicht auf Erfolg.
Impfempfehlungen
Personen mit chronischem Nierenversagen sind aufgrund der Erkrankung sowie der Behandlungsmethoden wie Hämodialyse von einer Immunschwäche betroffen. Im Falle einer Nierentransplantation kommt eine immunsuppressive Therapie zum Einsatz, welche Abstoßungsreaktionen vermeiden soll. Durch die Behandlung wird das Immunsystem noch weiter geschwächt und die Empfänglichkeit für Infektionskrankheiten ist hoch. Deshalb zählt die Ständige Impfkommission (STIKO) am Robert Koch-Institut (RKI) Personen mit chronischer Niereninsuffizienz zu den Risikopatienten für Infektionskrankheiten.[19]
Hinzu kommt, dass einige Infektionskrankheiten Abstoßungen und Versagen eines Transplantats auslösen können. Die STIKO rät daher, die altersentsprechenden Standardimpfungen zu vervollständigen und regelmäßig zu aktualisieren.[18][19] Zusätzlich hat die STIKO gemeinsam mit verschiedenen medizinischen Fachgesellschaften Anwendungshinweise zu Indikationsimpfungen für Patienten mit Immunschwäche herausgegeben: Insbesondere Totimpfstoffe gelten als gut verträglich für immungeschwächte Personen, da hier in der Regel kein erhöhtes Risiko für unerwünschte Nebenwirkungen besteht. Hierzu gehören Impfstoffe gegen Influenza, Herpes Zoster, Pneumokokken und Meningokokken der Gruppen ACWY und B. Lebendimpfstoffe wie etwa gegen Gelbfieber- oder Rotaviren sollten Nieren-Patienten dagegen nur nach individueller ärztlicher Risiko-Nutzen-Abschätzung gegeben werden.[18][44]
Bei Personen mit chronischer Nierenerkrankung, insbesondere bei solchen mit Dialysebehandlung, fällt die Immunantwort auf Impfungen teilweise schwächer aus oder hält kürzer an als bei immungesunden Personen. Deshalb sollte der Impferfolg mit einem Antikörpertest überprüft und gegebenenfalls mit einer Auffrischungsimpfung unterstützt werden.[18][44]
Als Infektionsprävention gegen Erkrankungen, deren Impfung für Nieren-Patienten nicht möglich ist, gilt außerdem der vollständige Impfschutz direkter Kontaktpersonen. Letztlich sollten auch potenzielle Organspender vollständig geimpft sein, um Risiken der Ansteckung über das Transplantat zu verringern.
Behandlung von Folgekrankheiten
| Definitionen der KDIGO
(Kidney Disease Improving Global Outcomes)[45] |
|---|
| Mineral- und Knochenstoffwechselstörung
bei chronischer Nierenerkrankung: |
| Systemische Störung des Mineral- und Knochenstoffwechsels bei
chronischer Nierenerkrankung, die sich manifestiert durch |
| 1. Veränderungen des Calcium-, Phosphat-, Parathormon oder
Vitamin-D-Stoffwechsels und/oder |
| 2. Veränderungen im Umsatz, Volumen, Wachstum oder
Stärke des Knochens und/oder |
| 3. Weichteil- oder Gefäßverkalkungen. |
| Renale Osteodystrophie: |
| Veränderungen der Knochenstruktur (Morphologie)
bei chronischer Nierenerkrankung, die nachgewiesen wird durch |
| quantitative feingewebliche Untersuchung einer
Knochenprobe (Histomorphometrie einer Knochenbiopsie). |
Pathogenese
Ab dem Stadium 3 der chronischen Nierenkrankheit sinkt die Ausscheidung von Phosphat in den Urin. Dies führt zu einem Anstieg des Phosphatspiegels im Blut (Hyperphosphatämie). Als Reaktion darauf wird von der Nebenschilddrüse vermehrt Parathormon in das Blut abgegeben (Hyperparathyreoidismus); die Osteoblasten des Knochens produzieren vermehrt Fibroblast Growth Factor 23 (FGF-23). In der Niere nimmt die Aktivierung von 25(OH)Vitamin D3 zu Calcitriol ab, der Calcitriol-Spiegel im Blut sinkt, die Calcium-Aufnahme im Darm nimmt ab, der Calcium-Spiegel im Blut sinkt, dies wiederum stimuliert die Freisetzung von Parathormon. In der gesunden Niere würde der Anstieg von Parathormon eine vermehrte Ausscheidung von Phosphat und eine vermehrte Rückgewinnung (Rückresorption) von Calcium aus dem Filtrat des Nierenkörperchens (Primärharn) bewirken; FGF-23 würde ebenfalls die Phosphatausscheidung stimulieren. Die Folge wären ein Abfall des Phosphat-Spiegels und ein Anstieg des Calciums im Blut. Die geschädigte Niere kann jedoch nicht adäquat auf Parathormon und FGF-23 reagieren, ein Anstieg von Phosphatausscheidung und Calciumrückresorption bleibt aus. Der erhöhte Parathormonspiegel führt jedoch zur Freisetzung von Calcium und Phosphat aus den Knochen, der Knochenumbau nimmt zu, die Knochensubstanz nimmt ab, die Gefahr von Knochenbrüchen steigt. Mit weiter sinkender Nierenfunktion steigt der Phosphatspiegel im Blut zunehmend an, es kommt zur aktiven Ablagerung von Calcium-Phosphat in den Weichteilen. Gefäße und Weichteilgewebe verkalken, Durchblutungsstörungen, Herz-Kreislauf-Komplikationen und eine verminderte Lebenserwartung sind die Folge. Diese Kombination aus Knochenstoffwechselstörung und Gefäßverkalkung wird neuerdings als Störung des Mineral- und Knochenstoffwechsels bei chronischer Nierenerkrankung oder CKD-MBD (Chronic Kidney Disease-Mineral and Bone Disorder) bezeichnet.
Diagnostik
Die KDIGO-Leitlinien geben Untersuchungsintervalle und Zielwerte vor, die jeweils vom Krankheitsstadium abhängen. Zu regelmäßigen Bestimmungen von Calcium, Phosphat, Parathormon und Alkalischer Phosphatase kann eine Bestimmung des 25(OH)Vitamin D3-Spiegels erwogen werden. Mit der Kontrolle soll bei Erwachsenen ab Stadium 3 begonnen werden.
Mineral- und Knochenstoffwechselsstörung bei chronischer Nierenkrankheit einerseits und Osteoporose bei Nierengesunden andererseits sind unterschiedliche Krankheitsbilder, die nicht verwechselt werden dürfen. Im Gegensatz zur Allgemeinbevölkerung besteht bei chronisch nierenkranken Patienten keine Beziehung zwischen Knochendichte und Risiko von Knochenbrüchen. Die routinemäßige Bestimmung der Knochendichte (Osteodensitometrie) wird bei Vorliegen einer chronischen Nierenerkrankung daher nicht empfohlen.
Zur Diagnostik von Gefäßverkalkungen wird eine konventionelle seitliche (laterale) Abdomen-Röntgenaufnahme zum Nachweis oder Ausschluss von Gefäßverkalkungen sowie eine Echokardiographie zum Nachweis oder Ausschluss von Herzklappenverkalkungen empfohlen.
Die feingewebliche Untersuchung einer Gewebeprobe des Knochens (Knochenbiopsie) wird empfohlen bei unerklärten Frakturen, anhaltenden Knochenschmerzen, unerklärter Calciumerhöhung (Hyperkalziämie), unerklärter Phosphaterhöhung (Hyperphosphatämie) oder -verminderung (Hypophosphatämie), Verdacht auf Aluminium-Überladung und vor einer Therapie mit Bisphosphonaten.
Therapie
Es wird angestrebt, Calcium- und Phosphatspiegel im Normalbereich zu halten. Bei Dialysepatienten ist es allerdings oft nicht möglich, normale Phosphatwerte zu erreichen, es wird aber angestrebt, erhöhte Phosphatwerte in Richtung Normalbereich abzusenken.
Bei erhöhten Phosphatwerten wird bislang die Phosphatzufuhr über die Nahrung eingeschränkt. Eine aktuelle Untersuchung konnte den Wert einer phosphatarmen Diät jedoch nicht belegen.[46]
Die medikamentöse Behandlung erhöhter Phosphatspiegel erfolgt mit Substanzen, welche Phosphat im Darm binden und so die Aufnahme in den Körper hemmen. Als Phosphatbinder eingesetzt werden derzeit Calcium- und Aluminium-Salze, Sevelamer (ein Polymer) und Lanthankarbonat. Bei erhöhten Calcium-Werten, arteriellen Gefäßverkalkungen, vermindertem Knochenumsatz (adynamem Knochen) und/oder erniedrigtem Parathormon werden bevorzugt calciumfreie Phosphatbinder eingesetzt, die Zufuhr calciumhaltiger Phosphatbinder wird eingeschränkt, ebenso die Gabe von Calcitriol und aktiven Vitamin-D-Abkömmlingen. Aluminium kann sich ebenfalls in den Knochen einlagern und zu einer Erkrankung des Knochens führen. Eine Langzeitbehandlung mit Aluminium-haltigen Phosphatbindern wird daher vermieden, der Aluminium-Spiegel muss regelmäßig kontrolliert werden.
| Vitamin-D-Mangel | |
|---|---|
| Vitamin-D-Defizienz | 25(OH) D3 (Calcidiol) < 10 ng/ml (25 nmol/l) |
| Vitamin-D-Insuffizienz | 25(OH) D3 (Calcidiol) 10–30 ng/ml (25–80 nmol/l) |
Die KDIGO-Leitlinien schlagen vor, einen Vitamin-D-Mangel (Vitamin-D-Defizienz, Vitamin-D-Insuffizienz) durch Gabe eines Vitamin-D-Präparates zu korrigieren, warnen aber, "der wahre Effekt kann beträchtlich vom geschätzten Effekt abweichen".
Der optimale Parathormon-Bereich ist nicht bekannt. Spricht ein erhöhtes Parathormon auf Behandlung durch Diät, Phosphatbinder, Calcium und/oder Vitamin D nicht an, oder steigt sogar weiter an, kommen aktive Vitamin-D-Metabolite zum Einsatz. Bei diesen Substanzen (Alfacalcidol, Calcitriol) ist der Stoffwechselschritt der Vitamin-D-Aktivierung, der normalerweise in der Niere abläuft, bereits erfolgt. Als Nebenwirkung wird allerdings die Calcium- und Phosphataufnahme über den Darm stimuliert. Neuerdings werden daher aktive Vitamin-D-Abkömmlinge (z. B. Paricalcitol) eingesetzt, welche die Parathormonsekretion aus der Nebenschilddrüse besonders stark hemmen und eine geringere Wirkung auf den Darm ausüben. Steigt die Konzentration von Calcium und Phosphat unter Vitamin-D-Therapie zu stark an, muss Vitamin D reduziert werden. Eine zu starke Hemmung der Parathormonsekretion sollte ebenfalls vermieden werden, da diese zu einem verminderten Knochenumbau (adyname Knochenerkrankungen) führt und Weichteilverkalkungen begünstigt.
Bei zunehmender Nierenfunktionseinschränkung ändert sich der Knochenstoffwechsel. So nimmt die Empfindlichkeit des Knochens gegenüber Parathormon ab. Aus diesem Grund versucht man bei Dialysepatienten, die Parathormon-Werte in einem Bereich zwischen ungefähr dem Zweifachen und dem Neunfachen des oberen Normalbereichs der eingesetzten Bestimmungsmethode zu halten.
Zur Behandlung erhöhter Parathormonwerte bei Dialysepatienten ist seit 2004 Cinacalcet zugelassen. Cinacalcet bindet an den Calciumrezeptor der Nebenschilddrüse, simuliert einen erhöhten Calciumspiegel und hemmt so die Parathormonsekretion. Trotz dieser Maßnahmen gelingt es manchmal nicht, ein Ansteigen des Parathormons zu verhindern. In diesem Fall müssen die Nebenschilddrüsen operativ entfernt werden.
Eine Behandlung mit Bisphosphonaten sollte bei erhöhtem Parathormon und/oder im Stadium 3–5 vermieden werden, in Zweifelsfällen sollte vor einer Bisphosphonat-Behandlung eine Knochenbiopsie erfolgen. Nach erfolgreicher Nierentransplantation und bei Behandlung mit Steroiden können dagegen eine Knochendichtemessung (Osteodensitometrie) und eine Behandlung mit Bisphosphonaten, ggf. in Kombination mit Vitamin D und aktiven Vitamin-D-Metaboliten, sinnvoll sein.[45][47]
Eine Übersäuerung des Blutes führt ebenfalls zu einem Verlust an Knochensubstanz. Die Behandlung erfolgt mit Alkalisalzen wie Citrat oder Bicarbonat. Die Gabe von Bicarbonat verlangsamt zudem möglicherweise den Nierenfunktionsverlust und verbessert den Ernährungszustand.[43]
Renale Anämie
| Ferritin-Zielbereich | |
|---|---|
| KDOQI-Stadium | Ferritin-Zielbereich |
| 3 und 4 | 100–500 ng/ml |
| 5 | 200–500 ng/ml |
Mit fortschreitender Nierenfunktionseinschränkung sinkt die Produktion des Botenstoffes Erythropoetin. Erythropoetin wird in den Nieren gebildet und steuert die Produktion der roten Blutkörperchen im Knochenmark. Die Konzentration des roten Blutfarbstoffes (Hämoglobin) nimmt daher mit zunehmender Nierenfunktionseinschränkung ab. Es kommt zur Blutarmut (renalen Anämie) mit einem Abfall der körperlichen Leistungsfähigkeit.[48][49]
Zur Diagnose und Behandlung der renalen Anämie sind regelmäßige Bestimmungen von Hämoglobin, Ferritin und Transferrinsättigung erforderlich. Bei der Erstuntersuchung sollte ein großes Blutbild incl. der Retikulozyten angefertigt werden. Eine Bestimmung des Erythropoetin-Spiegels ist nicht erforderlich. Eine Anämie liegt vor, wenn die Hämoglobinkonzentration des Blutes bei Frauen auf einen Wert unter 12,0 g/dl abgesunken ist, bei Männern unter 13,5 g/dl.
| Hämoglobin-Zielbereich | |
|---|---|
| KDOQI-Stadium | Hb-Zielbereich |
| 3 bis 5 | 11,0–12,0 g/dl |
Durch Gabe von Eisen, bei Dialysepatienten bevorzugt intravenös, werden Ferritin-Spiegel und Transferrin-Sättigung in den hochnormalen Bereich angehoben. In der Regel muss jedoch zusätzlich Erythropoetin gegeben werden, um das Hämoglobin in den Zielbereich anzuheben. Die Zielbereiche für Ferritin und Hämoglobin entsprechen dabei nicht den Normalbereichen. Die angestrebten Ferritin-Spiegel liegen höher als die Normwerte, die angestrebte Hämoglobinkonzentration liegt etwas unter dem Normalbereich. Eine Anhebung des Hämoglobin-Wertes in den Normalbereich bringt keinen zusätzlichen Nutzen, sondern führt zu vermehrtem Auftreten von Bluthochdruck, Schlaganfällen und Shunt-Thrombosen; möglicherweise nehmen auch Mortalität, Herz-Kreislauf-Komplikationen und Progression der Nierenfunktionseinschränkung zu.[50][51][52][53] Die Ursache der erhöhten Komplikationsraten bei höheren Hämoglobin-Zielwerten ist nicht bekannt. Diskutiert werden ein direkter Effekt des Hämoglobins, z. B. durch erhöhte Viskosität des Blutes, eine Nebenwirkung von Erythropoetin, eine Nebenwirkung von Eisen, der unter Erythropoetin-Behandlung erhöhte Blutdruck oder die Folge eines verminderten Ansprechens auf Erythropoetin.[54]
Blutübertragungen sind nur in seltenen Fällen erforderlich und werden nach Möglichkeit vermieden.
Vorbeugung von Komplikationen
Patienten mit chronischer Nierenkrankheit sind in erster Linie durch Herz-Kreislauf-Erkrankungen bedroht wie koronare Herzkrankheit, Herzversagen,[55] Schlaganfall[56] und arterielle Verschlusskrankheit. Die Gefahr, im Verlauf der Erkrankung von der Dialyse abhängig zu werden, ist demgegenüber deutlich geringer. Eine Nierenkrankheit im Stadium 5 ist ein kardiovaskulärer Risikofaktor, der so schwer wiegt wie ein durchgemachter Herzinfarkt;[57] die Sterblichkeit an Herz-Kreislauf-Komplikationen ist etwa 10–20 Mal höher als in der Allgemeinbevölkerung. Liegt zusätzlich ein Diabetes mellitus vor, ist die Sterblichkeit etwa 40 % höher als bei Nierenkranken im Stadium 5 ohne Diabetes.[58]
Bei Vorliegen einer chronischen Nierenkrankheit sollten daher die Blutfette Gesamt-Cholesterin, LDL-Cholesterin, HDL-Cholesterin und Triglyceride bestimmt werden. Ist das LDL-Cholesterin erhöht und durch eine Umstellung der Ernährung und vermehrte körperliche Betätigung nicht ausreichend zu senken, wird eine medikamentöse Senkung durch Einsatz eines Statins empfohlen, entsprechend den Leitlinien, die für die Normalbevölkerung gelten.[59] Für das Stadium 5 der chronischen Nierenkrankheit empfehlen die K/DOQI-Leitlinien eine besonders aggressive Senkung des LDL-Cholesterin auf Werte unter 100 mg/dl (2,6 mmol/l), bei Vorliegen eines Diabetes werden von manchen Autoren sogar Zielwerte unter 70 mg/dl (1,82 mmol/l) empfohlen.
Post-hoc-Analysen von Studien zur medikamentösen Senkung der Blutfette belegen im Stadium 3 der Nierenerkrankung den günstigen Einfluss einer Senkung des LDL-Cholesterins auf das Auftreten von Herz-Kreislauf-Komplikationen.[60][61][62] Eine große plazebokontrollierte Multicenterstudie konnte zeigen, dass bei chronischer Nierenerkrankung eine medikamentöse Senkung des LDL-Cholesterins durch Simvastatin und Ezetimib die Häufigkeit von Herzinfarkten, Schlaganfällen und behandlungsbedürftigen Durchblutungsstörungen senkt.[63]
Dagegen konnte bei Dialysepatienten durch eine medikamentöse Senkung des LDL-Cholesterins keine Verminderung kardiovaskulärer Komplikationen mehr erzielt werden.[64][65] Kohortenstudien an chronisch Nierenkranken und Hämodialyse-Patienten ergaben sogar ein besseres Überleben bei höheren Gesamt- und LDL-Cholesterin.[66] Diese im Vergleich zur Normalbevölkerung umgekehrte Beziehung zwischen Risikofaktor und Verlauf wird auch als reverse Epidemiologie bezeichnet.[67][68]
Diese diskrepanten Befunde werden neuerdings dahingehend interpretiert, dass im Stadium 5 die Veränderungen am Herz-Kreislauf-System so weit fortgeschritten sind, dass sie nicht mehr gut auf eine medikamentöse Senkung des LDL-Cholesterins ansprechen. Zudem können niedrige Cholesterin-Spiegel Folge der bei Nierenkranken häufig vorkommenden Fehlernährung und einer chronischen Entzündungskonstellation sein. Konsequenterweise empfiehlt die Amerikanische Herz-Gesellschaft (American Heart Association), bereits die frühen Stadien einer chronischen Nierenkrankheit in die höchste kardiovaskuläre Risikostufe einzuordnen und eine besonders aggressive Senkung des Cholesterins anzustreben.[69]
Bislang gibt es noch keine Daten, die bei chronischer Nierenkrankheit einen zusätzlichen günstigen Effekt zeigen, wenn zusätzlich zum LDL-Cholesterin die Triglyceride oder das HDL-Cholesterin medikamentös beeinflusst werden.[70]
Nierenersatztherapie
Im Stadium 4 einer chronischen Nierenerkrankung (GFR < 30 ml/min) sollten Patient, Angehörige und Arzt entscheiden, welches Nierenersatzverfahren im Fall eines weiteren Nierenfunktionsverlustes eingesetzt werden sollte.[71] Zur Auswahl stehen:
- Hämodialyse (Blutwäsche),
- Peritonealdialyse (Bauchfelldialyse),
- Nierentransplantation (ggf. präemptiv, d. h. noch vor Beginn einer Dialysebehandlung, wenn ein geeigneter Spender zur Verfügung steht),
- konservative Therapie (medikamentöse und supportive Therapie, wenn eine Dialysebehandlung oder eine Nierentransplantation vom Patienten nicht gewünscht werden).
Im Stadium 5 einer chronischen Nierenerkrankung (GFR < 15 ml/min) wird mit einem Nierenersatzverfahren begonnen. Ein früher Beginn der Nierenersatztherapie (d. h. bei einer eGFR 10–14 ml/min) bringt gegenüber einem späteren Dialysebeginn (eGFR 5–7 ml/min) keinen Vorteil.[72][73] Ohne Nierenersatztherapie führt der weitere Krankheitsverlauf zum Tod in der Urämie. Bei sehr alten und gebrechlichen Menschen bewirkt die Dialysebehandlung im Stadium 5 eine Lebensverlängerung von ca. zwei Jahren,[74] im Rahmen der Einleitung der Nierenersatztherapie kann es aber auch zu einer deutlichen Verschlechterung des Allgemeinzustandes kommen;[75] in solchen Fällen kann eine konservative Behandlung eine akzeptable Alternative darstellen.[76]
Leitlinien
1997 wurde von der National Kidney Foundation (Nationale Nierenstiftung der USA) die Dialyse-Ergebnisqualitäts-Initiative (Dialysis Outcomes Quality Initiative oder DOQI) begonnen. Dieses Projekt hatte zum Ziel, die Betreuung von Dialysepatienten zu verbessern. Es entstanden evidenzbasierte Leitlinien zur Hämodialyse, zur Peritonealdialyse (Bauchfelldialyse), zum Gefäßzugang und zur Ernährung von Dialysepatienten. 1999 beschloss die nationale Nierenstiftung, die Qualitätsinitiative auf frühe Stadien der chronischen Nierenkrankheit auszuweiten (Kidney Disease Outcomes Quality Initiative oder K/DOQI). 2002 erschien die erste Leitlinie der K/DOQI. Diese Leitlinie legte diagnostische Maßnahmen fest (Evaluation), definierte die derzeit gebräuchliche Stadieneinteilung (Klassifikation) und schlug Maßnahmen zur Abschätzung des Risikos einer Krankheitsverschlechterung und des Auftretens von Komplikationen (Stratifikation) vor.
Derzeit sind zwölf Leitlinien veröffentlicht:
- Hämodialyse
- Peritonealdialyse
- Gefäßzugang
- Anämie-Management
- Ernährung
- Evaluation, Klassifikation und Stratifikation von chronischer Nierenkrankheit
- Fettstoffwechselstörung
- Knochenstoffwechselstörungen
- Knochenstoffwechselstörungen bei Kindern
- Bluthochdruck und Blutdruckbehandlung
- Herz-Kreislauf-Erkrankungen bei Dialysepatienten
- Diabetes und chronische Nierenkrankheit.
Die Kidney Disease: Improving Global Outcomes (KDIGO) ist eine globale gemeinnützige Stiftung mit dem Ziel einer weltweiten Verbesserung der Versorgung von chronischen Nierenkranken und von deren Behandlungsergebnissen.[77] Die KDIGO hat folgende Leitlinien veröffentlicht:
- Vorbeugung, Diagnose, Evaluation und Behandlung der Hepatitis C bei chronischer Nierenkrankheit.[78]
- Diagnose, Evaluation, Vorbeugung und Behandlung von Störungen des Mineral- und Knochenstoffwechsels bei chronischer Nierenkrankheit.[45]
- Betreuung des nierentransplantierten Patienten.[79]
Die European Renal Association (Europäische Nieren-Vereinigung) hat Leitlinien veröffentlicht zum Anämie-Management, zur Hämodialyse und zur Nierentransplantation.
Die Leitlinien der Canadian Society of Nephrology (Kanadische Gesellschaft für Nephrologie) beschäftigen sich mit Prinzipien der Behandlung des Terminalstadiums einer Nierenkrankheit, mit der Überweisung vom Allgemeinmediziner zum Nephrologen sowie mit Hämodialyse, Peritonealdialyse, Gefäßzugang, Dialysebeginn und Anämie-Management.
Die britischen Leitlinien des Royal College of Physicians in Zusammenarbeit mit der britischen Nierenvereinigung wurden 2005 publiziert und 2008 aktualisiert. Es werden Maßnahmen zur Erkennung und zum Management von Nierenkrankheiten sowie Kriterien zur Überweisung zum Spezialisten vorgeschlagen.
Die Leitlinien der Nephrologischen Gesellschaft von Australien und Neuseeland werden seit 2000 veröffentlicht. Sie umfassen Diagnostik, Vorbeugung und Behandlung von chronischer Nierenkrankheit, Dialyse und Nierentransplantation.
In der Datenbank der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften finden sich Leitlinien zur diabetischen Nephropathie, zur urämischen Polyneuropathie sowie zur Nierentransplantation aus urologischer Sicht. Eine deutsche S3-Leitlinie zur ambulanten Versorgung von Patienten mit nicht dialysepflichtiger chronischer Nierenerkrankung wurde 2019 von der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin veröffentlicht.[80]
Selbsthilfeorganisationen
Als unabhängige Organisation hat die 1997 gegründete Deutsche Nierenstiftung die Information und Aufklärung, die Früherkennung und Prävention der Chronischen Nierenerkrankung in den Fokus ihres Handelns gestellt. Mit „Nierenstark“ hat sie 2013 ein entsprechendes Programm gestartet, seit Frühjahr 2016 arbeitet sie unter dem Motto „Tatort Niere“[81] mit 30 Betriebskrankenkassen zusammen.
In Deutschland gibt es eine große Anzahl von lokalen Selbsthilfegruppen, die sich insbesondere für Dialysepatienten und Nierentransplantierte einsetzen.
Viele dieser Gruppen sind im „Bundesverband Niere – Selbsthilfe Niere – Prävention, Dialyse, Transplantation – e. V.“ zusammengeschlossen. Ziele des Vereins sind u. a.
- die Förderung der Organspendebereitschaft in der Öffentlichkeit,
- die Prävention von Nierenerkrankungen,
- der Einsatz für das Qualitätsmanagement in der Nierenersatztherapie,
- die Wahrnehmung der Interessen der Mitglieder der ihm angeschlossenen Mitgliedervereine.
Der Bundesverband Niere gibt die Zeitschrift Der Nierenpatient heraus.
Das „Netzwerk von Menschen mit chronischen Nierenerkrankungen und deren Angehörige c/o Heimdialyse-Patienten (HDP) e. V.“ hat insbesondere die Förderung von Heimdialyseverfahren wie Bauchfelldialyse oder Heimhämodialyse zum Ziel.
Die „PKD Familiäre Zystennieren e. V.“ richtet sich an Patienten mit Zystennieren und deren Familienangehörige und ist Teil eines internationalen Netzwerkes von Zystennierenpatienten.
Ziele der Selbsthilfegruppe sind Selbsthilfe – Prävention – Forschung, u. a.
- die medizinische Aufklärung mit Hilfe von Ärzten,
- Gespräche mit Betroffenen und deren Familienangehörigen,
- persönlicher Erfahrungsaustausch,
- Hilfe bei auftretenden Problemen,
- Fachvorträge zu krankheitstangierenden Themen,
- gemeinsame Freizeitaktivitäten,
- Kontaktstelle für Eltern mit erkrankten Kindern.
Der Verein „Junge Nierenkranke Deutschlands e. V.“ vertritt die Interessen junger nierenkranker Menschen. Er richtet sich speziell an Jugendliche und junge Erwachsene, die von einer Nierenerkrankung betroffen sind. Unter anderem bietet der Verein Veranstaltungen, Seminare und Reisen an, die auch für dialysepflichtige Nierenkranke geeignet sind, und berät und unterstützt bei Problemen im sozialen, beruflichen und schulischen Umfeld.
Chronisches Nierenversagen in der Tiermedizin
In der Tiermedizin kommt chronisches Nierenversagen am häufigsten bei Hauskatzen vor und ist eine der häufigsten Todesursachen für diese Tierart (siehe Chronische Nierenerkrankung der Katze).
Literatur
- Bertram Hartmann, David Czock, Frieder Keller: Arzneimitteltherapie bei Patienten mit chronischem Nierenversagen. In: Deutsches Ärzteblatt International. Nr. 107(37), 2010, S. 647–656 (aerzteblatt.de).
Weblinks
- Website der Deutschen Nierenstiftung, nierenstiftung.de
- CLINICAL PRACTICE GUIDELINES, KDIGO – Internationales Leitlinienportal (englisch)
- S3-Leitlinie: Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis.
- German Chronic Kidney Disease – GCKD Studie Nationale Kohortenstudie zu chronischer Nierenerkrankung
- dosing.de – Medikamentendosierung bei Niereninsuffizienz, Universitätsklinikum Heidelberg, Abteilung Innere Medizin VI, Klinische Pharmakologie und Pharmakoepidemiologie
- kdigo.org – Leitlinien der Nationalen Nierenstiftung der USA (englisch)
- Chronic kidney disease. – Leitlinie des Royal College of Physicians (UK), September 2008. rcplondon.ac.uk (PDF, Volltext) Anhänge (PDF, englisch)
Einzelnachweise
- Kidney Disease: Common, Harmful, Treatable. World Kidney Day, a joint initiative of the International Society of Nephrology (ISN) and the International Federation of Kidney Foundations (IFKF).
- KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. In: Kidney Disease: Improving Global Outcomes [KDIGO] CKD Work Group (Hrsg.): Kidney International. Suppl. 3, Nr. 1, 2013, S. 1–150 (KDIGO CKD 2012 [PDF]). KDIGO CKD 2012 (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- U. Frei, H.-J. Schober-Halstenberg: Nierenersatztherapie in Deutschland. Bundesverband Niere, Jahresberichte 1995 bis 2005/2006, Berlin, Deutschland. Die Daten wurden von QuaSi-Niere gGmbH zur Verfügung gestellt. Eine Interpretation und die weiterführende Auswertung dieser Daten liegen allein in der Verantwortung des Autors.
- Ihab M. Wahba, Robert H. Mak: Obesity and Obesity-Initiated Metabolic Syndrome: Mechanistic Links to Chronic Kidney Disease. In: Clinical Journal of the American Society of Nephrology. 2007 2, S. 550–562.
- Helmut Schiffl: Fluoridation of drinking water and chronic kidney disease – absence of evidence is not evidence of absence. In: Nephrology Dialysis Transplantation, Volume 23, Issue 1, Januar 2008, S. 411.
- Nicola von Lutterotti: Die Kehrseite von Energydrinks, in: Frankfurter Allgemeine Zeitung für Deutschland, Nummer 103/2021 vom 5. Mai 2021, S. N 2, mit der dortigen Quelle British Medical Journal (doi:10.1136/bcr-2020-239370) und mit Zitaten von Herbert Löllgen.
- Abbildung: Prävalenz der chronischen Nierenkrankheit nach Alter NHANES 1988–1994 und 1999–2004. The Journal of the American Medical Association, 298(17), 2007, S. 2038–2047.
- Allan J. Collins u. a.: Who should be targeted for CKD screening? Impact of diabetes, hypertension, and cardiovascular disease. In: American Journal of Kidney Diseases. Band 53, 3 Suppl 3, März 2009, ISSN 1523-6838, S. S71–77, doi:10.1053/j.ajkd.2008.07.057, PMID 19231764.
- Josef Coresh, Elizabeth Selvin, Lesley A. Stevens, Jane Manzi, John W. Kusek, Paul Eggers, Frederick Van Lente, Andrew S. Levey: Prevalence of chronic kidney disease in the United States. In: The Journal of the American Medical Association. Band 298, Nr. 17, 7. November 2007, ISSN 1538-3598, S. 2038–2047, doi:10.1001/jama.298.17.2038, PMID 17986697.
- Mitchell Rosner, Emaad Abdel-Rahman, Mark E. Williams: Geriatric nephrology: responding to a growing challenge. In: Clinical Journal of the American Society of Nephrology. Band 5, Nr. 5, Mai 2010, ISSN 1555-905X, S. 936–942, doi:10.2215/CJN.08731209, PMID 20185600.
- Gesine Weckmann, Jean-François Chenot, Sylvia Stracke: S3-Leitlinie Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis. In: DEGAM-Leitlinie Nr. 22, AWMF-Register-Nr. 053-048. 30. Juni 2019 (awmf.org [PDF; abgerufen am 12. Mai 2020]).
- Gesine Weckmann, Jean-François Chenot, Sylvia Stracke: S3-Leitlinie Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis. In: DEGAM-Leitlinie Nr. 22, AWMF-Register-Nr. 053-048. 30. Juni 2019 (awmf.org [PDF; abgerufen am 12. Mai 2020]).
- A. S. Go u. a.: Chronic Kidney Disease and the Risks of Death, Cardiovascular Events, and Hospitalization. In: The New England Journal of Medicine 351, 2004, S. 1296–1305.
- Manjula Kurella Tamura Virginia Wadley u. a.: Kidney function and cognitive impairment in US adults: the Reasons for Geographic and Racial Differences in Stroke (REGARDS) Study. In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. Band 52, Nr. 2, August 2008, ISSN 1523-6838, S. 227–234, doi:10.1053/j.ajkd.2008.05.004, PMID 18585836.
- Minesh Khatri u. a.: CKD associates with cognitive decline. In: Journal of the American Society of Nephrology: JASN. Band 20, Nr. 11, November 2009, ISSN 1533-3450, S. 2427–2432, doi:10.1681/ASN.2008101090, PMID 19729443.
- Gerald Liew, Paul Mitchell, Tien Yin Wong, Sudha K. Iyengar, Jie Jin Wang: CKD increases the risk of age-related macular degeneration. In: Journal of the American Society of Nephrology: JASN. Band 19, Nr. 4, April 2008, ISSN 1533-3450, S. 806–811, doi:10.1681/ASN.2007080844, PMID 18216312.
- Matthew T. James u. a.: CKD and risk of hospitalization and death with pneumonia. In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. Band 54, Nr. 1, Juli 2009, ISSN 1523-6838, S. 24–32, doi:10.1053/j.ajkd.2009.04.005, PMID 19447535.
- Hans-Jürgen Laws, Ulrich Baumann, Christian Bogdan, Gerd Burchard, Maximilian Christopeit: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen. (III) Impfen bei hämatologischen und onkologischen Erkrankungen (antineoplastische Therapie, Stammzelltransplantation), Organtransplantation und Asplenie. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 63, Nr. 5, Mai 2020, ISSN 1436-9990, S. 588–644, doi:10.1007/s00103-020-03123-w, PMID 32350583, PMC 7223132 (freier Volltext) – (springer.com [abgerufen am 12. Oktober 2021]).
- Ständige Impfkommission (STIKO): Empfehlungen der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut 2021. 26. August 2021, doi:10.25646/8824 (rki.de [abgerufen am 12. Oktober 2021]).
- C. Y. Hsun u. a.: The risk of acute renal failure in patients with chronic kidney disease. In: Kidney International. Nr. 74, 2008, S. 101–107 (Abstract).
- D. S. Keith u. a.: Longitudinal Follow-up and Outcomes Among a Population With Chronic Kidney Disease in a Large Managed Care Organization. In: Arch Intern Med. Band 164, 2004, S. 659–663.
- Allan J. Collins, Robert N. Foley, David T. Gilbertson, Shu-Chen Chen: The state of chronic kidney disease, ESRD, and morbidity and mortality in the first year of dialysis. In: Clinical Journal of the American Society of Nephrology: CJASN. 4 Suppl 1, Dezember 2009, ISSN 1555-905X, S. S5–11, doi:10.2215/CJN.05980809, PMID 19996006.
- Grenzwert der GFR, ab dem die Wahrscheinlichkeit, dialysepflichtig zu werden, die Wahrscheinlichkeit, zuvor zu sterben, übersteigt; nach Altersgruppen aus Ann M. O’Hare u. a.: Age Affects Outcomes in Chronic Kidney Disease. In: Journal of the American Society of Nephrology. Band 18, Nr. 10, 1. Oktober 2007, S. 2758–2765, doi:10.1681/ASN.2007040422 (asnjournals.org).
- M. Tonelli u. a.: Chronic Kidney Disease and Mortality Risk: A Systematic Review Journal of the American Society of Nephrology 2006 17: 2034–2047.
- Kunihiro Matsushita u. a.: Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. In: The Lancet. Band 375, Nr. 9731, 12. Juni 2010, ISSN 1474-547X, S. 2073–2081, doi:10.1016/S0140-6736(10)60674-5, PMID 20483451.
- M. A. Roberts u. a.: Cardiovascular Biomarkers in CKD: Pathophysiology and Implications for Clinical Management of Cardiac Disease. In: American Journal of Kidney Diseases. Band 48, 2006, S. 341–360.
- Ursula C. Brewster u. a.: Dermatological Disease in Patients With CKD. In: American Journal of Kidney Diseases. Nr. 51, 2008, S. 331–344 (Online).
- A. K. Bello u. a.: Prevention of chronic kidney disease. A global challenge. In: Kidney International. 68, Supplement 98, 2005, S. S11–S17 (Artikel).
- Enyu Imai u. a.: Kidney Disease Screening Program in Japan. History, Outcome, and Perspectives. In: Clinical Journal of the American Society of Nephrology. Nr. 2, 2007, S. 1360–1366 (Abstract).
- Stephan R. Orth, Stein I. Hallan: Smoking: A Risk Factor for Progression of Chronic Kidney Disease and for Cardiovascular Morbidity and Mortality in Renal Patients Absence of Evidence or Evidence of Absence? In: Clinical Journal of the American Society of Nephrology. Nr. 3, 2008, S. 226–236 (Abstract).
- Ulrich O. Wenzel u. a.: My Doctor Said I Should Drink a Lot! Recommendations for Fluid Intake in Patients with Chronic Kidney Disease. In: Clinical Journal of the American Society of Nephrology. Nr. 1, 2006, S. 344–346 (cjasn.asnjournals.org).
- arznei-telegramm, 52. Jahrgang, Nummer 10/2021, 22. Oktober 2021, S. 76–78.
- K/DOQI Clinical Practice Guidelines on Hypertension and Antihypertensive Agents in Chronic Kidney Disease. In: American Journal of Kidney Diseases. 43, 2004, S.5(Suppl 1), S. S1.
- Lawrence J. Appel u. a.: Intensive blood-pressure control in hypertensive chronic kidney disease. In: The New England Journal of Medicine. Band 363, Nr. 10, 2. September 2010, ISSN 1533-4406, S. 918–929, doi:10.1056/NEJMoa0910975, PMID 20818902.
- David M. Kent u. a.: Progression Risk, Urinary Protein Excretion, and Treatment Effects of Angiotensin-Converting Enzyme Inhibitors in Nondiabetic Kidney Disease. In: Journal of the American Society of Nephrology. Band 18, 2007, S. 1959–1965.
- M. MacKinnon u. a.: Combination Therapy With an Angiotensin Receptor Blocker and an ACE Inhibitor in Proteinuric Renal Disease: A Systematic Review of the Efficacy and Safety Data. In: American Journal of Kidney Diseases. Band 48, 2006, S. 8–20.
- Roland E. Schmieder u. a. Additional Antiproteinuric Effect of Ultrahigh Dose Candesartan: A Double-Blind, Randomized, Prospective Study. In: Journal of the American Society of Nephrology. Band 16, 2005, S. 3038–3045.
- Leszek Tylicki u. a.: Triple pharmacological blockade of the renin-angiotensin-aldosterone system in nondiabetic CKD: an open-label crossover randomized controlled trial. In: American Journal of Kidney Diseases. Band 52, Nr. 3, September 2008, ISSN 1523-6838, S. 486–493, doi:10.1053/j.ajkd.2008.02.297, PMID 18423812.
- Fausta Catapano, Paolo Chiodini, Luca De Nicola, Roberto Minutolo, Pasquale Zamboli, Ciro Gallo, Giuseppe Conte: Antiproteinuric response to dual blockade of the renin-angiotensin system in primary glomerulonephritis: meta-analysis and metaregression. In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. Band 52, Nr. 3, September 2008, ISSN 1523-6838, S. 475–85, doi:10.1053/j.ajkd.2008.03.008, PMID 18468748.
- Salim Yusuf u. a.: Telmisartan, ramipril, or both in patients at high risk for vascular events. In: The New England Journal of Medicine. Band 358, Nr. 15, 10. April 2008, ISSN 1533-4406, S. 1547–1559, doi:10.1056/NEJMoa0801317, PMID 18378520.
- Bruno Cianciaruso u. a.: Effect of a low- versus moderate-protein diet on progression of CKD: follow-up of a randomized controlled trial. In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. Band 54, Nr. 6, Dezember 2009, ISSN 1523-6838, S. 1052–1061, doi:10.1053/j.ajkd.2009.07.021, PMID 19800722.
- James Shepherd u. a.: Effect of Intensive Lipid Lowering with Atorvastatin on Renal Function in Patients with Coronary Heart Disease: The Treating to New Targets (TNT) Study. In: Clinical Journal of the American Society of Nephrology. Nr. 2, 2007, S. 1131–1139 (Abstract).
- Ione de Brito-Ashurst, Mira Varagunam, Martin J. Raftery, Muhammad M. Yaqoob: Bicarbonate supplementation slows progression of CKD and improves nutritional status. In: Journal of the American Society of Nephrology: Journal of the American Society of Nephrology. Band 20, Nr. 9, September 2009, ISSN 1533-3450, S. 2075–2084, doi:10.1681/ASN.2008111205, PMID 19608703.
- Tim Niehues, Christian Bogdan, Jane Hecht, Thomas Mertens, Miriam Wiese-Posselt: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen(I) Grundlagenpapier. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 60, Nr. 6, Juni 2017, ISSN 1436-9990, S. 674–684, doi:10.1007/s00103-017-2555-4 (springer.com [abgerufen am 12. Oktober 2021]).
- KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD–MBD). In: Improving Global Outcomes [KDIGO] CKD-MBD Work Group (Hrsg.): Kidney International. 76 (Suppl 113), 2009, S. S1–S130 (kdigo.org [PDF]). Deutsche Übersetzung (PDF; 164 kB)
- Steven M. Brunelli: The Association between Prescribed Dietary Phosphate Restriction and Mortality among Hemodialysis Patients. In: Clinical Journal of the American Society of Nephrology. December 2010, 2011 (Artikel).
- KDOQI Clinical Practice Guidelines for Bone Metabolism and Disease in Chronic Kidney Disease (Memento vom 14. Februar 2015 im Internet Archive). In: American Journal of Kidney Diseases. 2003: 42 Supplement 3.
- KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. In: American Journal of Kidney Diseases. 2006: 47 Supplement S3
- KDOQI Clinical Practice Guideline and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease: 2007 Update of Hemoglobin Target. In: American Journal of Kidney Diseases. 2007: 50, S. 522–528.
- T. B. Drüeke u. a.: Normalization of hemoglobin level in patients with chronic kidney disease and anemia. In: The New England Journal of Medicine, Band 355, 2006, S. 2071–2084.
- A. K. Singh u. a.: Correction of anemia with epoetin alfa in chronic kidney disease. In: The New England Journal of Medicine Band 355, 2006, S. 2085–2098.
- Marc A. Pfeffer u. a.: A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. In: The New England Journal of Medicine. Band 361, Nr. 21, 19. November 2009, ISSN 1533-4406, S. 2019–2032, doi:10.1056/NEJMoa0907845, PMID 19880844.
- Suetonia C. Palmer u. a.: Meta-analysis: erythropoiesis-stimulating agents in patients with chronic kidney disease. In: Annals of Internal Medicine. Band 153, Nr. 1, 6. Juli 2010, ISSN 1539-3704, S. 23–33, doi:10.7326/0003-4819-153-1-201007060-00252, PMID 20439566.
- Steven Fishbane, Anatole Besarab: Mechanism of Increased Mortality Risk with Erythropoietin Treatment to Higher Hemoglobin Targets. In: Clinical Journal of the American Society of Nephrology. Nr. 2, 2007, S. 1274–1282 (Abstract).
- Anna Kottgen u. a.: Reduced Kidney Function as a Risk Factor for Incident Heart Failure: The Atherosclerosis Risk in Communities (ARIC) Study. In: J Am Soc Nephrol. Nr. 18, 2007, S. 1307–1315 (Artikel).
- Meng Lee u. a.: Low glomerular filtration rate and risk of stroke: meta-analysis. In: BMJ (Clinical Research Ed.). Band 341, 2010, ISSN 1468-5833, S. c4249, PMID 20884696.
- K/DOQI Clinical Practice Guidelines for Managing Dyslipidemias in Chronic Kidney Disease. In: American Journal of Kidney Diseases. 2003, 41, Supplement S3
- Mark E. Molitch: Management of Dyslipidemias in Patients with Diabetes and Chronic Kidney Disease. In: Clinical Journal of the American Society of Nephrology. Band 1, 2006, S. 1090–1099.
- Third Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). (Memento vom 4. Oktober 2014 im Internet Archive) National Heart, Lung and Blood Institute
- Joseph Nogueira, Matthew Weir: The Unique Character of Cardiovascular Disease in Chronic Kidney Disease and Its Implications for Treatment with Lipid-Lowering Drugs. In: Clinical Journal of the American Society of Nephrology. Nr. 2, 2007, S. 766–785 (Artikel).
- Marcello Tonelli u. a.: Effect of Pravastatin on Cardiovascular Events in People With Chronic Kidney Disease. In: Circulation. Nr. 110, 2004, S. 1557–1563 (Artikel).
- Michael J. Koren u. a.: Focused Atorvastatin Therapy in Managed-Care Patients With Coronary Heart Disease and CKD. In: American Journal of Kidney Diseases. Vol. 53, Issue 5, 2009, S. 741–750 (Abstract).
- Colin Baigent u. a.: The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. In: The Lancet. Band 377, Nr. 9784, 25. Juni 2011, ISSN 1474-547X, S. 2181–2192, doi:10.1016/S0140-6736(11)60739-3, PMID 21663949.
- Christoph Wanner u. a.: Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. In: The New England Journal of Medicine. Band 353, Nr. 3, 21. Juli 2005, ISSN 1533-4406, S. 238–248, doi:10.1056/NEJMoa043545, PMID 16034009.
- Bengt C. Fellström u. a.: Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. In: The New England Journal of Medicine. Band 360, Nr. 14, 2. April 2009, ISSN 1533-4406, S. 1395–1407, doi:10.1056/NEJMoa0810177, PMID 19332456.
- Bonnie C. H. Kwan u. a.: Lipoprotein Metabolism and Lipid Management in Chronic Kidney Disease. In: Journal of the American Society of Nephrology. Nr. 18, 2007, S. 1246–1261 (Artikel).
- Ryan D. Kilpatrick u. a.: Association between Serum Lipids and Survival in Hemodialysis Patients and Impact of Race. In: Journal of the American Society of Nephrology. Nr. 18, 2007, S. 293–303 (Artikel).
- C. P. Kovesdy u. a.: Inverse Association between Lipid Levels and Mortality in Men with Chronic Kidney Disease Who Are Not Yet on Dialysis: Effects of Case Mix and the Malnutrition-Inflammation-Cachexia Syndrome. In: Journal of the American Society of Nephrology. Nr. 18, 2007, S. 304–311 (Artikel).
- M. J. Sarnak u. a.: Kidney Disease as a Risk Factor for Development of Cardiovascular Disease: A Statement From the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. In: Circulation. Band 108, 2003, S. 2154–2169.
- Gursharan Dogra, Ashley Irish, Dick Chan, Gerald Watts: A randomized trial of the effect of statin and fibrate therapy on arterial function in CKD. In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation. Band 49, Nr. 6, Juni 2007, ISSN 1523-6838, S. 776–785, doi:10.1053/j.ajkd.2007.03.003, PMID 17533020.
- NKF K/DOQI GUIDELINES: Clinical Practice Guidelines and Clinical Practice Recommendations, 2006 Updates, Hemodialysis Adequacy, Peritoneal Dialysis Adequacy, Vascular Access. In: American Journal of Kidney Diseases. 2006: 48 Supplement S1 kidney.org (Memento des Originals vom 11. Februar 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Bruce A. Cooper u. a.: A Randomized, Controlled Trial of Early versus Late Initiation of Dialysis. In: The New England Journal of Medicine. 27. Juni 2010, ISSN 1533-4406, doi:10.1056/NEJMoa1000552, PMID 20581422.
- Seth Wright u. a.: Timing of dialysis initiation and survival in ESRD. In: Clinical Journal of the American Society of Nephrology: CJASN. Band 5, Nr. 10, Oktober 2010, ISSN 1555-905X, S. 1828–1835, doi:10.2215/CJN.06230909, PMID 20634325.
- Rachel C. Carson, Maciej Juszczak, Andrew Davenport, Aine Burns: Is Maximum Conservative Management an Equivalent Treatment Option to Dialysis for Elderly Patients with Significant Comorbid Disease? In: Clinical Journal of the American Society of Nephrology. Band 4, Nr. 10, 1. Oktober 2009, S. 1611–1619, doi:10.2215/CJN.00510109 (Abstract [abgerufen am 6. Februar 2010]).
- Manjula Kurella Tamura, Kenneth E. Covinsky, Glenn M. Chertow, Kristine Yaffe, C. Seth Landefeld, Charles E. McCulloch: Functional status of elderly adults before and after initiation of dialysis. In: The New England Journal of Medicine. Band 361, Nr. 16, 15. Oktober 2009, ISSN 1533-4406, S. 1539–1547, doi:10.1056/NEJMoa0904655, PMID 19828531.
- Vincenzo De Biase, Olga Tobaldini, Claudia Boaretti, Cataldo Abaterusso, Nicoletta Pertica, Carmelo Loschiavo, Gaetano Trabucco, Antonio Lupo, Giovanni Gambaro: Prolonged conservative treatment for frail elderly patients with end-stage renal disease: the Verona experience. In: Nephrology Dialysis Transplantation. Band 23, Nr. 4, April 2008, ISSN 1460-2385, S. 1313–1317, doi:10.1093/ndt/gfm772, PMID 18029376.
- kdigo.org – Kidney Disease: Improving Global Outcomes (KDIGO)
- KDIGO clinical practice guidelines for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. In: Kidney International. Supplement. Nr. 109, April 2008, ISSN 0098-6577, S. S1–99, doi:10.1038/ki.2008.81, PMID 18382440 (kdigo.org [PDF]).
- KDIGO clinical practice guideline for the care of kidney transplant recipients. In: American Journal of Transplantation. 9 Suppl 3, November 2009, ISSN 1600-6143, S. S1–155, doi:10.1111/j.1600-6143.2009.02834.x, PMID 19845597 (kdigo.org [PDF]).
- Gesine Weckmann, Jean-François Chenot, Sylvia Stracke: S3-Leitlinie Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis. In: DEGAM-Leitlinie Nr. 22, AWMF-Register-Nr. 053-048. 30. Juni 2019 (awmf.org [PDF; abgerufen am 12. Mai 2020]).
- Tatort Niere, bkk-sued.de