Lithiumhydroxid
Lithiumhydroxid LiOH, das Hydroxid des Lithiums, ist eine zwar starke, in Wasser aber nur mäßig lösliche Base.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
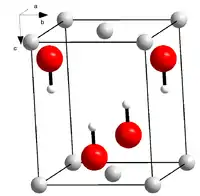 | ||||||||||||||||||||||
| _ Li+ _ O2− _ H+ | ||||||||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||||||||
| Raumgruppe |
P4/mmm (Nr. 123) | |||||||||||||||||||||
| Gitterparameter |
a = 3,549 Å, c = 4,334 Å | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Lithiumhydroxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | LiOH | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 23,95 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,46 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
924 °C[3] | |||||||||||||||||||||
| Löslichkeit |
mäßig löslich in Wasser | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Synthese
Reines Lithiumoxid Li2O reagiert mit Wasser zu Lithiumhydroxid.[5]
Die technische Herstellung erfolgt durch Umsetzung von Lithiumcarbonat mit Calciumhydroxid:[6]
Reines Lithiumhydroxid kann durch Reaktion von Lithiumsulfat mit Bariumhydroxid-Oktahydrat hergestellt werden. Das entstehende Monohydrat kann mit P4O10 im Vakuum zum Anhydrat umgesetzt werden.[7]
Alternativ kann Lithiumhydroxid auch durch Elektrolyse von wässrigen Lithiumsalzlösungen hergestellt werden.
Die direkte Herstellung aus Lithiummineralen erfolgt zum Beispiel im Lime-Roast-Prozess. Dabei werden Spodumen-Konzentrate aufgemahlen und zusammen mit ungelöschtem Kalk (CaO) in einem Ofen gebrannt. Der dabei hergestellte Klinker (Ca2SiO4, Li2O) wird aufgemahlen und mit heißem Wasser versetzt, wodurch Lithiumhydroxid entsteht. Neben diesem etablierten Acid-Roast-Prozess gibt es Ansätze zur direkten Gewinnung von Lithiumhydroxid aus Spodumen-Konzentraten ohne den Umweg über Lithiumcarbonat. Das Unternehmen Nemaska Lithium aus Kanada will bspw. über einen kombinierten Prozess aus Acid-Roast (+ Schwefelsäure), Ionenaustauscher und Membran-Elektrolyse eine Lithiumhydroxidlösung herstellen. Die beiden Unternehmen Neometals und Minerals Resources haben zusammen den Eli-Prozess entwickelt. In diesem Prozess wird das Spodumen-Konzentrat in einem Ofen von α-Spodumen in β-Spodumen umgewandelt und mit Salzsäure versetzt, wodurch eine Lithiumchloridlösung entsteht. Nach der Abtrennung von Verunreinigungen wie Eisen, Aluminium, Silizium, Kalzium und Magnesium folgen ein Ionenaustauscher sowie eine Membran-Elektrolyse zu einer Lithiumhydroxidlösung.[8]
Eigenschaften
Lithiumhydroxid ist ein weißer, durchscheinender Feststoff mit einer Kristallstruktur vom PbO-Typ (Raumgruppe P4/mmm (Raumgruppen-Nr. 123), a = 3,549, c = 4,334 Å).[7] Es ist eine starke Base und reagiert als solche mit Säuren. Außerdem ist Lithiumhydroxid fähig, Kohlenstoffdioxid zu binden (1 g wasserfreies Lithiumhydroxid bindet 450 ml CO2[9]).
Verwendung
Der größte Teil des Lithiumhydroxids wird für die Herstellung von Lithiumstearaten und Lithium-12-hydroxystearat benötigt, die wichtige Schmierfette für Autos oder Flugzeuge sind. Weiterhin wird es auf Grund seiner Kohlenstoffdioxid-bindenden Wirkung als Luftreiniger eingesetzt. Dies spielt vor allem in der Raumfahrt, auf U-Booten und bei Pendelatem-Tauchgeräten (Rebreather) eine Rolle. Lithiumhydroxid kann Zement zugesetzt werden und ist dabei in der Lage, die Alkali-Kieselsäure-Reaktion zu unterdrücken. Weiterhin ist Lithiumhydroxid ein möglicher Zusatzstoff in Nickel-Eisen-Akkus.[6]
In Druckwasserreaktoren wird Lithiumhydroxid dem Primärkreislauf zugesetzt, um Borsäure zu neutralisieren und einen pH-Wert von etwa 7,2 zu erreichen.[10]
Lithiumhydroxid wird auch als Ausgangsmaterial für die Herstellung von Fahrzeug-Akkumulatoren eingesetzt.[11]
Weitere Anwendungsgebiete sind Fotoentwickler, keramische Erzeugnisse und die Herstellung von Boraten.[9]
Weblinks
- International Chemical Safety Card (ICSC) für Lithium hydroxide beim National Institute for Occupational Safety and Health (NIOSH)
Einzelnachweise
- Eintrag zu LITHIUM HYDROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. März 2020.
- Eintrag zu Lithiumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Februar 2018. (JavaScript erforderlich)
- Datenblatt Lithiumhydroxid bei AlfaAesar, abgerufen am 6. Februar 2010 (PDF) (JavaScript erforderlich)..
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 1513 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Hermann Sicius: Wasserstoff und Alkalimetalle: Elemente der ersten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-12268-3, S. 25 (eingeschränkte Vorschau in der Google-Buchsuche).
- U. Wietelmann, R. Bauer: Lithium and Lithium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry, 2000, doi:10.1002/14356007.a15_393
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 958.
- Deutsche Rohstoffagentur: DERA Rohstoffinformationen - Rohstoffrisikobewertung – Lithium, abgerufen am 14. September 2020
- Eintrag zu Lithiumhydroxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- H.-G. Heitmann: Chemische Belange in Kernkraftwerke. In: Chemie Ingenieur Technik - CIT, 1976, 48, 2, S. 124–129, doi:10.1002/cite.330480210.
- Golem.de: Elektromobilität: Erste Lithiumhydroxid-Raffinerie in Deutschland geplant - Golem.de, abgerufen am 14. September 2020

