Methyllithium
Methyllithium ist eine chemische Verbindung aus der Gruppe der Organolithium-Verbindungen mit der empirischen Formel CH3Li. Es ist eine hochreaktive Verbindung, die nur in aprotischen Lösungsmitteln wie Diethylether, Tetrahydrofuran oder 1,2-Dimethoxyethan verwendbar ist. Es wird als Reagenz bei organischen und metallorganischen Synthesen verwendet. Die Verbindung nimmt eine oligomere Struktur, sowohl in Lösung als auch im festen Zustand, an. Reaktionen von Methyllithium erfordern wasserfreie Bedingungen, da die Verbindung sehr stark mit Wasser reagiert. Für die Anwesenheit von Sauerstoff und Kohlendioxid gilt dies in gleicher Weise.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Methyllithium | |||||||||||||||
| Summenformel | CH3Li | |||||||||||||||
| Kurzbeschreibung |
Farblose kubische, extrem hydrolyseempfindliche Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 21,98 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Die erste Synthese von lithiumorganischen Verbindungen (darunter Methyllithium) gelang 1917 Wilhelm Schlenk.[5]
Gewinnung und Darstellung
Bei der direkten Synthese wird Methylbromid mit einer Suspension von Lithium in Diethylether versetzt.[1]
Lithiumbromid bildet dabei eine Komplexverbindung mit Methyllithium. Das meiste kommerziell erhältliche Methyllithium besteht aus einer derartigen Komplexverbindung.[6] „Halogenfreies“ Methyllithium wird durch Umsetzung von Lithium mit Methylchlorid gewonnen. Das Lithiumchlorid fällt bei der Umsetzung aus, da es keinen so starken Komplex mit Methyllithium bildet. Das Filtrat besteht aus relativ reinem Methyllithium.
Eigenschaften
Physikalische Eigenschaften
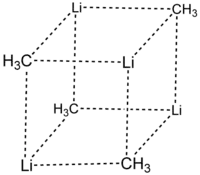
Durch Röntgenstrukturanalysen und NMR-Spektroskopie konnten zwei verschiedene Strukturen für Methyllithium nachgewiesen werden. Es bilden sich einerseits tetramere Assoziate mit einem (LiCH3) 4-Heterocuban-Gerüst. Die Tetramere haben hierbei ideale Td-Symmetrie und bilden ein kubisch-innenzentriertes Gitter mit einem Abstand zwischen den Lithium-Atomen von 268 pm und einem C-Li-Abstand von 231 pm. Die ungefähre Lage der H-Atome konnte durch Strukturverfeinerung erhalten werden.[7] Ebenso gelang der Nachweis pyramidaler Methylgruppen (C3v-Symmetrie). Das C-Atom einer Methylgruppe weist zu den Li-Atomen des eigenen Tetramers kurze Abstände auf, darüber hinaus aber auch nur einen 5–10 pm längeren zu dem auf einer Raumdiagonale der kubisch-innenzentrierten Elementarzelle benachbarten Tetramer. Dies führt zur Koordinationszahl 7 für Kohlenstoff. Die äußerst geringe Flüchtigkeit und Unschmelzbarkeit von Methyllithium ist eine direkte Folge dieser dreidimensionalen Vernetzung.
Chemische Eigenschaften
Methyllithium ist sowohl stark basisch als auch sehr nukleophil, da der Kohlenstoff den negativen Ladungsanteil trägt. Es ist daher besonders reaktiv mit Elektronen- und Protonen-Lieferanten. So wird THF, in der Regel ein chemisch inertes Lösungsmittel, zumindest bei Raumtemperatur von MeLi angegriffen. Wasser und Alkohole reagieren heftig. Die meisten Reaktionen, an denen Methyllithium beteiligt ist, werden bei Temperaturen unterhalb der Raumtemperatur durchgeführt. Obwohl MeLi für Deprotonierungen benutzt werden kann, wird n-Butyllithium häufiger verwendet, da es billiger, reaktiver und weniger gefährlich ist. Eine Pyrolyse von Methyllithium oberhalb von 200 °C führt zu den Hauptprodukten Methan und Lithiumhydrid, wobei weitere Kohlenwasserstoffe wie Ethen, Ethan, Propen und Isobuten gebildet werden.[8]
Verwendung
Methyllithium wird als Reagenz für Alkylierungen und zur Metallierung verwendet.[9]
Es ist als synthetisches Äquivalent eines Methyl-Anions anzusehen. So reagieren zum Beispiel Ketone in einem Zwei-Stufen-Prozess zu tertiären Alkoholen:
Nichtmetallhalogenide können mit MeLi zu Methyl-Verbindungen umgewandelt werden:
Bei solchen Reaktionen werden jedoch häufiger Methyl-Magnesium-Halogenide (Grignard-Reagenzien) verwendet, die weniger gefährlich sind als MeLi, ebenso wirksam und bequemer hergestellt werden können.
Einzelnachweise
- Eintrag zu Methyllithium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Oktober 2017.
- Datenblatt Methyllithium, 1-2M in ether bei AlfaAesar, abgerufen am 26. März 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Methyllithium solution (1.6 M in diethyl ether) bei Sigma-Aldrich, abgerufen am 9. November 2021 (PDF).
- Teile der Gefahrstoffkennzeichnung beziehen sich auf die Gefahren, die durch das Lösungsmittel verursacht werden.
- W. Schlenk, Johanna Holtz: Über die einfachsten metallorganischen Alkaliverbindungen. In: Berichte der deutschen chemischen Gesellschaft. 50, 1917, S. 262–274, doi:10.1002/cber.19170500142.
- M. J. Lusch, M. V. Phillips, W. V. Sieloff, G. S. Nomura, H. O. House: Preparation of Low-Halide Methyllithium In: Organic Syntheses. 62, 1984, S. 101, doi:10.15227/orgsyn.062.0101; Coll. Vol. 7, 1990, S. 346 (PDF).
- C. Elschenbroich: Organometallchemie, 2006, Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2.
- Baran, J.R.; Lagow, R.J.: Some observations on the pyrolysis of methyllithium in J. Organomet. Chem. 427 (1992) 1–7.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999-2013, John Wiley and Sons, Inc., Eintrag für Methyllithium, abgerufen am 10. Oktober 2017.


