Batterie (Elektrotechnik)
Eine Batterie ist ein Speicher für elektrische Energie auf elektrochemischer Basis. Ein Akkumulator ist eine wieder aufladbare Batterie.

Im Gegensatz zur Batterie speichert ein Kondensator elektrische Energie in einem elektrischen Feld, wodurch er wesentlich schneller aufgeladen und entladen werden kann, aber nicht in der Lage ist, die Spannung während der Entladung konstant zu halten. Hybrid- bzw. Superkondensatoren können die elektrische Energie sowohl statisch wie auch auf chemische Weise im Rahmen einer reversiblen Redoxreaktion speichern.
Begriff
Der Begriff „Batterie“ ist aus dem Sprachgebrauch des Militärs entnommen, wo es eine Zusammenstellung mehrerer Geschütze bedeutet, analog dazu wurde eine Zusammenschaltung mehrerer galvanischer Zellen mit diesem Begriff belegt. Ab der zweiten Hälfte des 20. Jahrhunderts dehnte sich die Verwendung des Begriffs „Batterie“ auch auf einzelne Primär- oder Sekundärzellen aus. Der geschilderte Wandel des Sprachgebrauchs wurde in der DIN-Norm 40729 Akkumulatoren; Galvanische Sekundärelemente; Grundbegriffe angesprochen, welche zunächst unter Batterie „immer mehrere verbundene Zellen“ verstand, wobei diese Begrifflichkeit sich bei der alltäglichen „Unterscheidung jedoch verwischt“ habe.[1]

"Batterie" ist heute sowohl der Oberbegriff für Energiespeicher, als auch im engeren Sinne die Bezeichnung für eine Primärbatterie, die nicht wieder aufladbar ist. Aufladbare Batterien werden Sekundärbatterie oder landläufig Akkumulator (kurz Akku) genannt.[2]
Man unterscheidet weiter
- Starterbatterien für Kraftfahrzeuge, Antriebsbatterien (Traktionsbatterien) bzw. zyklenfeste Speicherbatterien für Elektrofahrzeuge und stationäre, ortsfeste Anwendungen wie beispielsweise unterbrechungsfreie Stromversorgungen. Diese Batterien sind immer Akkumulatoren.
- Gerätebatterien, die zur Stromversorgung kleiner, meist tragbarer Geräte dienen, beispielsweise von Uhren, Radios, Spielzeug, Taschenlampen u. Ä. aber auch von fest installierten Geräten wie z. B. Rauchmeldern. Meist kommen Standardbauformen zum Einsatz.
Gerätebatterien müssen kompakt, lageunabhängig einsetzbar, leicht und trotzdem mechanisch robust sein. Bei normaler Lagerung und Verwendung im Gerät dürfen sie weder auslaufen noch ausgasen. Sie sind in einer Vielzahl von Ausführungen auf der Basis von Zink-Kohle oder Alkali-Mangan im Handel erhältlich. Zink-Kohle-Batterien werden seit den 2000er Jahren immer seltener angeboten und heute kaum noch hergestellt.
Geschichte
Als Batterien gedeutete antike Gefäßanordnungen wie die „Bagdad-Batterie“ hätten durch ein Zusammenspiel von Kupfer, Eisen und Säure eine elektrische Spannung von circa 0,8 V erzeugen können. Ob diese Gefäße zum damaligen Zeitpunkt vor etwa 2.000 Jahren als Batterien im heutigen Sinn verwendet wurden, ist umstritten und konnte nicht zweifelsfrei nachgewiesen werden.[3]
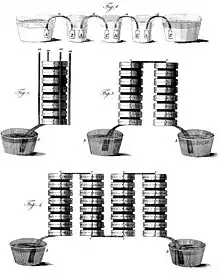
Im Jahr 1780 bemerkte der italienische Arzt Luigi Galvani, dass ein Froschbein, das in Kontakt mit Kupfer und Eisen kam, immer wieder zuckte, und hielt das für eine elektrische Wirkung. Das erste funktionierende galvanische Element und damit die erste Batterie wurde in Form der Voltaschen Säule im Jahr 1800 von Alessandro Volta erfunden. Es folgten in den Folgejahren konstruktive Verbesserungen wie die Trog-Batterie von William Cruickshank, welche den Nachteil des vertikalen Aufbaus der Voltaschen Säule vermied. Historisch wird zwischen Trockenbatterien – mit festem oder gelartigem Elektrolyt – und den heute nicht mehr gebräuchlichen Nassbatterien – mit flüssigem Elektrolyt – unterschieden.[4]
Zu den historischen Nassbatterien, welche nur in bestimmter Lage betrieben werden können, zählen das Daniell-Element von John Frederic Daniell aus dem Jahre 1836 und die verschiedenen Variationen und Bauformen in Form der Gravity-Daniell-Elemente, das Chromsäure-Element von Johann Christian Poggendorff aus dem Jahre 1842, das Grove-Element von William Grove aus dem Jahre 1844 und das Leclanché-Element von Georges Leclanché aus dem Jahr 1866.[4] Einsatzbereich dieser galvanischen Nasszellen war primär die Stromversorgung der drahtgebundenen Telegrafiestationen. Aus dem Leclanché-Element gingen über mehrere Entwicklungsschritte die noch heute üblichen lageunabhängigen Trockenbatterien hervor, erste Arbeiten dazu stammen von Carl Gassner, welcher die Trockenbatterie im Jahre 1887 patentierte.[5] Im Jahr 1901 setzte Paul Schmidt in Berlin erstmals die Trockenbatterie bei Taschenlampen ein.
Kommerziell am bedeutendsten sind heutzutage Sekundärbatterien,[6] darunter spielen der Blei-Säure-Akkumulator und der Lithium-Ionen-Akkumulator die größte Rolle.[7] Aufgrund der geringen Kosten und geringeren Selbstentladung werden Primärbatterien weiterhin für viele kleinere Geräte eingesetzt, wie Taschenlampen und Uhren. Unter den Primärbatterien hat die Alkali-Mangan-Batterie den größten Anteil.[8]
Grundlagen

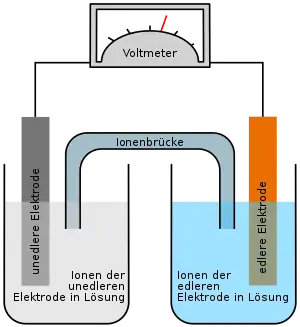
Eine Batterie ist eine elektrische oder galvanische Zelle und somit ein elektrochemischer Energiespeicher und ein Energiewandler. Bei der Entladung wird gespeicherte chemische Energie durch die elektrochemische Redoxreaktion in elektrische Energie umgewandelt. Diese kann von einem vom Stromnetz unabhängigen elektrischen Verbraucher genutzt werden. Alternativ kann sie auch in einem vom Stromnetz abhängigen Verbraucher eingesetzt werden, um kurzzeitige Netzausfälle zu überbrücken, und so eine unterbrechungsfreie Stromversorgung sicherstellen.
Primärzellen können nur einmal entladen und nicht wieder aufgeladen werden. In manchen Zellen sind die bei der Entladung ablaufenden chemischen Reaktionen teilweise umkehrbar. Der Energiegehalt des Neuzustands kann bei Primärbatterien nicht wiederhergestellt werden, während dies bei wiederaufladbaren Sekundärbatterien (Akkumulatoren) mehrere hundert Male annähernd möglich ist.
Abweichend von der grundsätzlichen Systematik werden wiederaufladbare alkalische Zellen manchmal dennoch zu den Primärzellen gezählt.
Die Elektrodenmaterialien legen die Nennspannung der Zelle fest, die Menge der Materialien die enthaltene Energie.
Wichtige Begriffe in Bezug auf die elektrischen Eigenschaften einer Batteriezelle sind:
- Kapazität
- Die in einer galvanischen Zelle gespeicherte elektrische Ladung wird als Kapazität bezeichnet, die nicht zu verwechseln ist mit der elektrischen Kapazität. Die Kapazität einer Batterie wird in der Dimension der elektrischen Ladung in Amperestunden (Einheitenzeichen: Ah), oder seltener in Amperesekunden (As) oder Coulomb (C; 1 As entspricht 1 C) angegeben.
- Energieinhalt
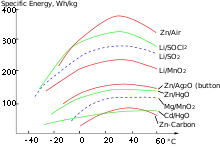
- Die physikalische Einheit ist die Wattsekunde. Die in einer Batterie gespeicherte Energie (elektrische Arbeit) wird nicht immer angegeben. Die spezifische Energie, also die Energie pro Masse oder pro Volumen ist jedoch eine typische Kenngröße von Batteriesystemen und oftmals in Datenblättern der Hersteller angeführt. Eine Einschätzung je nach Typ geben Diagramme vergleichender Energieangaben (siehe Diagramm). Die spezifische Energieeinheit ist Ws/m³ oder Ws/kg (entspricht J/m³ oder J/kg).
- Leistung
- Die Leistung einer Batterie/Batteriezelle ist die maximale Menge an elektrischer Energie, die pro Zeiteinheit entnommen werden kann. Sie wird in Watt (W) angegeben. Sie ist das Produkt aus Entladestrom (Ampere) und Entladespannung (Volt).
- Selbstentladung
- Alle galvanischen Zellen unterliegen bei Lagerung einer Selbstentladung. Die Geschwindigkeit der Selbstentladung hängt unter anderem vom Batterietyp und der Temperatur ab. Je niedriger die Lagertemperatur, desto geringer ist die Selbstentladung.
Die schwächste Zelle bestimmt die Qualität einer Batterie. In Parallelschaltung kommt es durch Ausgleichsströme zu größeren Verlusten, wenn die Zelle mit geringerer Kapazität früher entladen ist. In Reihenschaltung bricht die Spannung unter Last eher zusammen, weil stärkere, noch geladene Zellen Strom durch schwächere, schon entladene Zellen treiben, an denen dann bereits ein Teil der Spannung abfällt. Deren erhöhter Innenwiderstand führt nach dem Ohmschen Gesetz zu einer Zellerwärmung, ohne dass die elektrische Energie nutzbar ist.
Typen
Aufgrund der vielfältigen Einsatzbereiche mit sehr unterschiedlichen Anforderungen bezüglich Spannung, Leistung und Kapazität gibt es heute Batterien in vielen Typen. Diese werden unterschieden beispielsweise
- nach chemischer Zusammensetzung
- nach Baugröße / Bauform
- nach elektrischen Kenngrößen (Spannung, Kapazität …)
Nach chemischer Zusammensetzung
Die verschiedenen Typen werden nach den eingesetzten Materialien bezeichnet:
- Standardbatterien (Basis: Zink-Mangan)
- Alkali-Mangan-Batterie; 1,5 V Nennspannung pro Zelle
- Zinkchlorid-Batterie; 1,5 V pro Zelle (nahezu vollständig durch Alkali-Mangan-Batterie ersetzt)
- Zink-Kohle-Batterie; 1,5 V pro Zelle (in Europa nahezu vollständig durch Alkali-Mangan-Batterie ersetzt, abgesehen von einigen größeren Bauformen wie z. B. Laternenbatterien)
- Spezialbatterien
- Zink-Luft-Batterie; 1,4 V pro Zelle
- Quecksilberoxid-Zink-Batterie; 1,35 V pro Zelle
- Silberoxid-Zink-Batterie; 1,55 V pro Zelle
- Nickel-Oxyhydroxid-Batterie; 1,7 V pro Zelle
- Lithiumbatterien; je nach Kathodenmaterial 1,8 V (FeS2) bis 3,7 V (SOCl2)
- Lithium-Eisensulfid-Batterie; 1,5 V pro Zelle
- Aluminium-Luft-Batterie; 1,2 V pro Zelle
- Biobatterie auf Basis Magnesium/NaCl/Eisen+Molybdän+Wolfram, im Körper zersetzlich[9]
- Historische Batterien
- Edison-Lalande-Element; 0,75 V pro Element
Darüber hinaus werden im experimentellen Bereich und zur Veranschaulichung des Funktionsprinzips der zugrunde liegenden chemischen Redoxreaktion recht exotische galvanische Zellen eingesetzt, zum Beispiel Zitronenzellen.
Nach Baugröße / Bauform
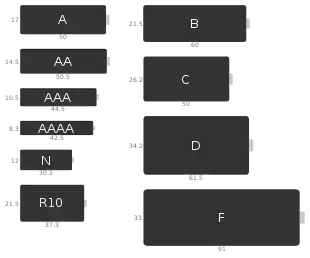
Es gibt sehr viele von der IEC genormte Typen und einige Bezeichnungen vom ANSI sowie inoffizielle Namen, insbesondere für die neun gängigsten Kategorien.[10][11][12]
Dies hat zur Folge, dass ein und dasselbe Batteriemerkmal durch unterschiedliche Bezeichnungen spezifiziert werden kann (siehe dazu Tabelle Beispiele). So bezeichnet etwa LR6 eine Alkali-Mangan-Batterie der Baugröße AA. Diese Baugröße heißt aber auch Mignon oder R6.
Zylindrische Batterien, deren Gesamthöhe kleiner ist als der Gesamtdurchmesser, werden als Knopfzellen bezeichnet.
Bezeichnungen nach IEC-60086
Bei den IEC-60086-Bezeichnungen steht
- R für round, also zylindrische Zellen,
- F für flat, also eine flache Bauform,
- S für square, also eine eckige Bauform.
Diesen Buchstaben kann ein weiterer Buchstabe vorangestellt sein, um die Batterien nach ihrer chemischen Zusammensetzung zu kennzeichnen:
| Buchstabe | chemischen Zusammensetzung |
|---|---|
| [leer] | Zink-Kohle-Batterie |
| A | Zink-Luft-Batterie |
| B | Lithium-Kohlenstoffmonofluorid-Batterie |
| C | Lithium-Mangandioxid-Zelle |
| E | Lithium-Thionylchlorid-Batterie |
| F | Lithium-Eisensulfid-Batterie |
| G | Lithium-Kupferoxid-Zelle |
| H | Nickel-Metallhydrid-Akkumulator |
| K | Nickel-Cadmium-Akkumulator |
| L | Alkali-Mangan-Batterie Wiederaufladbarer Alkali-Mangan-Akku (RAM) |
| P | Zink-Luft-Batterie |
| S | Silber-Zink-Akkumulator |
| Z | Nickel-Zink-Akkumulator |
Diesen Buchstaben kann eine Zahl vorangestellt sein, um die Anzahl der in Reihe geschalteten Zellgrößen im Gehäuse anzugeben.[13]
| Zahl[13] | Beispiel nach IEC-60086 |
|---|---|
| [leer] | R03 (1 Zelle der Größe R03) |
| 2 | 2R10 (2 Zellen der Größe R10) |
| 3 | 3R12 (3 Zellen der Größe R12) |
| 4 | 4LR44 (4 Zellen der Größe LR44) |
| 6 | 6F22 (6 Flachzellen der Größe F22) 6LR61 (6 Rundzellen der Größe LR61, heutzutage LR8D425) |
| 15 | 15F20 (15 Flachzellen der Größe F20) |
Mit nachgestellten Zeichen werden abweichende Bau- und Anschlussarten bzw. abweichende elektrische Charakteristiken gekennzeichnet.[13]
| Bis 1990[13] | Ab 1990[12] | Bemerkung |
|---|---|---|
| R6P | R6P | High Power Zink-Kohle Batterie des Typs R6 |
| R6 | R6S | Übliche Zink-Kohle Batterie des Typs R6 |
| 4R25X | 4R25X | Spiralfeder-Anschlusskontakte; ein Strang mit Reihenschaltung von vier Zellen R25 |
| 4R25Y | 4R25Y | Schraubanschlüsse; ein Strang mit Reihenschaltung von vier Zellen R25 |
| 4R25/2 | 4R25-2 | Zwei Stränge mit je vier R25 Zellen parallelgeschaltet; mit Schraubanschlüssen |
Beispiele
| Größenbezeichnung | Abmessungen[11] | Nennspannung[12] und Ausführungen | Abbildung | ||
|---|---|---|---|---|---|
| IEC[11] | ANSI[10] | weitere | |||
| R25 | F | Ø 32 mm × ca. 91 mm | 1,5 V bei R25 (Zink-Kohle) 1,5 V bei LR25 (Alkali-Mangan) heute nur mehr als Teil von 6V-Laternenbatterien üblich (siehe unten Größe 4R25X) |
 | |
| R20 | 13 | D Mono |
Ø 34,2 mm × ca. 61,5 mm | 1,5 V bei R20 (Zink-Kohle)
1,5 V bei LR20 (Alkali-Mangan) |
 |
| R14 | 14 | C Baby |
Ø 26,2 mm × 50,0 mm
(Ø 25 mm × 49 mm) |
1,5 V bei R14 (Zink-Kohle)
1,5 V bei LR14 (Alkali-Mangan) |
 |
| R22C429 | − | Sub-C SC |
Ø 22,2 mm × 42,9 mm
(Ø 22,2 mm × 42,5 mm) |
1,2 V bei KR22C429 (NiCd-Akku)
1,2 V bei HR22C429 (NiMH-Akku) |
 |
| R12 | − | B | Ø 21,5 mm × 60,0 mm | 1,5 V bei R12 (Zink-Kohle)
1,5 V bei LR12 (Alkali-Mangan) |
 |
| R23 | A | ca. Ø 17 mm × 50 mm
(Ø 16,5 mm × 48,5 mm) |
1,2 V als Akku in kürzerer Bauform als Lithium-Batterie |
 | |
| R6 | 15 | AA Mignon |
Ø 14,5 mm × 50,5 mm
(Ø 13,5 mm × 49,2 mm) |
1,5 V bei R6 (Zink-Kohle)
1,5 V bei LR6 (Alkali-Mangan) |
 |
| R03 | 24 | AAA Micro |
Ø 10,5 mm × 44,5 mm | 1,5 V bei R03 (Zink-Kohle)
1,5 V bei LR03 (Alkali-Mangan) |
 |
| R8D425 | 25 | AAAA Mini |
Ø 8,3 mm × 42,5 mm | 1,5 V bei R8D425 (Zink-Kohle)
1,5 V bei LR8D425 (Alkali-Mangan) |
 |
| R1 | 910 | N L20 Lady |
Ø 12,0 mm × 30,2 mm | 1,5 V bei R1 (Zink-Kohle)
1,5 V bei LR1 (Alkali-Mangan) |
 |
| 2R10 | c | Duplex | ca. Ø 21,5 mm × 74 mm | 3,0 V bei 2R10 (Zink-Kohle) |  |
| LR41 | - | 4AG3,
???L1325??? |
ca. Ø 11,6 mm × 5,4 mm | 1,5 V (Lithium) | |
| 4LR44 | - | 4AG13,
???L1325??? |
ca. Ø 13 mm × 25 mm | 6,0 V bei 4LR44 (Alkali-Mangan) |  |
| 8R932 | 1811A | 23A | Ø 10,3 mm × 28,5 mm | 12,0 V bei 8LR932 (Alkali-Mangan) |  |
| CR1620 | Ø 16, mm × 2,0 mm | 3 V (Lithium) | |||
| CR17345 | 5018LC | CR123A | Ø 17 mm × 34,5 mm | 3 V (Lithium) |  |
| CR2016 | CR2016
Knopfzelle |
Ø 20, mm × 1,6 mm | 3 V (Lithium) | ||
| CR2032 | − | CR2032
Knopfzelle |
Ø 20,5 mm × 3,2 mm | 3 V (Lithium) |  |
| CR2430 | v | Ø 24,5 mm × 3,0 mm | 3 V (Lithium) | ||
| CR2450 | CR2450
Knopfzelle |
Ø 24,5 mm × 5,0 mm | 3 V (Lithium) | ||
| 3R12 | − | Flachbatterie | ca. 65 mm × 61 mm × 21 mm | 4,5 V bei 3R12 (Zink-Kohle)
4,5 V bei 3LR12 (Alkali-Mangan) |
 |
| 4R25X | 908 915 |
4R25 996 Lantern Laternenbatterie |
ca. 114 mm × 66 mm × 66 mm | 6,0 V bei 4R25X (Zink-Kohle)
6,0 V bei 4LR25X (Alkali-Mangan) |
 |
| 6F22 6R61 |
1604 | 9-Volt-Block | ca. 48 mm × 26 mm × 17 mm | 9,0 V bei 6F22 (Zink-Kohle)
9,0 V bei 6LR61 (Alkali-Mangan) |
 |
| 15F20 | − | 15F20-Batterie | ca. 50 mm × 25 mm × 15 mm | 22,5 V bei 15F20 (Zink-Kohle) |  |
Frühere Benennung, bis etwa 1950
Bis etwa 1950 unterschied man[14]
- galvanische Zelle: konkrete Kombination aus Elektroden und Elektrolyt;
- galvanisches Element: in einen Behälter eingeschlossene gebrauchsfertige Zelle;
- (galvanische) Batterie: Zusammenschaltung mehrerer Zellen zu einer Einheit.
Galvanische Elemente und Batterien wurden kurz galvanische Stromerzeuger genannt und waren in VDE 0807 normiert.[14]
Die Unterscheidungen schlugen sich in der Benennung von galvanischen Stromerzeugern nieder. Diese bestand aus zwei oder drei Buchstaben, der Nennspannung sowie ggf. der Anzahl der Zellen:[14]
- erster Buchstabe: E für Element, B für Batterie;
- zweiter Buchstabe: A bis R je nach geometrischer Form der Zelle (zylindrisch oder quaderförmig), X oder Y bei Nasselementen zur Unterscheidung der Größe (weil hier nicht zwischen Zelle und Element unterschieden wird);
- dritter Buchstabe: für Ausführung der Zelle (T Trockenzelle, F Füllbraunstein, L Trocken-Luftsauerstoff);
- bei Batterien mit je zwei oder mehr parallelgeschalteten Zellen wurde deren Anzahl vor den Zellenbezeichner gesetzt.
Beispiele:[14]
- ELF: Element aus Zelle L (zylindrisch mit 50 mm Durchmesser) in Füllbraunsteinausführung
- BD 90: Batterie aus Zellen D (zylindrisch mit 19,6 mm Durchmesser) mit 90 V Nennspannung
- B 2 J 4,5: Batterie aus zwei parallelgeschalteten Zellen J (zylindrisch mit 31,5 mm Durchmesser) mit 4,5 V Nennspannung
- BH 4,5: Flachbatterie (30 × 87 × 95 mm) mit 4,5 V Nennspannung
Adapter und Kontaktierung
Nicht jeder Batterietyp ist überall erhältlich. Deshalb gibt es zum Beispiel Flachbatterie-Adapter, die drei AA-Zellen zu je 1,5 V aufnehmen. Diese lassen sich in allen Geräten verwenden, in die auch eine 4,5-V-Flachbatterie (3R12) hineinpasst. Nützlich sind diese Adapter auch, weil es keine wiederaufladbaren Flachbatterien gibt.
Die Kontaktierung kleiner Batterien erfolgt mit Federkontakten, zuverlässigere Ausführungen sind vergoldet. Fest eingebaute Akkumulatoren sind mit Steckkontakten, Schraubanschlüssen, Polbolzen oder Lötfahnen versehen.
Konfektionierte wiederaufladbare Batterien, sogenannte Akkupacks, bestehen aus mehreren Zellen, die untereinander fest verbunden und oft mit einer Ummantelung oder einem Gehäuse versehen sind. Bei Starterbatterien sind die Zellen untereinander mit Bleistegen, bei Antriebsbatterien in der Regel mit Kupferverbindern kontaktiert.
Microsoft offerierte 2010 eine „InstaLoad“ genannte, rein mechanische Lösung eines Batteriefaches, die das Einlegen von Einzelzellen in beliebiger Orientierung erlaubt. Die Kontakte sind dabei so gestaltet, dass keine Verpolung auftreten kann.[15] Das Verfahren erlangte jedoch keine Bedeutung.
Entsorgung


Batterien und Akkumulatoren gehören nicht in den Restmüll oder in die Umwelt, da sie umweltschädliche und zudem erneut nutzbare Rohstoffe enthalten, die das Batterierecycling für entsprechende Unternehmen wirtschaftlich attraktiv machen. Auch ausgelaufene Batterien sollten mit Vorsicht behandelt werden, da sich teils ätzende Substanzen an den Kontakten befinden. Sie müssen ebenfalls einem Recycling zugeführt werden und gelten als Problemstoff.
In Deutschland regelt die Batterieverordnung die Rücknahme und Entsorgung von Batterien. Sie legt unter anderem fest, dass in Deutschland keine Batterien oder Zellen mit einem Quecksilbergehalt von mehr als 0,0005 Gewichtsprozent in den Verkehr gebracht werden dürfen. Bei Knopfzellen darf der Quecksilbergehalt nicht über 2,0 Gewichtsprozent liegen. Alkali-Mangan-Batterien enthalten seit Beginn der 1990er Jahre kein Quecksilber mehr. Davor wurde es zum Amalgamieren des Elektrodenmaterials Zink verwendet. Pole von Lithium-Batterien müssen vor Entsorgung abgeklebt werden.[16]
Kleine Batterien können in Deutschland in Einzelhandelsgeschäfte zurückgebracht werden, wenn diese auch Batterien verkaufen. Gesetzlich verpflichtend ist zwar nur die Rücknahme von Batterietypen, die der jeweilige Händler im Sortiment führt; es werden aber üblicherweise auch „fremde“ Typen akzeptiert, da dem Händler dadurch keine Nachteile oder Kosten entstehen. Zu diesem Zweck müssen dort Sammelbehälter aufgestellt sein.
Schadstoffhaltige Batterien sind zusätzlich mit chemischen Zeichen versehen.[17]
- Pb: Batterie enthält mehr als 0,004 Masseanteil Blei
- Cd: Batterie enthält mehr als 0,002 Masseanteil Cadmium
- Hg: Batterie enthält mehr als 0,0005 Masseanteil Quecksilber
Abfallmenge
Die üblichen Akku- und Batteriearten (Zink-Kohle-Batterie, Alkaline-Batterie, Lithiumbatterie, NiMH-Akkumulator) unterscheiden sich in der Menge an Abfall, die sie im Verhältnis zu ihrer Kapazität verursachen.
Visualisierung der Müllmengen bei einer Verbrauchsannahme von 40 Wh pro Haushalt:[18]
| Standard-Bauform: Mignon AA (LR6) | Zink-Kohle-Batterie | Alkali-Mangan-Batterie (Alkaline) | Lithium-Batterie | NiMH-Akku |
|---|---|---|---|---|
| Kapazität pro Zelle: | 0,25 Wh | 1,67 Wh | 3,91 Wh | 2,9 Wh |
| Gewicht pro Zelle: | 15 g | 23 g | 14 g | 30 g |
| Volumen pro Zelle: | 8,8 cm³ | 8,8 cm³ | 8,8 cm³ | 8,8 cm³ |
| Ø Preis je Zelle: | 0,20 € | 0,49 € | 2,25 € | 3,50 € |
| Angenommen jeder der 40 Millionen Haushalt benötigt 40 Wh, dann … | ||||
| Bedarf je Haushalt: | 160 St. | 24 St. | 10 St. | 14 St. |
| Ø Gesamtpreis der Zellen: | 47,60 € | 20,65 € | 24,50 € | 48,26 € |
| Gewicht der Zellen aller Haushalte: | 96.000 t | 22.080 t | 5.600 t | 16.800 t |
| Gesamtvolumen der Zellen: | 56.320 m³ | 8.448 m³ | 3.520 m³ | 4.928 m³ |
Wiederverwertung
Für Starterbatterien existiert in Deutschland seit dem Jahr 2009 ein Pfandsystem. Daher werden beinahe 100 Prozent der Bleiakkumulatoren in Deutschland gesammelt und wiederverwertet.
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren – Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- David Linden, Thomas B. Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw-Hill, New York 2002, ISBN 0-07-135978-8 (englisch).
- Clive D. S. Tuck (Hrsg.): Modern Battery Technology. Ellis Horwood, New York 1991, ISBN 0-13-590266-5 (englisch).
- Philipp Brückmann: Autonome Stromversorgung – Auslegung und Praxis von Stromversorgungsanlagen mit Batteriespeicher. Ökobuch, Staufen 2007, ISBN 978-3-936896-28-2.
- Werner Döring: Einführung in die Theoretische Physik, Band II. Göschen, Berlin 1965 (speziell das Kapitel über Batterien).
- Michael Sterner, Ingo Stadler (Hrsg.): Energiespeicher. Bedarf, Technologien, Integration. 2. Auflage, Berlin/Heidelberg 2017, ISBN 978-3-662-48893-5.
Weblinks
- Ratgeber. Batterien und Akkus. Herausgegeben vom Umweltbundesamt, umfangreiche Info-Broschüre (PDF; 3,4 MB).
- Geschichte der elektrischen Energiespeicherung.
- Geschichte der elektrischen Batterien, Geschwister-Scholl-Gymnasium Wetter (Ruhr).
- PowerStream Battery Chemistry FAQ (englisch).
- Ihre Batterien – unsere Verantwortung, Stiftung Gemeinsames Rücknahmesystem Batterien.
- Technische Daten und Vergleichslisten für Knopfzellen und Batterien (PDF; 641 kB).
- Batteriegesetz vom 25. Juni 2009 (PDF; 112 kB).
- Allgemeine Hinweise für Akkus und Batterien. Hinweispflichten gem. §18 BattG (PDF; 82 kB).
- Mignon LR6 Batterien im Test. Kapazitätsmessungen von Marken-Mignon-Batterien mit verschiedenen Stromstärken (2010).
- Testberichte und Test-Vergleiche von Akkus & Batterien. Testberichte sowie Vergleiche von handelsüblichen Akkus & Batterien
Einzelnachweise
- Dirk Flottmann, Detlev Forst, Helmut Roßwag: Chemie für Ingenieure: Grundlagen und Praxisbeispiele. Springer, 2003, ISBN 3-540-06513-X, S. 225.
- Wo liegt eigentlich der Unterschied zwischen einer Batterie und einem Akku? In: zvei.org. Abgerufen am 18. Oktober 2019.
- Riddle of 'Baghdad's batteries'. In: news.bbc.co.uk. BBC, 27. Februar 2003, abgerufen am 16. Oktober 2020 (britisches Englisch).
- William Edward Ayrton: Practical Electricity. Cassell, London 1891, S. 212 und folgend. (Online).
- Patent US373064: Galvanic Battery. Veröffentlicht am 15. November 1887, Erfinder: Carl Gassner.
- The Global Battery Market – an Industry Report Review. In: News about Energy Storage, Batteries, Climate Change and the Environment. 2. August 2014, abgerufen am 16. Oktober 2020 (amerikanisches Englisch).
- Battery Market Size & Share | Industry Report, 2020-2027. Abgerufen am 16. Oktober 2020 (englisch).
- Primary Battery Market | Growth, Trends, and Forecast (2020 - 2025). Abgerufen am 16. Oktober 2020 (englisch).
- Biobatterie löst sich im Körper auf. In: orf.at. ORF.at. 26. März 2014. Archiviert vom Original am 26. März 2014.
- Establishing harmonised methods to determine the capacity of all portable and automotive batteries and rules for the use of a label indicating the capacity of these batteries. (PDF; 3,04 MB) In: europa.eu. European Commission DG Environment, September 2008, abgerufen am 15. März 2012 (englisch).
- INTERNATIONAL STANDARD - IEC 60086-1. (PDF; 529 kB) In: cnlumos.com. International Electrotechnical Commission, Dezember 2006, archiviert vom Original am 25. November 2011; abgerufen am 15. März 2012 (englisch).
- INTERNATIONAL STANDARD - IEC 60086-2. (PDF; 521 kB) (Nicht mehr online verfügbar.) In: sztxr.com. International Electrotechnical Commission, Dezember 2006, archiviert vom Original am 4. Mai 2012; abgerufen am 15. März 2012 (englisch).
- IEC 60086-1:2006(E), Annex, C.1 Designation system in use up to October 1990 (englisch, PDF, 525 kB) In: instrument.com.cn. IEC Central Office GENEVA, SWITZERLAND. S. 26–29. Dezember 2006. Archiviert vom Original am 15. März 2017.
- Wilhelm Friedrich, Carl Schaub, Gottfried Voltz: Tabellenbuch für Elektrotechnik (Ausgabe C). Zum Unterricht in Fachkunde, Fachrechnen und Fachzeichnen in Berufs-, Handwerker- und Fachschulen, sowie zum Selbstunterricht und praktischen Gebrauch für Elektroinstallateure und Elektrotechniker. 175. bis 199. Auflage. Ferd. Dümmlers Verlag, Bonn 1949.
- InstaLoad Battery Holders (englisch) In: batteryholders.com. Memory Protection Devices Inc. 2016. Archiviert vom Original am 17. März 2016.: „InstaLoad battery holders are an ingenious solution to guarantee correct battery insertions by users“
- Systemadmin_Umwelt: Ratgeber: Batterien und Akkus. Umweltbundesamt, 18. April 2013 (umweltbundesamt.de [abgerufen am 4. Dezember 2018]).
- Hinweise zur Batterieentsorgung. In: holzkern.com. Time for Nature GmbH.
- Eine Müllbilanz von Akkus und Batterien. 11. Juli 2018, abgerufen am 9. August 2021.