Lithiumdiisopropylamid
Lithiumdiisopropylamid (LDA) ist das Lithiumsalz von Diisopropylamin. Es ist eine starke Base, die in der Organischen Chemie oft zur Deprotonierung von CH-aciden Verbindungen eingesetzt wird. Auf Grund der sterischen Hinderung durch die raumerfüllenden Isopropylreste ist LDA wenig nucleophil. Der pKS-Wert der konjugierten Säure beträgt 40. Damit ist es möglich, auch schwach CH-acide Verbindungen wie Carbonylverbindungen in α-Position zu deprotonieren und diese dadurch in Enolate zu überführen.[3] Kommerziell ist LDA meist als Lösung in Diethylether oder THF erhältlich. In diesen Lösungen bildet es dimere Strukturen aus.[4] In unpolaren Lösungsmitteln wie z. B. Toluol liegt es hingegen als ein Gemisch aus Trimeren, Tetrameren, Pentameren und höheren Oligomeren vor.[5][6]
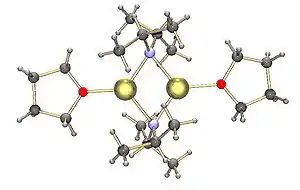 LDA-Dimer mit 2 THF-Molekülen
LDA-Dimer mit 2 THF-Molekülen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
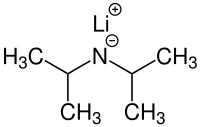 Strukturformel von Lithiumdiisopropylamid | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumdiisopropylamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H14LiN | |||||||||||||||
| Kurzbeschreibung |
selbstentzündlicher, feuchtigkeitsempfindlicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 107,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest (meist jedoch in Lösung) | |||||||||||||||
| Dichte |
0,86 g·cm−3 (25 °C)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
LDA kann aus Diisopropylamin mit Organo-Lithiumverbindungen wie Phenyllithium oder Butyllithium hergestellt werden.[7] Ein günstigerer Weg ist die Umsetzung von elementarem Lithium mit Diisopropylamin in Gegenwart von Styrol.[8]
Einzelnachweise
- Eintrag zu Lithiumdiisopropylamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. August 2015.
- Datenblatt Lithiumdiisopropylamid bei Sigma-Aldrich, abgerufen am 16. August 2015 (PDF).
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 3. Auflage. Wiley-VCH, Weinheim 2000, ISBN 3-527-29819-3.
- P. G. Williard, J. M. Salvino: Synthesis, Isolation, and Structure of an LDA-THF Complex. In: J. Org. Chem. 58 (1), 1993, S. 1–3, doi:10.1021/jo00053a001.
- R. Neufeld, M. John, D. Stalke: Aufklärung der donorbasenfreien Aggregation von Lithiumdiisopropylamid in Kohlenwasserstoffen mithilfe einer DOSY-Methode. In: Angew. Chem. 127 (1), 2015, S. 7100–7104, doi:10.1002/ange.201502576.
- R. Neufeld: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. Dissertation. Georg-August-Universität, Göttingen 2016.
- A. P. Smith, J. J. S. Lamba, C. L. Fraser: Efficient Synthesis of Halomethyl-2,2'-Bipyridines: 4,4'-Bis(chloromethyl)-2,2'-Bipyridine In: Organic Syntheses. 78, 2002, S. 82, doi:10.15227/orgsyn.078.0082; Coll. Vol. 10, 2004, S. 107 (PDF).
- M. T. Reetz, W. F. Maier: Einfache Darstellung von Lithiumdiisopropylamid in molarem Maßstab. In: Liebigs Annalen. 10, 1980, S. 1471–1473, doi:10.1002/jlac.198019801002.


