Drosophila melanogaster
Drosophila melanogaster (von altgriechisch δρόσος drosos „Tau“, φίλος philos „liebend“, μέλας melas „schwarz“ und γαστήρ gaster „Bauch“) ist eine von über 3000 Arten aus der Familie der Taufliegen (Drosophilidae). Sie ist einer der am besten untersuchten Organismen der Welt. Die recht ungebräuchlichen deutschen Bezeichnungen Schwarzbäuchige Fruchtfliege oder Schwarzbäuchige Taufliege für dieses Tier sind relativ neu und tauchen in der deutschsprachigen Literatur erst nach 1960 auf. Als „Fruchtfliegen“ wurden im fachlichen deutschen Sprachgebrauch ursprünglich nicht die Vertreter der Familie der Drosophilidae, sondern nur der Tephritidae bezeichnet.[1]
| Drosophila melanogaster | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
-20200607-RM-210232.jpg.webp)
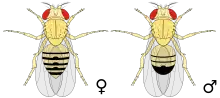
Drosophila melanogaster (Weibchen) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Drosophila melanogaster | ||||||||||||
| Meigen, 1830 |
Drosophila melanogaster (synonym unter anderem mit Drosophila ampelophila Loew[2]) wurde erstmals 1830 von Johann Wilhelm Meigen beschrieben. Als geeigneten Versuchsorganismus nutzte sie 1901 zuerst der Zoologe und Vererbungsforscher William Ernest Castle. Er untersuchte an D.-melanogaster-Stämmen die Wirkung von Inzucht über zahlreiche Generationen und die nach Kreuzung von Inzuchtlinien auftretenden Effekte. 1910 begann Thomas Hunt Morgan ebenfalls, die Fliegen im Labor zu züchten und systematisch zu untersuchen. Seitdem haben viele andere Genetiker an diesem Modellorganismus wesentliche Erkenntnisse zur Anordnung der Gene in den Chromosomen des Genoms dieser Fliege gewonnen.
Beschreibung
.jpg.webp)
.jpg.webp)
Drosophila melanogaster war ursprünglich eine tropische und subtropische Art. Sie hat sich jedoch gemeinsam mit dem Menschen über die ganze Welt verbreitet und überwintert in Häusern. Die Weibchen sind etwa 2,5 Millimeter lang, die Männchen sind etwas kleiner. Letztere sind leicht an ihrem stärker abgerundeten, durch Melanine fast einheitlich dunkel gefärbten Hinterleib von den Weibchen unterscheidbar, die in der Aufsicht einen spitzeren Hinterleib besitzen und die schwarzen Melanine mehr in Form eines Querstreifenmusters in die Körperdecke (Cuticula) ihres Hinterendes eingelagert haben. Die Augen der kleinen Fliegen sind durch Einlagerung von braunen Ommochromen und roten Pterinen in typischer Weise rot gefärbt.
Phylogenie: Drosophila oder Sophophora?
Die Gattung Drosophila im klassischen Sinn umfasst 1450 valide Arten und ist das artenreichste Taxon der Drosophilidae. Neuere Arbeiten, die auf Phylogenomik (Untersuchung von Verwandtschaftsverhältnissen durch den Vergleich von homologen DNA-Sequenzen), aber auch auf Morphologie, zum Beispiel der männlichen Genitalarmatur, aufbauen, haben gezeigt, dass die konventionelle Gattung Drosophila paraphyletisch ist.[3][4] Das bedeutet: Einige Arten, die bisher in mindestens acht, wahrscheinlich aber eher fünfzehn anderen Gattungen geführt werden, sind näher mit bestimmten Artengruppen innerhalb von Drosophila verwandt, als diese es untereinander sind. Die Untergattung Sophophora Sturtevant, 1939 steht dabei relativ basal, das heißt spaltet sich früh von dem verbleibenden Artenkomplex ab (sie ist allerdings selbst ebenfalls paraphyletisch.)[5]
Die normale Vorgehensweise in einem solchen Fall wäre, die Großgattung Drosophila aufzuspalten und die (Altwelt-Klade der) Untergattung Sophophora in den Gattungsrang zu erheben, was zu der Umkombination Sophophora melanogaster für unsere Art führen würde. Dies wäre für Fliegentaxonomen mehr oder weniger Alltag. Es hätte aber gravierende Auswirkungen auf die in diesem Fall extrem bedeutsame angewandte Forschung an der Art, wo sogar oft nur abgekürzt von Drosophila geredet wird. Die eingeschachtelten Gattungen einfach in Drosophila als Supergattung aufgehen zu lassen, hätte ebenfalls unerwünschte Konsequenzen: So hießen dann vier verschiedene Arten Drosophila serrata und vier andere Drosophila carinata.[6] Kim van der Linde versuchte, Drosophila melanogaster nachträglich zur Typusart der Gattung erklären zu lassen,[7] was von der ICZN abgelehnt wurde.[8] Andere schlugen vor, von den Regeln der Kladistik abzuweichen und paraphyletische Gattungen wieder zuzulassen.[9] Die formale Revision der Gattung Drosophila ist bisher, und zwar ausschließlich aus diesem Grund, unterblieben, so dass Drosophila melanogaster weiterhin der taxonomisch valide Name der Art ist, weil bisher kein Taxonom bereit war, die Konsequenzen der Umbenennung zu verantworten.
Entwicklung
Die Weibchen legen insgesamt etwa 400 weißlich-gelbliche, von einem Chorion und einer Vitellinmembran umhüllte Eier, die etwa einen halben Millimeter groß sind, auf Obst und verfaulendem, gärendem organischen Material ab. Ihre Vorliebe für Zitrusduft schützt Taufliegen vor Parasiten.[10] Die Dauer der Entwicklungszeit hängt von der Umgebungstemperatur ab. Bei einer Temperatur von 25 °C schlüpft aus jedem Ei nach etwa 22 Stunden als Larve eine Made, die sich sofort auf die Suche nach Futter macht. Die Nahrung besteht in erster Linie aus den Mikroorganismen, die das Obst zersetzen, wie zum Beispiel Hefen und Bakterien, und erst in zweiter Linie aus dem zuckerhaltigen Obst selbst. Nach etwa 24 Stunden häutet sich die Larve, die ständig wächst, zum ersten Mal und erreicht das zweite Larvenstadium. Nach dem Durchlaufen von drei Larvenstadien und einem viertägigen Puppenstadium schlüpft bei 25 °C nach insgesamt neun Tagen Entwicklungszeit das flugfähige Insekt, das dann innerhalb von etwa 12 Stunden geschlechtsreif ist.[11]
Embryonalentwicklung

Nach der Befruchtung des D. melanogaster-Eies und der Verschmelzung der Zellkerne erfolgen mehrere schnell aufeinander folgende synchrone Kernteilungen (Mitosen), bei denen eine Abgrenzung durch Zellmembranen unterbleibt. So entsteht ein Embryo, der aus einer Zelle mit vielen Zellkernen besteht, die nicht durch Membranen abgegrenzt werden. Dieser Zustand wird als synzytiales Blastoderm beziehungsweise als polyenergid bezeichnet. Bereits nach der siebten Kernteilung wandern die meisten Kerne an die Peripherie des Embryos, also unter die äußere Zellmembran. Zwischen der achten und neunten Kernteilung werden acht bis zehn Zellkerne in das posteriore Polplasma eingeschlossen und beginnen sich daraufhin unabhängig von den anderen Kernen zu teilen. Aus diesen so genannten Polzellen entwickeln sich die Keimzellen.
Aus dem synzytialen Blastoderm entsteht etwa 2,5 Stunden nach der Eiablage das „zelluläre Blastoderm“, und zwar durch Einstülpung und Wachstum der äußeren Zellmembran in die Regionen zwischen den einzelnen Kernen. Auf diese Weise wird das erste einschichtige Epithel der entstehenden Fliege gebildet und den Zellkernen damit der Zugang zu asymmetrisch verteilten, morphogenen Genprodukten verwehrt (siehe zum Beispiel bicoid). Entsprechend ist das Entwicklungspotential der Zellen zu diesem Zeitpunkt in Abhängigkeit von ihrer Position bereits weitgehend festgelegt.
Eine ventrale Einfurchung entlang der Längsachse (Ventralfurche) leitet die Gastrulation ein, durch die das Blastodermepithel in drei Keimblätter aufgeteilt wird: Durch die ventrale Einfurchung, die an der „Bauchseite“ längs des Embryos erfolgt, entsteht die Mesodermanlage. Eine anterior der Ventralfurche stattfindende Einstülpung (Invagination), die das Stomodeum bildet, und eine am posterioren Pol des Embryos stattfindende Invagination, die das Proktodeum bildet, grenzen das spätere Entoderm ab. Die an der Außenseite des Embryos verbleibenden Zellen und die Endbereiche der stomodealen und proktodealen Invaginationen bilden das Ektoderm. Mit der Verlängerung des Keimstreifs wandern die Polzellen von posterior in das Innere des Embryos. Die Organogenese setzt ein und zum ersten Mal wird eine embryonale Metamerie erkennbar. Etwa 7,5 Stunden nach der Befruchtung beginnt die Keimstreifverkürzung, die mit dem Dorsalschluss (dorsal closure) endet. Nach weiteren Differenzierungsschritten schlüpft etwa 21 Stunden nach der Befruchtung die vollständig entwickelte Larve.
Larvalentwicklung
Die fußlosen, segmentierten Maden besitzen an ihrem etwas stärker zugespitzten Vorderende einen dunklen Chitin-Stift, der ausgestreckt und eingezogen werden kann und die recht kümmerlichen Mundwerkzeuge enthält. Die Larven kriechen im Nahrungsbrei oder in der Umgebung der Nahrungsquelle umher, fressen und wachsen innerhalb weniger Tage von der Größe des Eies (0,5 mm) bis zur Größe der Fliege (2,5 mm) heran. Sie häuten sich in dieser Zeit zweimal. Es werden dementsprechend drei Larvenstadien unterschieden.
Verpuppung
Im letzten Larvenstadium stellt das Insekt bald das Umherkriechen ein und verpuppt sich. Die Puppe färbt sich zunächst nach und nach braun, ähnelt bei D. melanogaster aber nicht einer typischen Insektenpuppe, sondern sieht eher wie eine verschrumpelte und vertrocknete Made aus. Im Inneren der Madenhaut entwickelt sich nämlich eine Tönnchenpuppe, deren Hülle aus verhärteter Larvenhaut besteht. Nach einigen Tagen platzt ein Deckel am Ende des Tönnchens auf, und eine fertig entwickelte Taufliege kriecht heraus, die ihre Körperdecke nachträglich noch etwas verfärbt und aushärtet und ihre Flügel ausrichtet.
Festlegung des Geschlechts

Das Geschlecht der Taufliege ist – wie bei den meisten Tieren – genetisch bedingt. D. melanogaster hat nur vier verschiedene Chromosomen, sie kommen in den Zellen paarweise vor. Dieser zweifache Chromosomensatz enthält ein Paar Geschlechtschromosomen, die auch als erstes Chromosom oder X- beziehungsweise Y-Chromosom bezeichnet werden, und drei Paar Autosomen, die als zweites, drittes und viertes Chromosom bezeichnet werden. Ebenso wie der Mensch besitzt D. melanogaster zwei Geschlechtschromosomen: Weibchen haben zwei X-Chromosomen, sind homogametisch; Männchen haben ein X- und ein Y-Chromosom, sind heterogametisch. Anders als beim Menschen jedoch trägt das Y-Chromosom keine geschlechtsbestimmende Komponente, vielmehr ist das Verhältnis der X-Chromosomen zu den Autosomen geschlechtsbestimmend.[12]
Liegt das Verhältnis von X-Chromosom zu Autosomensatz bei größer oder gleich 1 (z. B. zwei X im diploiden Satz), so entsteht ein Weibchen; ist es kleiner oder gleich 0,5 (z. B. ein X im diploiden Satz), entsteht ein Männchen. Mutanten mit dazwischenliegenden Verhältnissen, etwa bei XX und triploidem Autosomensatz (Verhältnis: 0,67) bilden Intersexe aus mit mosaikartig verteilten männlichen und weiblichen Merkmalen (sogenanntes „Salz-und-Pfeffer-Muster“). Das Geschlecht wird demnach von jeder Zelle selbst festgelegt; es kann bei nicht eindeutigem Effekt (zwischen 0,5 und 1) verschieden sein.
Die Kompensation der unterschiedlichen Gendosen von nicht geschlechtsbestimmenden Genen des X-Chromosoms gelingt durch eine beim Männchen stark erhöhte Transkriptionsrate. Ermöglicht wird dies durch Acetylierungen von Lysinresten des Histons H4, womit die elektrostatische Wechselwirkung zwischen dem Histonkomplex und dem Zucker-Phosphat-Rückgrat der DNA abnimmt; die somit weniger stark an die Nukleosomen gebundene DNA ist nun leichter ablesbar. Derart kann mit Hyperaktivierung des singulären X-Chromosoms des Männchens dessen geringere Gendosis kompensiert werden.
Die Entscheidung, welche geschlechtsspezifischen Gene wie transkribiert werden, wird über das Gen sex lethal (Sxl) gesteuert. Bei Weibchen ist Sxl aktiv, bei Männchen inaktiv. Das Genprodukt Sxl ist ein RNA-spleißendes Enzym, das die sogenannte Transformer-mRNA spleißt. Das entstehende Protein „Transformer“ (tra) ist ebenfalls ein Spleißfaktor, welcher die mRNA des Gens double sex (dsx) spleißt. Das produzierte dsx bewirkt dann die eigentliche Geschlechtsfestlegung auf molekularer Ebene, und zwar ebenfalls als Transkriptionsfaktor. Das Protein dsx gibt es in einer männlichen und weiblichen Variante.
Weibchen: sxl aktiv, tra aktiv, dsxF (Female) entsteht. Die Realisatorgene des männlichen Geschlechts werden reprimiert. Männchen: sxl inaktiv, tra inaktiv, dsxM (Male) entsteht. Die Realisatorgene des weiblichen Geschlechts werden reprimiert.
Der Zusammenhang zwischen Aktivität von „sex lethal“ und der X-Chromosomen-Dosis erklärt sich nun folgendermaßen: Auf dem X-Chromosom werden 3 Gene für Transkriptionsfaktoren im syncytialen Blastoderm aktiviert, die auch „Numeratorgene“ genannt werden. Diese Faktoren (Beispiel: sisterless) binden an den sogenannten early promoter, eine regulatorische Region vor dem Sxl-Gen, und aktivieren es. Auf den Autosomen sind hingegen Gene zu finden, die man „Denominatorgene“ nennt. Sie codieren Faktoren (Beispiel: deadpan), die dem entgegenwirken.
Das Verhältnis X-Chromosomen zu Autosomen ist somit als ein Verhältnis der Numeratorgene zu Denominatorgenen aufzufassen. Liegt ein weiblicher Chromosomensatz vor (XX), überwiegen die Numeratorgene und aktivieren die Sxl-Transkription. Bei einem männlichen Satz (XY) sind dagegen die Denominatoren in Überzahl, die Transkription von Sxl wird reprimiert. In diesem Fall ist Sxl im Entwicklungsverlauf somit inaktiv.
Das Sxl-Gen besitzt zusätzlich einen late promoter. Dieser ist in der späteren Entwicklung konstitutiv in beiden Geschlechtern aktiviert. Durch eine Autoregulation von Sxl bleibt jedoch das Level an Sxl-Protein in weiblichen Zellen hoch, in männlichen niedrig. In weiblichen Zellen nämlich bindet frühes Sxl-Protein an Poly(U)-Sequenzen in Introns später Sxl-prä-mRNA. Jene Introns flankieren das Exon3, das ein Stop-Codon enthält. Wenn Sxl-Protein an diese Introns bindet, wird das Exon3 nicht als solches erkannt und herausgespleißt. Die Translation der so erzeugten Sxl-mRNA ergibt weiteres effektives Sxl-Protein. In männlichen Zellen ist die Konzentration an frühem Sxl-Protein nahezu null, sodass das Stop-Codon der späten Sxl-prä-mRNA wirksam wird. Die Translation der aus jener erzeugten mRNA ist daher unvollständig und ergibt keine effektive Isoform von Sxl.
Bei D. melanogaster ist die Festlegung des Geschlechts somit "zellautonom", d. h. durch interne Steuerungsmechanismen der einzelnen Zelle erklärbar. Jede Zelle „zählt“ gewissermaßen ihr X/Y-Verhältnis ab und entwickelt sich dementsprechend.
Generelle Anatomie des zentralen Nervensystems
Larvales Stadium
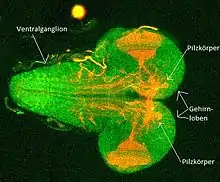
Das zentrale Nervensystem der D. melanogaster Larve ist aus den zwei Gehirnloben und dem ventralen Ganglion aufgebaut, welches das Bauchmark darstellt.[13] Die zwei Gehirnloben sind ventral miteinander verbunden. Die Fusionsstelle der beiden wird durch den Oesophagus durchstoßen, welcher dorsal über dem Ventralganglion verläuft. Das Fenster, durch das der Oesophagus läuft, wird Foramen genannt.[13]
Zentrales Nervensystem
Von jedem Gehirnlobus gehen der Antennennerv und der Bolwig-Nerv aus. Ein Querschnitt der Gehirnloben zeigt, dass sich die Gehirnloben aus einem Cortex aus neuronalen Somata sowie einem zentralen Neuropil zusammensetzen. Das Neuropil zeichnet sich durch eine große Dichte von Dendriten und synaptischen Endigungen aus, welche untereinander über synaptische Kontakte kommunizieren.
Das Ventralganglion ist ebenfalls in Cortex und Neuropil gegliedert. Jeder Gehirnlobus besitzt einen Pilzkörper, ein optisches Neuropil und einen larvalen Antennallobus. Ein Zentralkomplex ist bis jetzt in der Larve nicht gefunden worden. Theoretisch sollte er aber vorhanden sein, da er für die visuelle Koordination von Bewegung zuständig ist. Eventuell übernehmen Neurone, welche nicht auf typische Art einen Zentralkörper aufbauen, diese Aufgaben. Im larvalen Stadium nehmen Gehirn und Ventralganglion an Größe zu. Dies beruht darauf, dass Neuroblasten bereits während der Larvalphase beginnen, sich zu teilen, und in weiten Teilen des Gehirns neuronale Vorläuferzellen der späteren Neurone generieren. Der im ZNS häufigste exzitatorische Neurotransmitter ist, im Gegensatz zu den Wirbeltieren, Acetylcholin. Glutamat und andere kommen ebenfalls vor. Der hauptsächliche inhibitorische Transmitter ist γ-amino-Buttersäure (GABA).[13]
Larvaler Antennallobus
Im larvalen Antennallobus enden die Projektionen der olfaktorischen Rezeptorneuronen. Ausgangsneurone (sogenannte Projektionsneurone) ziehen vom larvalen Antennallobus über den Antennozerebraltrakt zum Pilzkörper. Hierbei projizieren 21 Projektionsneurone auf 28 Calyx-Glomeruli des Pilzkörpers.[14]
Pilzkörper
Der Pilzkörper ist im larvalen Stadium um einiges einfacher aufgebaut als bei der erwachsenen Fliege. Nach dem Eischlupf besitzt die L1-Larve ca. 250 Kenyonzellen, deren Anzahl sich innerhalb der 3 Larvenstadien auf ca. 2000 Zellen erhöht. Der Pilzkörper integriert verschiedene Sinnesinformationen und hat eine wichtige Funktion beim olfaktorischen Lernen. Der Pilzkörper besteht aus einem Calyx („Kelch“), an der sich ventral ein Stiel (Pedunculus) anschließt. Der Pedunculus teilt sich in verschiedene Loben. Der Pilzkörper erhält auch olfaktorische Eingänge aus dem Antennallobus.[15]
Ventralganglion
Das Ventralganglion befindet sich im dritten Thoraxsegment und reicht bis hin zum ersten Abdominalsegment der Larve.[13] Das Ventralganglion besteht aus drei suboesophagialen Neuromeren, drei thorakalen Neuromeren (Pro-, Meso- und Metathorakalneuromeren) und acht abdominalen Neuromeren, die miteinander zu einem Ganglion fusioniert sind. Der strukturelle Aufbau des Nervensystems in der frühen Embryonalentwicklung von D. melanogaster ähnelt dem einer Strickleiter. In der späten Embryonalentwicklung kommt es zu einer Fusion der abdominalen und thorakalen Neuromeren. Einzelne Ganglien sind nach der Fusion nicht mehr zu erkennen. Aus den acht abdominalen Neuromeren geht je ein paariger Segmentalnerv ab, welcher die entsprechenden Segmente innerviert. Der Segmentalnerv leitet sensorische Informationen auf den afferenten Bahnen von der Peripherie ins zentrale Nervensystem. Zudem leitet der Segmentalnerv motorische Informationen auf efferenten Bahnen vom zentralen Nervensystem in die Peripherie.[16]
Adultes Stadium
Das adulte Zentralnervensystem von Drosophila melanogaster setzt sich aus fusioniertem Oberschlundganglion und Unterschlundganglion (Gehirn) zusammen, sowie thorakalen und abdominalen Ganglien, die zu einem Ventralganglion fusioniert sind.
Zentrales Nervensystem
Das symmetrische Oberschlundganglion enthält ca. 100.000 Neurone, das Volumen beträgt ca. 0,2 mm³ und das Gewicht ca. 0,25 mg. Es besteht aus drei verschmolzenen Teilen, die entwicklungsgeschichtlich von den drei ursprünglichen Kopfsegmenten abstammen: Einem großen Protocerebrum, einem kleineren Deutocerebrum und einem sehr kleinen Tritocerebrum. Am Protocerebrum befinden sich die beiden optischen Loben, Gehirnlappen, die für die visuelle Verarbeitung zuständig sind. Das Deutocerebrum erhält über olfaktorische Rezeptorneurone olfaktorische Informationen, die in die Antennalloben gelangen. An den Antennen befinden sich ebenfalls Mechanorezeptoren zur Detektion mechanischer Reize. Diese Information wird in das antennomechanische Zentrum im Deutocerebrum geleitet.[13]
Zentralkomplex, optische Loben, Antennalloben und Pilzkörper stellen wichtige funktionelle Einheiten des adulten Gehirns dar. Der Zentralkomplex besteht aus vier deutlich abgrenzbaren Neuropilregionen. Hiervon liegt die Protozerebralbrücke am weitesten posterior ("hinten"), anterior davor liegt der Zentralkörper mit einer größeren oberen Einheit (Fächerkörper) und einer kleineren unteren Einheit (Ellipsoidkörper), sowie die beiden posterioren Noduli. Der Zentralkomplex spielt eine Rolle bei der motorischen Kontrolle und der visuellen Orientierung. So haben beispielsweise Fliegen mit Mutationen im Zentralkomplex ein vermindertes visuelles Orientierungsvermögen.[17]
Die optischen Loben sind für die Verarbeitung optischer Reize zuständig. Sie enthalten vier Verschaltungsebenen: Lamina, Medulla, Lobula und Lobularplatte. Die olfaktorischen Eingänge werden in den beiden Antennalloben verarbeitet, die aus sog. Glomeruli bestehen. Diese kugelartigen Strukturen stellen verdichtetes Neuropil dar. Über Geruchsrezeptoren an den Antennen werden olfaktorische Reize detektiert und in elektrische Signale umgewandelt. Die Erregung wird über Rezeptorneurone in die Glomeruli und von dort über Projektionsneurone in Pilzkörper und laterales Horn geleitet, wo die Information verarbeitet wird. Zur Modulation dienen lokale Neurone, die die Glomeruli innervieren.[18]
Die Pilzkörper sind zusammengesetzt aus Calyx und Pedunculus und sind der Sitz von höheren integrativen Leistungen, wie olfaktorisches Lernen und Gedächtnis. Dies konnten verschiedene Arbeitsgruppen z. B.durch transgene Techniken in rutabaga-Mutanten zeigen.[13][19]
Unterschlundganglion und Bauchmark
Das Unterschlundganglion weist eine klare segmentale Gliederung auf. Es liegt unterhalb des Oesophagus und besteht aus den drei fusionierten Neuromeren des mandibularen, maxillaren und labialen Segments.[13] Afferente Bahnen aus der Peripherie, die sensorische Informationen, z. B. von den Mundwerkzeugen, leiten, enden im Unterschlundganglion. Efferente Bahnen, die die Motorik in der Peripherie innervieren, entspringen dem Unterschlundganglion. Über die Schlundkonnektive ist das Unterschlundganglion mit dem Bauchmark verbunden.[13]
Peripheres Nervensystem
In D. melanogaster, wie auch in anderen Insekten, ist das viscerale Nervensystem, welches den Verdauungstrakt und die Geschlechtsteile innerviert, ein Bestandteil des peripheren Nervensystems und untergliedert sich wiederum in das ventrale viscerale, das caudale viscerale und das stomatogastrische System.
Das stomatogastrische Nervensystem innerviert die vordere Schlundmuskulatur und den Vorderdarm. Obwohl Frontalnerv und Nervus recurrens vorhanden sind, fehlt dem stomatogastrischen Nervensystem ein typisches Frontalganglion, das lediglich als Nervenkreuzung ausgebildet ist. Das stomatogastrische Nervensystem beinhaltet aber ein Proventrikularganglion und ein Hypocerebralganglion, die über den Proventrikularnerv miteinander verbunden sind.[13][20] Das ventrale caudale System bezeichnet die dem unpaaren Mediannerv zugehörigen Äste und steht in Verbindung mit den thorakalen und abdominalen Neuromeren des Bauchmarks. Das ventrale caudale System innerviert beispielsweise die Tracheen.[13]
Nervensystem während der Metamorphose
Das adulte Nervensystem entwickelt sich nicht erst während der Metamorphose komplett neu, sondern formt sich überwiegend aus einem Gerüst larvaler sensorischer Neurone, Inter- und Motoneurone. Die meisten sensorischen Neurone aus dem Larvenstadium degenerieren während der Metamorphose und werden durch adulte Neurone ersetzt, die sich aus den Imaginalscheiben entwickeln. Dadurch entsteht ein Teil des peripheren Nervensystems. Die adulten Interneurone bestehen zu einem kleinen Teil aus umgebauten larvalen Interneuronen, der Hauptanteil wird allerdings erst während der Metamorphose aus Neuroblasten gebildet. Diese Neurone werden vor allem für das optische System, die Antennen, den Pilzkörper und das thorakale Nervensystem gebraucht, um die Informationen der adultspezifischen Strukturen (Komplexaugen, Beine, Flügel) zu verarbeiten. Die Motoneurone bleiben überwiegend erhalten und werden während der Metamorphose in adultspezifische Neurone umgewandelt. Diese Motoneurone werden hauptsächlich für die neue Bein- und Flugmuskulatur, als auch für die Körperwandmuskulatur benötigt. Die postembryonale Neubildung von Neuronen, das Absterben larvaltypischer Neurone, sowie die Modifizierung bestehender larvaler Neurone werden von Genkaskaden reguliert, die vor allem von dem Steroidhormon Ecdyson ausgelöst werden.[21][22]
12-14 Stunden nach der Verpuppung degenerieren larvale Elemente vor allem in der Abdominalregion, die verbleibenden Neurone verkürzen ihre Axone und Dendriten. Außerdem entsteht eine Einschnürung zwischen dem suboesophagealen und dem thorakalen Bereich des ZNS, das damit sein larvales Aussehen verliert.
24 Stunden nach der Verpuppung beginnt die vollständige Differenzierung adulter Neurone, indem sich ihre Verzweigungen in größere Bereiche ausbreiten. Dies trägt neben der Bildung neuer Neurone zu einer Vergrößerung des Gehirns bei. Im larvalen Stadium besteht das olfaktorische System beispielsweise nur aus 21 sensorischen Neuronen, in den adulten Antennen hingegen aus ca. 1200 afferenten Fasern.[21][23]
Nach Abschluss der Metamorphose kommt es zum Absterben von Motoneuronen und peptidergen Neuronen, die nur zum Schlüpfen gebraucht werden und im adulten Tier keine Funktion haben.[21]
Sexueller Dimorphismus im zentralen Nervensystem
Das adulte Gehirn der D. melanogaster weist geschlechtsspezifische Unterschiede in der Morphologie auf. Männchen besitzen bestimmte Regionen im Gehirn, sogenannte MERs (male enlarged regions), die im Vergleich zu Weibchen deutlich vergrößert sind. Im Durchschnitt sind diese etwa 41,6 % größer. Auch Weibchen besitzen vergrößerte Strukturen, hier FERs (female enlarged regions), welche jedoch durchschnittlich nur ca. 17,9 % größer sind als die männlichen Gegenstücke. Durch Volumenberechnung der MERs ist es möglich, lediglich anhand des Gehirns eine Aussage über das Geschlecht der Fliege zu machen. Der größte Teil der MERs liegt im olfaktorischen Bereich des Gehirns. Dies erklärt das unterschiedliche Verhalten von Männchen und Weibchen auf Gerüche. Setzt man beispielsweise beide Geschlechter dem männlichen Pheromon cVA aus, so wirkt dieses auf Männchen abstoßend, auf Weibchen jedoch aphrodisierend.[24]
Ähnlich wie für die Geschlechtsdetermination sind die beiden Gene sex lethal (sxl) und transformer (tra) für die geschlechtsspezifischen, morphologischen Unterschiede des Gehirns zuständig. Sind beide aktiv, stellt das Gen doublesex (dsx) die weibliche Variante des Proteins DsxF her, welches die für Weibchen charakteristischen Regionen vergrößert (FER). Sind die Gene sxl und tra jedoch inaktiv, so stellt das Gen dsx die männliche Variante DsxM her, das für die differenzielle Ausbildung der MERs zuständig ist. Um aus einem einzelnen Gen zwei verschiedene Proteine zu synthetisieren, ist alternatives Spleißen notwendig. In diesem Fall geschieht dies durch die Regulatorgene sxl und tra.
Zudem ist das Gen fruitless (fru) an dem sexuellen Dimorphismus des zentralen Nervensystems beteiligt. Im weiblichen Wildtyp stellt es das nonfunktionale Protein FruF her. Im Männchen entsteht dementsprechend das Protein FruM. Dieses ist entscheidend für das normale Balzverhalten der Männchen. In Versuchen, bei denen man weibliche Mutanten herstellte, welche das Protein FruM synthetisieren konnten, konnte festgestellt werden, dass die Regionen, die normalerweise bei Männchen vergrößert sind, auch in diesen Weibchen vorhanden waren, wenn auch nicht im gleichen Ausmaße.[25][26]
Das optische System
Von der Embryogenese zur Larve
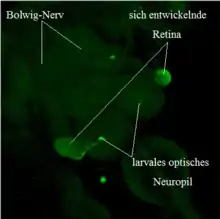
Während der Embryonalentwicklung kommt es im vorderen dorsalen Blastoderm zu einer plattenartigen Verdickung, welche invaginiert, sich in die Tiefe absenkt und sich zu sogenannten Plakoden ausbildet, die paarig vorliegen und sich lateral an die Oberfläche des sich entwickelnden Hirns als optische Anlagen anheften. Während der Larvenstadien nehmen die optischen Anlagen an Größe zu und transformieren sich, um in der Puppe zu den adulten optischen Loben auszudifferenzieren. Die optischen Anlagen spalten sich in die inneren und äußeren optischen Loben sowie in die adulte Retina. Aus den Anlagen der äußeren optischen Loben entwickeln sich zwei äußere optische Neuropile, die Lamina und Medulla. Die Anlagen für die inneren optischen Loben entwickeln sich in die Lobula und die Lobulaplatte. Bereits im zweiten Larvenstadium haben die sich entwickelnde Lamina und Medulla den Großteil des Volumens des Larvengehirns eingenommen. Während des dritten Larvenstadiums differenzieren sich die Lamina und Medulla weiter aus. Ebenfalls bilden sich die Verbindungen der inneren optischen Loben zum Zentralgehirn. An die Anlagen der optischen Loben angrenzend, befinden sich die Augen-Antennen-Imaginalscheiben, die sich aus undifferenzierten Stammzellen während der Embryogenese entwickeln. Während des dritten Larvenstadiums beginnt bereits eine Ausdifferenzierung, die in der Metamorphose bis zu vollständig differenzierten Komplexaugen weiterschreitet.[27][28] Das funktionelle Sehorgan der Larve ist das Bolwig-Organ. Es entsteht während der Embryonalentwicklung aus Vorläuferzellen, die sich von der optischen Invagination abspalten.[27] Das Bolwig-Organ besteht aus 12 Photorezeptorzellen mit den Rhodopsinen Rh5 und Rh6.[29] Rh5 absorbiert Licht im kurzwelligen blauen Bereich und gewährleistet die Lichtempfindlichkeit. Rh6 hingegen absorbiert langwelliges Licht und spielt zusätzlich eine wesentliche Rolle für die larvale innere Uhr.[30] Die Axone der Photorezeptoren bündeln sich und bilden den Bolwig-Nerv. Dieser projiziert durch die Augen-Antennen-Imaginalscheiben hindurch ins larvale Gehirn in das larvale optische Neuropil. Von dort aus folgen drei verschiedene Verschaltungen: auf serotonerge dendritisch verzweigte Neurone (SDA), auf dendritisch verzweigte ventrale laterale Neurone (LNvs) und auf visuelle Interneurone (CPLd).[31]
Von der Larve zur Imago (Metamorphose)
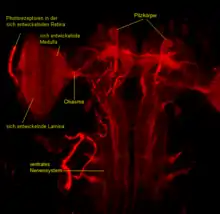
Aus den Augen-Antennen-Imaginalscheiben entwickeln sich die Ommatidien des Komplexauges. Die Photorezeptoraxone der Ommatidien ziehen über den Sehnerv (Nervus opticus) in das Gehirn. Bei der 24h alten Puppe ist das Auge ein relativ dickwandiger flacher Becher, bei dem die einzelnen Ommatidien klar sichtbar sind. Während der Augenbecher noch mehr abflacht, werden die Ommatidien dünner und kürzer. Später liegen die Ommatidien rund vor. Am Ende des zweiten Tages der Puppenentwicklung beginnt die Bildung der Cornealinsen und eine erste Pigmentierung erfolgt. Nach zweieinhalb Stunden schreitet die Pigmentierung in den Cornealinsen fort, das Auge erhält so eine bräunliche Farbe. Am Ende des Puppenstadiums nehmen die Ommatidien an Länge zu und differenzieren sich endgültig.[13]
Aus dem Bolwig-Organ entsteht das Hofbauer-Buchner-Äuglein, welches wie das Bolwig-Organ bei der circadianen Rhythmik eine wichtige Rolle spielt.[32] Am Ende der Metamorphose liegt das neuronale Superpositionsauge der Imago vor.
Das Komplexauge
Das Komplexauge einer adulten D. melanogaster besteht aus ca. 800 Ommatidien, wovon jede eine funktionelle Einheit der Retina darstellt.[33] Die Ommatidien sind hexagonal zueinander gerichtet. Jedes Ommatidium besitzt einen dioptrischen Apparat, welcher sich aus einer Cornealinse und einem Kristallkegel zusammensetzt. Neben dem dioptrischen Apparat besitzt ein Ommatidium 8 Photorezeptoren, wovon jeder einen zur Mitte gerichteten Mikrovillisaum besitzt. Diese Mikrovillifortsätze nennt man Rhabdomere. Da D. melanogaster ein neuronales Superpositionsauge hat, sind die Rhabdomere anders als bei dem Appositionsauge und dem optischen Superpositionsauge nicht miteinander verschmolzen, sondern liegen isoliert voneinander vor. Bei Lichteinfall absorbiert zuerst die Cornealinse das Licht und leitet es an den Kristallkegel weiter. Von dort aus wird das Licht von den Farbpigmenten, den Rhodopsinen, in den Rhabdomeren detektiert. Die acht Rhabdomere sind unterschiedlich im Ommatidium angeordnet: Es befinden sich sechs Rhabdomere (R1-R6) kreisförmig um das 7. und 8. Rhabdomer, dabei liegt das 7. Rhabdomer über dem 8. Besonders an dem neuronalen Superpositionsauge ist, dass die Rhabdomere R1-R6 und R7+R8 eines Ommatidiums unterschiedliche Blickpunkte wahrnehmen, weil die Photorezeptoren in verschiedenen Winkeln zueinander stehen, wobei R7 und R8 den gleichen Blickpunkt anpeilen. Bei Lichteinfall durch das 7. Rhabdomer wird das nicht absorbierte Licht an das darunter liegende 8. Rhabdomer weitergeleitet. Obwohl jeder Photorezeptor eines Ommatidiums einen anderen Punkt fixiert, wird jeder Blickpunkt durch sechs Photorezeptoren erfasst. Dieser Punkt wird von sechs verschiedenen Photorezeptoren in sechs benachbarten Ommatidien detektiert. Insgesamt kann also ein Ommatidium sieben verschiedene Punkte wahrnehmen, d. h. einen durch die Photorezeptoren R7+R8 und die restlichen sechs durch die sechs Photorezeptoren R1-R6. Durch die retinotope Organisation der Reizverarbeitung der Photorezeptoren R1-R6 wird gewährleistet, dass die Informationen, die von den sechs Photorezeptoren aufgenommen werden, zusammen in einer funktionellen Einheit in der Lamina gesammelt werden. Diese funktionelle Einheit nennt man Cartridge.[34] Da eine Laminacartridge sechsmal die gleiche Information enthält, wird die Lichtsensitivität um den Faktor 6 verbessert. Das ermöglicht bei gleicher räumlicher Auflösung eine verbesserte Anpassung an schlechte Lichtverhältnisse.[35] Die Information der Photorezeptoren R7-8, welche essentiell für das Farbsehen ist, wird nicht in die Lamina, sondern direkt in die Medulla weitergeleitet.
Die optischen Loben des Adultgehirns
Die optischen Loben, bestehend aus Lamina, Medulla und dem Lobulakomplex, stellen Verschaltungsregionen des adulten optischen Systems dar. Sie sind aus repetitiven Untereinheiten aufgebaut und zuständig für die Interpretation der Information der Lichtsinneszellen des Komplexauges.
Lamina
Die Lamina des Komplexauges enthält je Cartridge fünf verschiedene Interneurone L1-L5, die sich in ihren Funktionen unterscheiden. In der Mitte jeder Cartridge liegen die Interneurone L1 und L2. Ihre Aufgabe ist es, Bewegungen wahrzunehmen. Das Interneuron L3 verknüpft die äußeren Photorezeptoren mit den Interneuronen der Medulla, die ebenfalls mit den Photorezeptoren R7 und R8 verbunden sind. Die einzelnen Cartridges werden untereinander durch L4-Neurone verbunden.[36]
Gliazellen sorgen für eine chemische und elektrische Isolation der Cartridges und teilen die Lamina in sechs Schichten ein, wovon jede einen charakteristischen Gliazelltyp aufweist.[37]
Die erste Schicht ist die fenestrierende Schicht, in der die Gliazellen Bündel aus Fotorezeptoren umhüllen, welche aus der Retina hervorgehen.
Die zweite Schicht ist die Pseudocartridge-Schicht, da Axonbündel hier eine den Cartridges ähnliche Form ausbilden. Die Gliazellen weisen eine lange, horizontal ausgedehnte Struktur auf.
In der dritten und vierten Schicht befindet sich die Satelliten-Glia. Diese Schichten kennzeichnen den Beginn des Lamina Cortex mit den Somata der monopolaren Neuronen L1-L5.
Die fünfte Schicht stellt das Lamina-Neuropil dar, in der Bündel aus Rezeptorterminalen und Interneuronen direkt von Gliazellen umhüllt sind. Zusätzlich bilden die Gliazellen Ausstülpungen in die Axone von R1-R6, was zum einen strukturellen Halt bietet und zum anderen einen regen metabolischen Austausch zwischen Glia und Neuron bewirkt.[38]
Die sechste Schicht ist die proximale Grenzschicht. Marginale Gliazellen bilden den Abschluss des Lamina-Neuropils und markieren damit die Wachstumsgrenze für die Axone von R1-R6. Die letzte Schicht wird nur noch von den Axonen der Fotorezeptoren R7 und R8 durchzogen, die direkt in die Medulla hineinreichen.[39]
Medulla
Die Medulla besteht wie die Lamina aus Untereinheiten, die aufgrund ihrer Struktur als „Säulen“ bezeichnet werden. Horizontal wird die Medulla noch einmal in 10 Schichten (M1-M10) unterteilt, wobei die dickste Schicht als Serpentinschicht bezeichnet wird. Die Serpentinschicht unterteilt die Medulla in einen distalen und proximalen Teil. Innerhalb der Serpentinschicht verlaufen Tangentialneurone, die die vertikalen Säulen miteinander verbinden, deren Informationen verschalten und teilweise in das Zentralgehirn weiterleiten. Die Axone der L1-L5 Zellen der Lamina enden in der jeweils zugehörigen Säule in der Medulla, ebenso wie die Photorezeptorzellen R7 und R8. Zwischen der Lamina und der Medulla bilden die Axone ein Chiasma opticum.[40] So kommt in jeder Medullasäule die gebündelte Information von einem Punkt des Sichtfeldes an, indirekt über die monopolaren Zellen der Lamina (L1-L5) und direkt über die Rezeptorzellen R7 und R8. Ausgehend von den verschiedenen Schichten verlassen zwei Arten von Projektionsneuronen die Medulla. Hierbei handelt es sich um Transmedulla-Zellen des Typs Tm und TmY,[41] die verschiedene Säulen der Medulla mit der Lobula (Tm-Typ) oder mit Lobula und Lobula-Platte (TmY-Typ) verbinden und so ein zweites Chiasma opticum bilden.
Lobulakomplex
Der Lobulakomplex, bestehend aus der anterior gelegenen Lobula und der posterior gelegenen Lobula-Platte, ist proximal zur Medulla positioniert und durch ein inneres Chiasma opticum mit ihr verbunden. Der Lobulakomplex stellt eine Verbindung der Medulla mit den visuellen Zentren des Zentralhirns dar, verknüpft also die visuelle Wahrnehmung mit dem Flugverhalten. Die Lobula leitet die erhaltene Bildinformation über den vorderen optischen Trakt zum Zentralhirn weiter, während die Lobulaplatte über Horizontal- und Vertikal-Zellen die jeweiligen Bewegungsinformationen weiterleitet.[42] Der Lobulakomplex hat eine direkte neuronale Verschaltung zum Flugapparat und kodiert richtungsabhängig die Bewegung von Reizmustern.[43]
Funktion des optischen Systems
Die Funktion des visuellen Systems bei D. melanogaster ist die Wahrnehmung und Verarbeitung visueller Information, sowie die Unterscheidung von Lichtverhältnissen bei Tag und Nacht. D. melanogaster kann sehr schnell fliegen. Deshalb muss das visuelle System eine sehr hohe zeitliche Auflösung, sowie eine gut organisierte Weiterleitung der Information leisten. Außerdem kann die Fliege auf mögliche Gefahrenquellen rechtzeitig reagieren und so ihr Überleben sichern. Das zeitliche Auflösungsvermögen liegt bei 265 Bildern pro Sekunde.
Die Fliege kann verschiedene Gegenstände anhand von unterschiedlichen Lichtspektren und Lichtintensitäten unterscheiden. Das spektrale Wahrnehmungsvermögen des Auges liegt zwischen 300 und 650 nm. Die 8 verschiedenen Photorezeptoren unterscheiden sich in den Absorptionsmaxima ihrer Photopigmente, den Rhodopsinen. Die in der Peripherie des Ommatidiums liegenden Photorezeptoren 1-6 (R1-6) exprimieren blau-grünes Rhodopsin 1 (Absorptionsmaximum bei 478 nm) und enthalten zusätzlich kurzwellige ultraviolett-sensitive Pigmente. Die Photorezeptoren 1-6 werden von schwachen Lichtintensitäten und Kontrasten aktiviert. Im Photorezeptor R7 befindet sich entweder Rh3 (345 nm) oder Rh4 (374 nm). Photorezeptor R8 exprimiert Blaulicht-empfindliche (Rh5, 437 nm) oder Grünlicht-empfindliche Rhodopsine (Rh6, 508 nm).[44]
Am dorsalen Rand des Auges exprimieren R7 und R8 Rhodopsin 3, das ultraviolettes Licht absorbiert. Dieser Bereich der Retina dient der Detektion des e-Vektors von polarisiertem Licht. Mit Hilfe des e-Vektors können die Fliegen sich an der Sonne orientieren. Im restlichen Teil der Retina befinden sich zwei Typen von Ommatidien, „pale (p)“ und „yellow (y)“. In der p-Typ Ommatide exprimiert R7 Rh3 und R8 blau-sensitives Rh5. Im y-Typ exprimiert R7 Rh4, das langwelliges UV-Licht absorbiert, und R8 das grün-sensitive Rh6.[45]
Lange wurde angenommen, dass die Photorezeptoren 1-6 ausschließlich für das Bewegungssehen und die Rezeptoren 7 und 8 für das Farbensehen zuständig sind. Fliegen, bei denen die Photorezeptoren 1-6 ausgeschaltet werden, zeigen eine geringe Reaktion in Bezug auf die Bewegung. Jedoch sind alle Photorezeptoren 1-8 am Bewegungssehen beteiligt.[46] Im frühen Larvenstadium ist das wichtigste Ziel der Larve das Fressen. Aus diesem Grund bleiben die Fresslarven innerhalb des Futters und weisen negative Phototaxis auf. Erst kurz vor der Metamorphose zeigen sie positive Phototaxis, die Wanderlarve verlässt die Nahrungsquelle, um sich außerhalb einen Platz zum Verpuppen zu suchen.
Circadianes System
Endogene Uhren helfen lebenden Organismen, sich an tägliche Zyklen der Umgebung anzupassen. D. melanogaster verfügt wie viele andere Lebewesen auch über eine solche "innere Uhr". Dieses sogenannte circadiane System regelt unter anderem metabolische Prozesse, die Entwicklung sowie das Verhalten.
Lokalisation und Aufbau

Bei D. melanogaster liegt die zentrale Uhr im Gehirn und besteht aus zwei lateralen und einer dorsalen Neuronengruppe pro Hemisphäre. Diese Neuronengruppen sind Teil des Protocerebrums. Die erste laterale Neuronengruppe (LN) besteht aus 5-8 dorsal liegenden Neuronen (LNd), die zweite Gruppe liegt ventral (LNv) und wird weiter unterteilt in 4-6 große LNv (l-LNv) und fünf kleine LNv (s-LNv). Die dritte Gruppe bilden die im Gehirn dorsal liegenden Neuronen (DN). Die dorsale Gruppe wird nach der Morphologie und Lokalisation der einzelnen Neuronen weiter unterteilt in etwa 15 DN1 und 2 DN2, die mittelgroß sind und posterior im dorsalen superioren Gehirn liegen. Etwa 40 kleine DN3 Zellen liegen lateral im dorsalen Gehirn. In der Larve findet man vier PDF-exprimierende (siehe Äußere Regulation/ circadiane Kontrolle von Verhalten) laterale Neuronen in jeder Hemisphäre (siehe Abb.1), die im adulten Tier den s-LNv entsprechen. Die l-LNv, LNd und DN entstehen während der Metamorphose. Bis auf die l-LNv projizieren alle Neuronengruppen ins dorsale Protocerebrum. Außerdem senden s-LNv, l-LNv, DN1 und DN3 Projektionen an die akzessorische Medulla. Die l-LNv verbinden die beiden akzessorischen Medullae miteinander über den posterioren optischen Trakt. Ein Ziel der Output-Bahnen der inneren Uhr könnten der Pilzkörper und der Zentralkomplex darstellen. Der Pilzkörper steht vermutlich unter rhythmischer Kontrolle der s-LNv Zellen, die einen circadianen Einfluss auf das Lernen und Gedächtnis haben könnten. Durch die LNd Zellen wird eine Innervation des Zentralkomplexes vermutet, der möglicherweise eine Umschaltstation für circadiane Signale bildet. Die Bewegungsaktivität wird ebenfalls durch circadiane Signale kontrolliert. s-LNv Zellen leiten die Signale an DN1 und DN2, wo sie umgeschaltet und an die Bewegungszentren weitergeleitet werden. Im Gegensatz dazu werden die Signale der LNd im Zentralkomplex umgeschaltet. Auch diese Signale werden weiter in den Bewegungszentren verarbeitet.[47]
Circadiane Kontrolle von Verhalten
Das Circadiane System kontrolliert unter anderem das Bewegungsverhalten, das im Tagesverlauf zwei Aktivitätshöhepunkte aufweist[47][48][49]. Unter Licht-Dunkel -Bedingungen (12 Stunden Licht und 12 Stunden Dunkelheit) sind bei ihr zwei lokomotorische Aktivitätshöhepunkte zum Morgen (ZT= 0) und zum Abend (ZT= 12) zu verzeichnen.[47][49] Diese Aktivitätshöhepunkte sind auch unter konstanten Bedingungen (z. B. Dunkel-Dunkel-Situation) zu beobachten. Der Tagesrhythmus bei Nullmutanten hingegen weist unter konstanten Bedingungen keine Rhythmik auf.[47] Werden sie Hell-Dunkel-Zyklen ausgesetzt, weisen sie jedoch eine Tagesrhythmik auf. Daraus lässt sich schließen, dass die Rhythmik in der lokomotorischen Aktivität auf die innere Uhr und auf das Tageslicht zurückzuführen ist.[48] Die circadiane Synchronisation erfolgt über zwei gekoppelte Oszillatoren, welche aus einem Netzwerk aus LNv und LNd bestehen.[47] Die LNv regulieren die Aktivität kurz vor der Morgendämmerung, die LNd hingegen die Aktivität vor der Abenddämmerung. Dabei spielt das Neuropeptid PDF, das in den s-LNv und l-LNv der beiden Hemisphären exprimiert wird, eine wichtige Rolle. PDF ist ein Outputsignal der inneren Uhr, das für eine rhythmische Aktivität bei einem 12-12h Licht-Dunkel-Zyklus notwendig ist. In Abwesenheit von PDF werden D. melanogaster bei dauerhafter Dunkelheit arhythmisch.[50]
Die Lichtsynchronisation erfolgt über den internen Photorezeptor Cryptochrom (CRY), der in fast allen Schrittmacherzellen vorkommt.[48] Zudem findet die Lichtperzeption auch durch die Facettenaugen, das Hofbauer-Buchner-Äuglein und die Ocellen statt.[48] Neben dem Licht können noch andere Faktoren als äußere Zeitgeber fungieren, z. B. Temperatur und Pheromone.
Molekularer Mechanismus
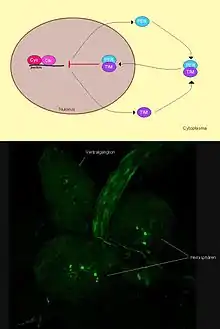
Einen zentralen Aspekt des circadianen Systems bei D. melanogaster stellt der hier kurz skizzierte Mechanismus dar: Um die innere Uhr bzw. den Tag-Nacht-Rhythmus aufrechtzuerhalten, besitzt D. melanogaster eine Reihe von Genen (engl. ‚clock–genes‘ Uhrengene), deren Expression im Tagesverlauf zyklisch schwankt. Zu den Uhrengenen, die in den Uhrenneuronen im Gehirn von D. melanogaster exprimiert werden, gehören Cycle (CYC), Clock (CLK), Period (PER) und Timeless (TIM).[51]
Die beiden Regulatorproteine Clock (CLK) und Cycle (CYC) können zusammen die Transkription der Gene period (per) und timeless (tim) aktivieren. Da das Protein TIM sehr lichtempfindlich ist und TIM PER stabilisiert, können diese beiden Proteine auch nur am Abend bzw. in der Nacht angehäuft werden.[52] Die Proteine PER und TIM bilden dann ein Dimer, das in den Kern wandert und daraufhin im Zellkern die Transkription der Gene Cycle und Clock hemmen kann[50] (siehe Bild). Es handelt sich hierbei also um einen positiven (clk, cyc) und negativen (per, tim) Feedback-Loop, wodurch eine cyclische Expression der Uhrengene gewährleistet wird.[52] Da dieser Mechanismus auf genetischer Ebene abläuft, spricht man hier auch von einem endogenen molekularen Oszillator.
Verhalten
Im larvalen Stadium weist D. melanogaster eine vom circadianen System regulierte negative Phototaxis auf, welche sich durch eine minimale Lichtsensitivität zu Ende des subjektiven Tages (CT= 12) und durch eine maximale Lichtsensitivität gegen subjektiven Morgen (CT= 0) auszeichnet. Evolutionsbiologisch dient dieses Verhalten der Larven wahrscheinlich dazu, Fressfeinde zu vermeiden.[53] Die adulte Fliege weist ebenfalls mehrere von der circadianen Uhr abhängige Verhaltensmuster auf, wie z. B. der Adultschlupf aus der Puppe, welcher zur Zeit des subjektiven Morgens (CT= 0) geschieht, um einen schnellen Wasserverlust zu verhindern.[54] Der Nahrungsaufnahmerhythmus wird sowohl durch Licht als auch durch die circadiane Uhr beeinflusst. Unter Licht-Dunkel-Bedingungen gibt es hierbei einen Nahrungsaufnahmehöhepunkt am Morgen (ZT = 0-2) und darauffolgend eine lange Phase stark verminderter Nahrungsaufnahme (ZT = 8-22). Unter Dunkel-Dunkel-Bedingungen kommt es zu einem Nahrungsaufnahmehöhepunkt von Morgen bis zum Mittag (CT = 0-6) und zu einer stark verminderter Nahrungsaufnahme am späten Tag bis frühen Abend (CT = 8-14).[55] Die Fähigkeit, ein olfaktorisches assoziatives Kurzzeitgedächtnis auszubilden, hat einen Höhepunkt zur Zeit der subjektiven frühen Nacht (CT = 13) und einen weiteren Höhepunkt kurz vor Mitternacht (CT= 17).[56] Die beste Wahrnehmung chemischer Geruchsstoffe, welche sich durch Elektroantennogramme darstellen lässt, findet während der subjektiven Nacht (CT=17) statt. Allerdings ist hierbei ein Zusammenhang zu bestimmten Verhaltensmustern unklar.[57] Das Immunsystem ist während des subjektiven Tages (Infektionszeitpunkt: CT = 5) anfälliger für Bakterieninfektion durch Pseudomonas aeruginosa und Staphylococcus aureus als während der subjektiven Nacht (Infektionszeitpunkt: CT = 17), in der im Falle einer Infektion eine erhöhte Expression von antimikrobiellen Peptiden (AMP) im Vergleich zu einer tagsüber stattfinden Infektion festzustellen ist.[58] Schließlich unterliegt das Balz- und Paarungsverhalten ebenfalls rhythmischen Schwankungen. Diese Schwankungen werden vor allem durch das Verhalten des Männchens bestimmt. Das Balz- und Paarungsverhalten weist einen Höhepunkt zur Zeit des subjektiven Morgens (CT = 0) und gegen Mitternacht (CT = 18), sowie einen Tiefpunkt zur Zeit des subjektiven Abends (CT = 12) auf.[59]
Das neuroendokrine System
Das neuroendokrine System dient der Zell-Zell-Kommunikation. Es sendet Signale von Zellen des Nervensystems über hormonähnliche Botenstoffe an Zielzellen im Gewebe verschiedener Organe.[60] Das neuroendokrine System setzt sich aus neurosekretorischen Zellen zusammen, die in Neurohämalorgane oder neurohämale Zonen projizieren und von dort Botenstoffe (typischerweise Peptide) in die Zirkulation abgeben, um auf das Zielgewebe zu wirken.[61] Durch diese Eigenschaft unterscheiden sich die neurosekretorischen Zellen von gewöhnlichen Neuronen. Die Pars intercerebralis und die Pars lateralis sind dabei wichtige Zentren im dorso-medialen Protocerebrum, die solche neurosekretorischen Zellen beinhalten.[60]
Neuroendokrines System der Larve
In der Larve projizieren die Axone der sekretorischen Neurone der Pars intercerebralis und der Pars lateralis über die Nervi corporis cardiaci in die Ringdrüse. Im larvalen Stadium ist die Ringdrüse ein Komplex aus zwei endokrinen Drüsen, der Prothoraxdrüse sowie dem Corpus allatum, und einem neurohämalen Bereich, der paarigen Corpora cardiaca, die mit der Aorta assoziiert sind. Die Struktur der Ringdrüse verändert sich während der Metamorphose zum adulten Insekt (siehe Metamorphose).[62] Im larvalen Stadium kann man die Ringdrüse gut durch ihre auffallende Struktur, anterior zu den beiden Hirnhemisphären, erkennen. Durch die Nervi Corporis Cardiaci (NCC) ist die Ringdrüse mit dem larvalen Gehirn verbunden. Das größte Volumen in der Ringdrüse nimmt die Prothoraxdrüse ein. Die Zellen teilen und vergrößern sich mit fortschreitender Entwicklung der Larve. Innerhalb der Ringdrüse ist das Corpus Cardiacum ventral unpaarig angelegt und hat eine U-förmige Struktur. In ihrem glandulären Bereich wird das adipokinetische Hormon (AKH) produziert, das im Fettkörper den Abbau von Fetten und Kohlenhydraten stimuliert. In der Prothoraxdrüse wird die Synthese des Steroidhormons Ecdyson durch PTTH (Prothorakotropisches Hormon) aktiviert. Ecdyson ist unter anderem für die adulte Häutung und in Kombination mit dem Juvenilhormon für die larvale Häutung verantwortlich. Das Corpus allatum synthetisiert das Juvenilhormon.[63] In jeder Gehirnhemisphäre findet man fünf Neurone des lateralen Protocerebrums, die die beiden endokrinen Drüsen innervieren. Diese befinden sich in enger Nachbarschaft zu Axonen der circadianen Schrittmacherneurone. Diese Verbindung ist möglicherweise für den circadianen Rhythmus von Häutung und Metamorphose verantwortlich. Außerdem wurde ein ventromediales Neuron gefunden, das die Ringdrüse innerviert und für die Produktion des Schlupfhormons (Eclosionshormon) verantwortlich ist.[64]
Perisympathische Organe
Die perisympathischen Organe (PSO) sind neurohämale Organe, die als Verdickungen am medianen und transversalen Nerv auftreten. In der D. melanogaster Larve findet man sie assoziiert mit den drei thorakalen Neuromeren sowie den abdominalen Neuromeren A2 – A4. Die thorakalen PSO werden jeweils durch ein Zellpaar von Tv-Neuronen, die abdominalen PSO jeweils durch ein Zellpaar von Va-Neuronen im gleichen Neuromer innerviert. Während der Metamorphose verschwinden die PSO und die innervierenden peptidergen Neuriten werden in das ventrale Ganglion mit eingebunden. Ihre Terminalen liegen nach der Metamorphose zwischen dem Zellkörpercortex und der das Nervensystem umhüllenden Glia, wo sie eine neurohämale Zone bilden.[65]
Neurochemie
Quelle[66]
| Larvale und adulte Neuropeptidhormone | Freisetzungsort |
|---|---|
| Adipokinetische Hormone (AKH) | Corpus cardiacum (CC) |
| Bursicon (BURS) | neurohämale Zone |
| CAPA-Periviscerokinin (CAPA-PVK) | abdominale PSO |
| CAPA-Pyrokinin | abdominale PSO, CC |
| Corazonin (CRZ) | CC |
| Crustacean cardioactive Peptide (CCAP) | neurohämale Zone |
| Diuretisches Hormon 31 (DH31) | CC |
| Ecdysis-triggering Hormon (ETH) | epitracheale Zellen |
| FMRFamid | thorakale PSO |
| Hugin-Pyrokinin | CC |
| Insulin-ähnliche Peptide (DILP) | CC |
| Leukokinin (LK) | neurohämale Zone |
| Myoinhibitorisches Peptid (MIP, AstB) | neurohämale Zone |
| Myosuppressin (DMS) | CC |
| Partner of Bursicon (PBURS) | neurohämale Zone |
| Prothorakotropes Hormon (PTTH) | CC |
| Schlupfhormon (Eclosion Hormone, EH) | CC |
| short Neuropeptid F (sNPF) | CC |
In D. melanogaster wurden mindestens 42 verschieden codierende Gene für Vorstufen von Neuropeptiden, Peptidhormonen und Proteinhormonen gefunden. Die meisten Peptidhormone aktivieren G-Protein-gekoppelte Rezeptoren (GPCRs). Es wurden mind. 45 Neuropeptide, Peptid- und Proteinhormone GPCRs identifiziert. Jedes Neuropeptidgen besitzt spezifische Expressionsmuster im larvalen und adulten Nervensystem von D. melanogaster. Neuropeptide können von verschiedenen Neuronentypen produziert werden. Hierzu gehören bei D. melanogaster die olfaktorischen Rezeptorneurone, verschiedene Typen von Interneuronen, neurosekretorische Zellen, Motoneurone und sekretorische Neurone.[66]
DIMMED
Der basische Helix-Loop-Helix (bHLH) Transkriptionsfaktor DIMMED ist ein entscheidender Regulator bei der neuroendokrinen Zelldifferenzierung. Er wird selektiv in den neuroendokrinen Zellen exprimiert und ist anscheinend für die Koordination ihrer molekularen und zellulären Eigenschaften zuständig. Es kommt zu einer transkriptionellen Kontrolle, wobei dies zum Einschlagen des regulierten sekretorischen Weges führt. Der Transkriptionsfaktor versetzt die Zelle in die Lage, LDCVs (large dense-core vesicles) auszubilden und anzuhäufen. Diese Vesikel können Neuropeptide speichern und nach Erhöhung der freien Intrazellulären Calciumkonzentration sezernieren. Zum anderen aktiviert DIMM den kompletten post-translationalen Verarbeitungsprozess von Neuropeptiden. Dadurch können biologisch aktive Peptide aus den Präpropeptiden hergestellt werden. DIMM kann Eigenschaften von neuroendokrinen Zellen auf Neuronen übertragen, die sonst nicht diesem Typ angehören: Nicht-peptiderge Neuronen häufen normalerweise keine ektopischen Neuropeptide an. Nach ektopischer Expression von DIMM können sie dies jedoch. Es gibt peptiderge Neurone, die kein DIMM exprimieren, dabei handelt es sich um Interneurone. Bei einer Überexpression im Wildtyp erhöht sich sowohl das Level an sekretorischen Peptiden in neuroendokrinen Zellen, als auch die Anzahl an Zellen, die einen neuroendokrinen Phänotyp aufweisen.[67]
Funktion des neuroendokrinen Systems
| Funktionen von Neuropetiden und Peptidhormonen | Neuropeptide und Peptidhormone |
|---|---|
| Entwicklung und Wachstum | DILP |
| Fressverhalten | Hugin-PK, NPF, sNPF |
| Wasser- und Ionenhaushalt | DH44, DH31, LK, CAPA-PVK |
| Balzverhalten | SIFamid, SP, NPF |
| Aggressionsverhalten | NPF |
| Bewegung | AKH, DTK |
| Circadianer Outputfaktor | |
| Metabolismus | DILP, AKH |
Metamorphose
Die Metamorphose in D. melanogaster wird vom Wechselspiel zwischen Ecdyson und Juvenilhormon gesteuert. Ist eine hohe Konzentration an Juvenilhormon in der Larve vorhanden, induzieren Ecdysteroide eine Larvenhäutung. Das Juvenilhormon fördert das Larvenwachstum und hemmt die Metamorphose. Liegt eine niedrige Konzentration an diesem Hormon vor, geht die Larve Ecdyson-induziert zur Puppenhäutung über. Ist kein Juvenilhormon mehr vorhanden, jedoch eine hohe Konzentration von Ecdyson, wird die Imaginalhäutung eingeleitet.
Veränderungen der Ringdrüse während der Metamorphose
Die endokrinen Drüsen der Ringdrüse durchlaufen während der Metamorphose drastische Veränderungen. Nach dem Beginn der Verpuppung wandert die Ringdrüse von ihrer Position oberhalb der Gehirnhemisphären zum Ösophagus bis kurz vor den Vormagen (Proventriculus). Eine neue Basallamina legt sich um die einzelnen Teile der Ringdrüse. Die Prothoraxdrüse separiert sich von dem Corpus Allatum und von dem Corpus Cardiacum. Das Corpus Cardiacum verschmilzt mit dem Hypocerebralganglion zu einem Komplex. Zum Ende der Metamorphose nimmt die Ecdyson-Biosynthese ab, da die Prothoraxdrüse degeneriert. 24 Stunden nach der Verpuppung fangen die Prothoraxdrüsenzellen an kleiner zu werden, sich voneinander zu entfernen und leiten schließlich den Zelltod ein. Nur die Zellen der Prothoraxdrüse degenerieren. Corpus Allatum und Corpus Cardiacum dagegen findet man auch im adulten Tier wieder.[68]
Alterungsprozess
Je nach Lebensbedingungen lebt die Taufliege 2-8 Wochen. Die Lebensdauer bei Männchen beträgt allerdings nur ca. 10 Tage.[69] Das Altern in D. melanogaster wird durch Hormone gesteuert. Darunter fallen besonders Ecdyson und Juvenilhormon, die die Seneszenz beeinflussen. Mutationen im Insulin-Signalweg verlängern die Lebensdauer in D. melanogaster und beeinflussen den Hormonspiegel anderer Hormone, darunter besonders Juvenilhormon und Ecdyson. Entfernt man das endokrine Gewebe des JH-produzierenden Corpus Allatum, verlängert sich das Überleben der Fliegen und die Sterblichkeit wird reduziert. Adulte Fliegen, die mit Juvenilhormon behandelt wurden, weisen eine erhöhte Sterblichkeit auf. Daraus folgt, dass das Alter, zumindest zum Teil, durch die neuroendokrine Kontrolle von Juvenilhormon reguliert wird. Diapause in adulten Fliegen verzögert eine Seneszenz und kann die Überlebensrate erhöhen. In Versuchen verlangsamten induzierte Diapausen das Altern. Alter und Sterblichkeit sind von der neuronalen Regulation des Juvenilhormons abhängig. Die neuroendokrine Antwort ist unter anderem abhängig von der Umwelt, die wiederum das Altern beeinflusst.[70]
Drosophila melanogaster als Forschungsobjekt der Genetik

Die Fliege als Untersuchungsobjekt der klassischen Genetik
D. melanogaster wurde in der ersten Hälfte des 20. Jahrhunderts durch die Forschungen des amerikanischen Zoologen und Genetikers Thomas Hunt Morgan und seiner Schule zum Versuchstier der klassischen Genetik. Diese Art hat nur vier verschiedene Chromosomen, die in den D. melanogaster-Zellen paarweise vorkommen: ein Paar Geschlechtschromosomen, die auch als erstes Chromosom oder X- bzw. Y-Chromosom bezeichnet werden, und drei Paar Autosomen, die als zweites, drittes und viertes Chromosom bezeichnet werden. Das vierte Chromosom ist jedoch nur sehr klein und enthält nur wenige Gene. Ideal für die Forschung ist auch, dass die Zucht einer großen Anzahl von Fliegen in Flaschen leicht möglich und die Generationenfolge kurz ist. „Eine halbe Milchtüte mit einem Stück verfaulender Banane genügte, um zweihundert Taufliegen vierzehn Tage lang bei Laune zu halten“, schreibt Martin Brookes in seinem 2002 erschienenen Buch über Drosophila. So hat man eine sehr große Anzahl von Kreuzungsexperimenten mit den Taufliegen durchführen können. Dabei wurden Kopplungsgruppen von Genen, die auf ein und demselben Chromosom sitzen, festgestellt, das Phänomen des Crossing Over entdeckt und auch etliche Mutanten beschrieben und näher untersucht, etwa Fliegen mit weißen statt mit roten Augen oder Exemplare mit Stummelflügeln, die flugunfähig sind. Hermann Muller war der erste, der die mutationsauslösende Wirkung von Röntgenstrahlen auf die Erbsubstanz der Taufliege erkannte. Seitdem wurden die harten Strahlen eingesetzt, um bei den Fliegen eine Vielzahl von unterschiedlichen Mutationen auszulösen.
Die Popularität von D. melanogaster als Modellorganismus hielt zunächst bis in die 1940er Jahre an.
Mit Drosophila synthetica existiert eine genetisch modifizierte Variante, die im Labor derartig stark verändert wurde, dass sie als eigene Art angesehen werden kann.
Ergebnisse der Sequenzanalyse
Im Jahr 2000 wurde die Sequenzierung des Genoms abgeschlossen. Insgesamt 139.731.881 Basenpaare und etwa 13.600 unterschiedliche Gene wurden dabei ermittelt. Diese erste Schätzung muss nach zehn Jahren revidiert werden, da man inzwischen 19.806 Gene kennt. Viele dieser Gene haben zum Teil erstaunliche Ähnlichkeit mit den Genen des Menschen. Forscher haben herausgefunden, dass etwa 70 Prozent der menschlichen Gene, die im Zusammenhang mit Krebs beschrieben wurden und im Verdacht stehen, in mutiertem Zustand an der Krebsentstehung beteiligt zu sein, auch im Erbgut der Taufliege vorkommen.[71][72][73]
Entwicklungsbiologische Forschungen
Auch im Rahmen entwicklungsbiologischer Untersuchungen hat man an den Embryonalstadien der Taufliegen zahlreiche Erkenntnisse gewinnen können. Schon um 1900 war der Harvard-Professor William Ernest Castle der erste, der auf der Suche nach einem Organismus, der sich als Objekt für embryologische Studien eignete, auf die Taufliege stieß. Seitdem hat sich auf diesem Gebiet viel getan. In den 1970er Jahren begann sich Christiane Nüsslein-Volhard mit den Entwicklungsgenen von D. melanogaster zu beschäftigen. Die Entwicklung der Fliege vom Ei bis zum Imago wird über eine Genkaskade verschiedener Gengruppen gesteuert. Dabei beeinflussen die früher in dieser Genkaskade auftretenden Gengruppen jeweils die zeitlich nachfolgenden, nicht jedoch umgekehrt. An erster Stelle stehen die bereits während der Oogenese in Eizelle, Nährzellen und Follikelzellen exprimierten maternalen Koordinatengene. Auf diese folgen während der larvalen Entwicklung zuerst die Lückengene, dann die Paarregelgene und schließlich die Segmentpolaritätsgene. Die homöotischen Gene sorgen zuletzt für die Entwicklung der Organe in den entsprechenden Segmenten. 1980 veröffentlichte sie ihre bahnbrechende Studie über die „Mutationen, die Zahl und Polarität der Segmente bei D. melanogaster beeinflussen“, für die sie 1995 zusammen mit Eric Wieschaus und Edward Lewis den Nobelpreis für Physiologie oder Medizin erhielt.
Vorteile von Drosophila melanogaster als Modellorganismus
D. melanogaster ist eine Fliegenart, die sehr einfach und billig zu züchten ist. In der Genforschung wird D. melanogaster bevorzugt als Forschungsobjekt verwendet, weil sie eine kurze Generationsfolge (etwa 9–14 Tage) aufweist, aus einer Generation bis zu 400 Nachkommen entspringen, jedes Individuum nur vier Chromosomenpaare besitzt und weil die Art viele leicht erkennbare Genmutationen zeigt. Mit dem Gal4/UAS-System steht ein genetisches Werkzeug zur Verfügung, welches die Expression beliebiger Gene in spezifisch ausgewählten Zellen erlaubt.
Verwendung als Lebendfutter
Neben der Verwendung in der Genetik ist D. melanogaster auch als Futtertier beliebt, zum Beispiel zur Fütterung von Fischen oder kleinen Reptilien und Amphibien. Dabei werden vor allem flugunfähige Mutanten verwendet, weil sie einfacher zu handhaben sind.
Drosophila melanogaster-Forschungsgemeinschaft
In den USA findet in wechselnden Städten jährlich die größte internationale Drosophila-Konferenz statt. Sie hat etwa 2000 Teilnehmer. Die europäische Drosophila-Konferenz hat im Schnitt 400 bis 500 Teilnehmer und findet alle zwei Jahre in wechselnden europäischen Ländern statt. Eine kleine deutsche regionale Tagung gibt es jährlich. Des Weiteren ist D. melanogaster als Forschungsobjekt auf vielen internationalen Life Science-, Entwicklungsbiologie-, Neurobiologie- und weiteren Tagungen vertreten.
Mutationen
Die Züchtungen in den wissenschaftlichen Laboratorien haben eine Unzahl von Mutationen hervorgebracht. In systematischen Screens wurde inzwischen ein Großteil der etwa 13400 Gene mutiert.
Literatur
- Karl-Friedrich Fischbach: Funktionelle Differenzierung und Wechselwirkungen der Rezeptorsysteme im Komplexauge von Drosophila melanogaster. Freiburg 1976, DNB 770769349.
- David B. Roberts: Drosophila: A practical Approach. IRL Press, Oxford/ Washington DC, 1986, ISBN 0-947946-45-4.
- Peter A. Lawrence: The making of a fly. The genetics of animal design. Blackwell Science, 1992, ISBN 0-632-03048-8.
- Robert E. Kohler: Lords of the fly. Drosophila genetics and the experimental life. University of Chicago Press, 1994, ISBN 0-226-45062-7.
- Gerald M. Rubin, Edward B. Lewis: A brief history of Drosophila's contributions to genome research. In: Science. Band 287, 2000, S. 2216–2218, doi:10.1126/science.287.5461.2216.
- Martin Brookes: Drosophila – Die Erfolgsgeschichte der Fruchtfliege. Rowohlt Verlag, Hamburg 2002, ISBN 3-498-00622-3.
- Christian Dahmann (Hrsg.): Drosophila: methods and protocols. Humana Press/ Springer, Berlin 2008, ISBN 978-1-4939-6369-0.
Einzelnachweise
- Stefan von Kéler: Entomologisches Wörterbuch. Akademie-Verlag, Berlin 1963.
- EPPO Global Database: Drosophila melanogaster(DROSME).
- Kim van der Linde, David Houle, Greg S. Spicer, Scott J. Steppan: A supermatrix-based molecular phylogeny of the family Drosophilidae. In: Genetic Research. Band 92, 2010, S. 25–38. doi:10.1017/S001667231000008X
- Amir Yassin: Phylogenetic classification of the Drosophilidae Rondani (Diptera): the role of morphology in the postgenomic era. In: Systematic Entomology. Band 38, 2013, S. 349–364. doi:10.1111/j.1365-3113.2012.00665.x (open access)
- Jian-jun Gao, Yao-guang Hub, Masanori J. Toda, Toru Katoh, Koichiro Tamura: Phylogenetic relationships between Sophophora and Lordiphosa, with proposition of a hypothesis on the vicariant divergences of tropical lineages between the Old and New Worlds in the family Drosophilidae. In: Molecular Phylogenetics and Evolution. Band 60, 2011, S. 98–107. doi:10.1016/j.ympev.2011.04.012
- Amir Yassin: A fly by any other name. In: New Scientist. June 2010, S. 24–25.
- Kim van der Linde: Case 3407: Drosophila Fallén, 1832 (Insecta, Diptera): proposed conservation of usage. In: Bulletin of Zoological Nomenclature. Band 64, Nr. 4, 2007, S. 238–242.
- Opinion 2245 (Case 3407) Drosophila Fallén, 1823 (Insecta, Diptera): Drosophila funebris Fabricius, 1787 is maintained as the type species. In: Bulletin of Zoological Nomenclature. Band 67, Nr. 1, S. 106–115.
- Jaroslav Flegr: Why Drosophila is not Drosophila any more, why it will be worse and what can be done about it? In: Zootaxa. Band 3741, Nr. 2, 2013, S. 295–300.
- A. Overmeyer: Vorliebe für Orangen schützt Fruchtfliegen vor Parasiten. MPI Pressemitteilung.
Hany KM Dweck u. a.: Olfactory Preference for Egg Laying on 'Citrus' Substrates in 'Drosophila'. In: Current Biology. 2013. - Introduction to Drosophila
- L. O. Penalva, I. Sanchez: RNA binding protein sex-lethal (Sxl) and control of Drosophila sex determination and dosage compensation. In: Microbiol Mol Biol Rev. Band 67, Nr. 3, Sep 2003, S. 343–359. PMID 12966139, table of contents.
- M. Demerec: Biology of Drosophila. Hafner Publishing, New York/ London 1965, ISBN 0-02-843870-1.
- Ariane Ramaekers u. a.: Glomerular maps without cellular redundancy at successive levels of the Drosophila larval olfactory circuit. In: Current biology: CB. Band 15, Nr. 11, 2005, S. 982–992, PMID 15936268.
- Dennis Pauls u. a.: Drosophila Larvae Establish Appetitive Olfactory Memories via Mushroom Body Neurons of Embryonic Origin. In: The Journal of Neuroscience. Band 30, Nr. 32, 2010, S. 10655–10666, PMID 20702697.
- Voker Hartenstein: Atlas of Drosophila Development. Cold Spring Harbor Laboratory Press, Cold Spring Harbor/ New York 1993, ISBN 978-0-87969-472-2.
- R. Strauss, M. Heisenberg: A higher control center of locomotor behavior in the Drosophila brain. In: The Journal of Neuroscience. Band 13, Nr. 5, 1993, S. 1852–1861, PMID 8478679.
- C. G. Galizia, W. Rössler: Parallel Olfactory Systems in Insects: Anatomy and Function. In: Annual Reviews of Entomology. Band 55, 2010, S. 399–420, doi:10.1146/annurev-ento-112408-085442, PMID 19737085.
- T. Zars, R. Wolf, R. Davis, M. Heisenberg: Tissue-specific expression of a type I adenylyl cyclase rescues the rutabaga mutant memory defect: in search of the engram. In: Learning & memory. Band 7, Nr. 1, 2000, S. 18–31, PMID 10706599.
- R. Spiess, A. Schoofs, H. G. Heinzel: Anatomy of the stomatogastric nervous system associated with the foregut in Drosophila melanogaster and Calliphora vicina third instar larvae. In: Journal of Morphology. Band 269, Nr. 1, 2008, S. 272–282, PMID 17960761.
- Madeleine Tissot, Reinhard F. Stocker: Metamorphosis in Drosophila and other insects: the fate of neurons throughout the stages. In: Progress in Neurobiology. Band 62, Nr. 1, 2000, S. 89–111, PMID 10821983.
- Richard B. Levine, David B. Morton, Linda L. Restifo: Remodeling of the insect nervous system. In: Current Opinion in Neurobiology. Band 5, Nr. 1, 1995, S. 28–35, PMID 7773002.
- James W. Truman: Metamorphosis of the Central Nervous System of Drosophila. In: Journal of Neurobiology. Band 21, Nr. 7, 1990, S. 1072–1084, PMID 1979610.
- Amina Kurtovic, Alexandre Widmer, Barry J. Dickson: A single class of olfactory neurons mediates behavioural responses to a Drosophila sex pheromone. In: Nature. Band 446, Nr. 7135, 2007, S. 542–546, doi:10.1038/nature05672, PMID 17392786.
- Sebastian Cachero, Aaron D. Ostrovsky, Jai Y. Yu, Barry J. Dickson, Gregory S. X. E. Jefferis: Sexual Dimorphism in the Fly Brain. In: Current Biology. Band 20, Nr. 18, 2010, S. 1589–1601, PMID 20832311.
- Jai Y. Yu, Makoto I. Kanai, Ebru Demir, Gregory S. X. E. Jefferis, Barry J. Dickson: Cellular Organization of the Neural Circuit that Drives Drosophila Courtship Behavior. In: Current Biology. Band 20, Nr. 18, 2010, S. 1602–1614, PMID 20832315.
- P. Green, A. Y. Hartenstein, V. Hartenstein: The embryonic development of the Drosophila visual system. In: Cell and Tissue Research. Band 273, Nr. 3, September 1993, S. 583–598.
- C. Y. Ting, C. H. Lee: Visual circuit development in Drosophila. In: Current Opinion in Neurobiology. Band 17, 2007, S. 65–72, doi:10.1016/j.conb.2006.12.004.
- S. G. Sprecher, F. Pichaud, C. Desplan: Adult and larval photoreceptors use different mechanisms to specify the same Rhodopsin fates. In: Genes&Development. Band 21, Nr. 17, September 2007, S. 2182–2195, doi:10.1101/gad.1565407.
- J. Hassan, B. Iyengar, N. Scantlebury, V. Rodriguez Moncalvo, A. R. Campos: Photic input pathways that mediate the Drosophila larval response to light and circadian rhythmicity are developmentally related but functionally distinct. In: The Journal of Comparative Neurology. Band 481, 2005, S. 266–275, doi:10.1002/cne.20383.
- M. Friedrich: Drosophila as a Developmental Paradigm of Regressive Brain Evolution: Proof of Principle in the Visual System. In: Brain, Behavior and Evolution. Nr. 3, 2011, S. 199–215, doi:10.1159/000329850.
- C. Helfrich-Förster: The extraretinal eyelet of Drosophila: development, ultrastructure and putative circadian function. In: Journal of Neuroscience. Band 22, 2002, S. 9255–9266.
- J. P. Kumar: Building an Ommatidium One Cell at a Time. In: Developmental Dynamics. Band 241, Nr. 1, 2011, S. 136–149, doi:10.1002/dvdy.23707.
- E. Pyza: Dynamic Structural Changes of Synaptic Contacts in the Visual System of Insects. In: Microscopy Research and Technique Developmental Dynamics. Band 58, 2002, S. 335–344, PMID 12214300.
- M. Tsachaki, S. G. Sprecher: Genetic and Developmental Mechanisms Underlying the Formation of the Drosophila. In: Developmental Dynamics. Band 241, 2011, S. 40–56, doi:10.1002/dvdy.22738.
- I. A. Meinertzhagen, E. Pyza: Neurotransmitter regulation of circadian structural changes in the fly’s visual system. In: Microscopy research and technique. Band 45, Nr. 2, 1999, S. 96–105, doi:10.1002/(SICI)1097-0029(19990415)45:2<96::AID-JEMT4>3.0.CO;2-L, PMID 10332727.
- R. L. Saint Marie, S. D. Carlson: The fine structure of neuroglia in the lamina ganglionaris of the housefly. In: Musca domestica L. Journal of Neurocytology. Band 12, Nr. 2, 1983, S. 213–241, doi:10.1007/BF01148463.
- W. S. Stark, S. D. Carlson: Ultrastructure of capitate projections in the optic neuropil of Diptera. In: Cell and tissue research. Band 246, Nr. 3, 1986, S. 481–486, doi:10.1007/BF00215187.
- M. L. Winberg, S. E. Perez, H. Steller: Generation and early differentiation of glial cells in the first optic ganglion of Drosophila melanogaster. In: Development. Band 115, Nr. 4, 1992, S. 903–911.
- K.-F. Fischbach, A. P. M Dittrich: The optic lobe of Drosophila melanogaster. I A Golgi analysis of wild-type structure. In: Cell Tissue Research. 1989, doi:10.1007/BF00218858.
- Shamprasad Varija Raghu, Alexander Borst: Candidate Glutamatergic Neurons in the Visual System of Drosophila. In: PLoS ONE. Band 6, Nr. 5, 2011, Artikel e19472, doi:10.1371/journal.pone.0019472.
- K. Fischbach, A. P. M. Dittrich: The optic lobe of Drosophila melanogaster. I. A Golgi analysis of wild-type structure. In: Cell and Tissue Research. Band 258, Nr. 3, 1989, S. 441–475, doi:10.1007/BF00218858.
- M. A. Frye, M. H. Dickinson: Fly flight: a model for the neural control of complex behavior. In: Neuron. Band 32, Nr. 3, 2001, S. 385–388, doi:10.1016/S0896-6273(01)00490-1.
- E. Salcedo, A. Huber, S. Henrich, L. V. Chadwell, W. H. Chou, R. Paulsen, S. G. Britt: Blue- and green-absorbing visual pigments of Drosophila: ectopic expression and physiological characterization of the R8 photoreceptor cell-specific Rh5 and Rh6 rhodopsins. In: The Journal of Neuroscience. Band 19, Nr. 24, 1999, S. 10716–10726.
- Satako Yamaguchi, Claude Desplan, Martin Heisenberg: Contribution of photoreceptor subtypes to spectral wavelength preference in Drosophila. In: PNAS. 2008, doi:10.1073/pnas.0809398107.
- Trevor J. Wardill, Olivier List, Xiaofeng Li, Siedhartha Dongre, Marie McCulloch, Chun-Yuan Ting, Cahir J. O´Kane, Shiming Tang, Chi-Hon Lee, Roger C. Hardie, Mikko Juusola: Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. In: Science. 2012, doi:10.1126/science.1215317.
- C. Helfrich-Förster: Neurobiology of the fruit fly’s circadian clock. In: Genes, Brain and Behaviour. 2005, S. 65–76.
- Dennis C. Chang: Neural circuits underlying circadian behavior in Drosophila melanogaster. In: Behav Processes. 2005.
- D. Stoleru, Y. Peng u. a.: Coupled oscillators control morning and evening locomotor behaviour of Drosophila. In: letters to nature. 2004.
- Michael N. Nitabach, Paul H. Taghert: Organization of the Drosophila Circadian Control Circuit. In: Current Biology. Band 18, Nr. 2, Januar 2008, S. R84-R93.
- Hannele Kauranen, Pamela Menegazzi, Rodolfo Costa, Charlotte Helfrich-Förster, Annaliisa Kankainen, Anneli Hoikkala: Flies in the North. In: Biol. Rhythms. Band 27, Nr. 5, Oktober 2012, S. 377–387, PMID 23010660.
- Nicolai Peschel, Charlotte Helfrich-Förster: Setting the clock- by nature: Circadian rhythm in the fruitfly Drosophila melanogaster. In: FEBS Letters. Band 858, Nr. 10, Mai 2011, S. 1435–1442.
- Esteban O. Mazzoni, Claude Desplan, Justin Blau: Circadian Pacemaker Neurons Transmit and Modulate Visual Information to Control a Rapid Behavioral Response. In: Neuron. Band 45, Nr. 2, 2005, S. 293–300, doi:10.1016/j.neuron.2004.12.038, PMID 15664180.
- Colin S. Pittendrigh: ON TEMPERATURE INDEPENDENCE IN THE CLOCK SYSTEM CONTROLLING EMERGENCE TIME IN DROSOPHILA. In: Proc Natl Acad Sci U S A. Band 40, Nr. 10, 1954, S. 1018–1029, PMC 534216 (freier Volltext).
- K. Xu, X. Zheng, A. Sehgal: Regulation of feeding and metabolism by neuronal and peripheral clocks in Drosophila. In: Cell Metabolism. Band 8, Nr. 4, 2008, S. 289–300, PMID 18840359, PMC 2703740 (freier Volltext).
- Lisa C. Lyons, Gregg Roman: Circadian modulation of short-term memory in Drosophila. In: Learning Memory. Band 16, Nr. 1, 2009, S. 19–27, doi:10.1101/lm.1146009, PMC 2632854 (freier Volltext).
- Balaji Krishnan, Stuart E. Dryer, Paul E. Hardin: Letters to Nature. In: Nature. Band 400, 1999, S. 375–378, doi:10.1038/22566.
- J. E. Lee, I. Edery: Circadian regulation in the ability of Drosophila to combat pathogenic infections. In: Current Biology. Band 18, Nr. 3, 2008, S. 195–199, PMID 18261909, PMC 2279094 (freier Volltext).
- Shinsuke Fujii, Parthasarathy Krishnan, Paul Hardin, Hubert Amrein: Nocturnal Male Sex Drive in Drosophila. In: Current Biology. Band 17, Nr. 3, 2007, S. 244–251, doi:10.1016/j.cub.2006.11.049, PMC 2239012 (freier Volltext).
- V. Hartenstein: The neuroendocrine system of invertebrates: A developmental and evolutionary perspective. In: The Journal of endocrinology. Band 190. Los Angeles 2006, S. 555–570, PMID 17003257.
- S. Siga: Anatomy and functions of brain neurosecretory cells in diptera. In: Microscopy research and technique. Band 62. Osaka 2003, S. 114–131, PMID 12966498.
- B. de Velasco, T. Erclik, D. Shy, J. Sclafani, H. Lipshitz, R. McInnes, V. Hartenstein: Specification and development of the pars intercerebralis and pars lateralis, neuroendocrine command centers in the drosophila brain. In: Developmental biology. Band 302. Los Angeles 2007, S. 309–323, PMID 17070515.
- B. De Velasco, J. Shen, S. Go, V. Hartenstein: Embryonic development of the drosophila corpus cardiacum, a neuroendocrine gland with similarity to the vertebrate pituitary, is controlled by sine oculis and glass. In: Developmental biology. Band 274. Los Angeles 2004, S. 280–294, PMID 15385159.
- T. Siegmund, G. Korge: Innervation of the ring gland of drosophila melanogaster. In: The Journal of comparative neurology. Band 431. Berlin 2001, S. 481–491, PMID 11223816.
- Jonathan G. Santos, Edit Pollák, Karl-Heinz Rexer, László Molnár, Christian Wegener: Morphology and metamorphosis of the peptidergic Va neurons and the median nerve system of the fruit fly, Drosophila melanogaster. In: Cell Tissue Res. Band 326, 2006, S. 187–199.
- D. R. Nassel, A. M. Winther: Drosophila neuropeptides in regulation of physiology and behavior. In: Progress in Neurobiology. Band 92. Stockholm 2010, S. 42–104, PMID 20447440.
- D. Park, T. Hadzic, P. Yin, J. Rusch, K. Abruzzi, M. Rosbash, J. B. Skeath, S. Panda, J. V. Sweedler, P. H. Taghert: Molecular organization of drosophila neuroendocrine cells by dimmed. In: Current biology. Band 21. St. Louis 2011, S. 1515–1524, PMID 21885285.
- J. D. Dai, L. I. Gilbert: Metamorphosis of the corpus allatum and degeneration of the prothoracic glands during the larval-pupal-adult transformation of drosophila melanogaster: A cytophysiological analysis of the ring gland. In: Developmental biology. Band 144. Chapel Hill 1991, S. 309–326, PMID 1901285.
- Siehe Wie lang ist die Fruchtfliegen Lebensdauer?
- M. Tatar: The neuroendocrine regulation of drosophila aging. In: Experimental Gerontology. Band 39. Rhode Island 2004, S. 1745–1750, PMID 15582291.
- MapViewer Eintrag
- Proteom bei UniProt
- M. D. Adams, S. E. Celniker, R. A. Holt u. a.: The genome sequence of Drosophila melanogaster. In: Science. Band 287, Nr. 5461, März 2000, S. 2185–2195, PMID 10731132.
Weblinks
- Drosophila melanogaster im National Center for Biotechnology Information (NCBI)
- Flymove – Schulausgabe auch auf Deutsch
- Flybase (englisch)
- Interactive Fly (englisch)
- www.wissenschaft.de: Reaktion auf Alkohol liegt bei Drosophila in den Genen
