Lithiumperoxid
Lithiumperoxid, Li2O2 ist eine Sauerstoffverbindung des Alkalimetalls Lithium.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
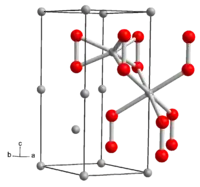 | ||||||||||||||||
| _ Li+ _ O− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumperoxid | |||||||||||||||
| Andere Namen |
Dilithiumperoxid | |||||||||||||||
| Verhältnisformel | Li2O2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 45,88 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,36 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
exotherme Reaktion mit Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Die Darstellung erfolgt durch Umsetzung von Lithiumhydroxid mit Wasserstoffperoxid und anschließendem Erhitzen unter Abspaltung von Wasserstoffperoxid[4]
Eigenschaften
Lithiumperoxid ist ein in reinster Form farbloser, gewöhnlich gelblicher Feststoff. Mit Wasser erfolgt Bildung von Wasserstoffperoxid. Die Verbindung hat eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und den Gitterparametern a = 3,183 Å und c = 7,726 Å.[5] Die Kristallstruktur enthält zwei kristallographisch verschiedene Li-Atome. Eines ist von den sechs Sauerstoffatomen dreier Perioxidionen koordiniert, das zweite in einem verzerrten Oktaeder von den Sauerstoffatomen sechs benachbarter Peroxidionen. Die Standardbildungsenthalpie von Lithiumperoxid beträgt ΔHf0 = −633 kJ/mol.[6]
Verwendung
Lithiumperoxid kann zur Herstellung hochreinen Lithiumoxids eingesetzt werden. Hierbei wird Lithiumperoxid bei 195 °C zersetzt, wobei sich Lithiumoxid und Sauerstoff bilden:[4]
Des Weiteren wird es in der Raumfahrt zur Regeneration der lebenserhaltenden Gasversorgungssysteme eingesetzt. Mit Kohlenstoffdioxid reagiert es zu Lithiumcarbonat und Sauerstoff. Hierdurch wird der Atemluft Kohlenstoffdioxid entzogen und Sauerstoff freigesetzt.[7]
Lithiumperoxid findet Verwendung als Härter für spezielle Polymere.[8] Es wird weiterhin für die sich in der Entwicklung befindenden Lithiumperoxid-Akkumulatoren verwendet bzw. beim Entladebetrieb in der Batterie gebildet.
Einzelnachweise
- Eintrag zu Lithiumoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- Datenblatt Lithiumperoxid bei AlfaAesar, abgerufen am 15. Dezember 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Lithium peroxide bei Sigma-Aldrich, abgerufen am 8. April 2011 (PDF).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1263.
- Luis Guillermo Cota, Pablo de la Mora: On the structure of lithium peroxide, Li2O2. In: Acta Crystallographica Section B Structural Science. 61, 2005, S. 133–136, doi:10.1107/S0108768105003629.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1176.
- N. N. Greenwood, A. Earnshaw: Chemistry of the Elements. 1997, 2. Auflage, Oxford:Butterworth-Heinemann, ISBN 0-7506-3365-4.
- Patent DE2365449 1975 Thiokol Chemical Corp.

