Deuterium
Deuterium (von altgriechisch δεύτερος deúteros, „der Zweite“) ist ein natürliches Isotop des Wasserstoffs. Sein Atomkern wird auch Deuteron genannt, er besteht aus einem Proton und einem Neutron. Deuterium (2H) wird aufgrund seiner Masse auch als „schwerer Wasserstoff“ bezeichnet. Es wurde 1931 von den US-amerikanischen Chemikern Harold C. Urey und Ferdinand Brickwedde sowie George Murphy entdeckt. Urey erhielt dafür 1934 den Nobelpreis für Chemie.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Deuterium | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | D2 (molekulare Form) | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
0,17 kg·m−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−249,58 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Die beiden anderen natürlichen Isotope des Wasserstoffs sind Protium (1H) und Tritium (3H). Aufgrund der großen Bedeutung der Isotope und weil die Massen sich stark unterscheiden, verwendet man für die Isotope Deuterium und Tritium auch eigene Symbole: D und T.
Der Name Deuterium stammt von Gilbert Newton Lewis (der Lehrer von Urey), der auch als erster schweren Wasserstoff herstellte.[4] Hinweise auf das Isotop gab es schon mit der Entwicklung der Massenspektrometrie in den 1920ern.
Beschreibung
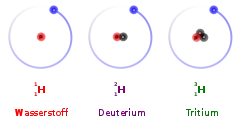
Das chemische Symbol ist 2H; aus Gründen der Vereinfachung in der Formelschreibweise wird häufig auch „D“ verwendet.
Im Gegensatz zum 1H-Wasserstoff, dessen Atomkern nur aus einem einzigen Proton besteht, enthält der Deuteriumkern außer diesem Proton ein Neutron. Der Stoffmengenanteil an Deuterium in den auf der Erde natürlich vorkommenden Wasserstoffatomen beträgt 0,015 Prozent.[2]
Es wird davon ausgegangen, dass Deuterium allein in der primordialen Nukleosynthese unmittelbar nach dem Urknall entstanden ist, denn das bei der stellaren Nukleosynthese gebildete Deuterium fusioniert nach kurzer Zeit weiter zu Helium. Deshalb ist die Häufigkeit des Deuteriums im Kosmos ein wichtiger Parameter für kosmologische Modelle.
Chemisch verbinden sich im einfachsten Fall zwei Deuterium-Atome zu einem Deuterium-Molekül. Dabei gibt es je nach Gesamtspin IG des Moleküls zwei Varianten, das Orthodeuterium (o-D2), wenn das Kernspinisomer den Gesamtspin 0 oder 2 besitzt, und das Paradeuterium (p-D2) im Falle IG = 1.
In der Natur kommt es wegen seiner geringen Häufigkeit fast ausschließlich in Form des Moleküls HD vor.
Vorkommen
Die natürliche Häufigkeit des Isotops Deuterium beträgt auf der Erde 0,015 Prozent (Stoffmengenanteil).[2] Das auf der Erde vorkommende Wasser (1,4 Milliarden Kubikkilometer oder 1,4 ·1018 Tonnen) besteht zu rund einem Neuntel (2 u von 18 u) bzw. zu 11,19 Prozent seiner Masse aus Wasserstoff (einschließlich Deuterium), daher enthält es 0,0035 Prozent oder 5·1013 Tonnen Deuterium. Dieses ist überwiegend als DHO und sehr selten als D2O gebunden.
Im Wasserdampf der Venusatmosphäre hat Deuterium einen Stoffmengenanteil von 1,6 %,[2] in Proben des Kometen Tschurjumow-Gerassimenko wurde ein 2H/1H-Verhältnis von 0,053 % gemessen.[5]
Gewinnung
Deuterium lässt sich aufgrund des großen relativen Massenunterschieds leichter anreichern als die Isotope anderer Elemente wie Uran. In den ersten Anreicherungsstufen kommt gewöhnlich der Girdler-Sulfid-Prozess zum Einsatz. Dabei wird ausgenutzt, dass in einer wässrigen Schwefelwasserstoff-Lösung die Wasserstoffatome und die Deuteriumatome ihre Plätze zwischen beiden Molekülarten tauschen: Bei niedrigen Temperaturen wandert das Deuterium bevorzugt in das Wassermolekül, bei hohen Temperaturen in das Schwefelwasserstoffmolekül. In der letzten Anreicherungsstufe wird das Gemisch aus H2O, HDO und D2O durch Destillation getrennt.
Neben dem Girdler-Sulfid-Prozess kann Deuterium auch durch Destillation und Elektrolyse angereichert werden.
Anwendungen

Eingesetzt wird Deuterium als Moderator in Kernreaktoren (hier in Form von schwerem Wasser), als Brennstoff in Wasserstoffbomben und künftig in Kernfusionsreaktoren, als Ersatz für Protium (gewöhnlichen Wasserstoff) in Lösungsmitteln für die 1H-NMR-Spektroskopie und als Tracer in der Chemie und Biologie. Dort ist es ebenfalls in der NMR-Spektroskopie (insbesondere der Festkörper-NMR) ein wichtiges Isotopen-Label, um die Dynamik in organischen Substanzen zu detektieren und Strukturen aufzuklären. Ferner wird gasförmiges Deuterium in Speziallampen in Photometern eingesetzt, z. B. in der Atomspektroskopie als Quelle für UV-Licht.[6]
Schweres Wasser

Ersetzt man beim Wasser (H2O) den Wasserstoff durch Deuterium, so erhält man schweres Wasser (D2O). In Mischungen liegt durch den schnellen Austausch von Protonen und Deuteronen statistisch auch halbschweres Wasser (HDO) vor.
Die Dichte von D2O beträgt 1,1047 g·cm−3 bei 25 °C, der Schmelzpunkt liegt bei 3,8 °C und der Siedepunkt bei 101,4 °C. Das Dichtemaximum liegt bei 11,2 °C (Wasser: 3,98 °C). Diese Unterschiede der physikalischen Eigenschaften gegenüber Wasser bezeichnet man als Isotopeneffekt. Er ist unter allen Nukliden zwischen 1H und 2H am stärksten ausgeprägt.
Schweres Wasser verlangsamt oder unterbindet viele Stoffwechselvorgänge, weswegen die meisten Lebewesen bei sehr hohem Deuteriumgehalt nur noch eingeschränkt lebensfähig sind.
- Schweres Wasser besitzt eine verminderte Lösefähigkeit im Vergleich zu normalem Wasser.
- Deuteronen haben ein geringeres Tunnelvermögen als Protonen und erschweren daher in biologischen Systemen die Aufrechterhaltung der elektrochemischen Gradienten an mitochondrialen Membranen. Diese sind aber ausschlaggebend für die Synthese von ATP.
- Die Funktionsfähigkeit der meisten Proteine hängt von der Beweglichkeit der umgebenden Wassermoleküle ab. Da Deuteronen wegen der größeren Masse träger sind, können die Proteine ihre Aufgaben nur schlechter oder überhaupt nicht mehr erfüllen.
Laut einem kurzen Beitrag von Urey und Failla von 1935 sollte sich der Geschmack von schwerem Wasser von dem destillierten „normalen“ Wassers nicht unterscheiden.[7] Neuere Experimente konnten jedoch zeigen, dass schweres Wasser für Menschen einen süßlichen Geschmack hat.[8]
Sicherheitshinweise
Deuterium ist im Anhang VI der Verordnung (EG) Nr. 1272/2008 (CLP) nicht aufgeführt, ist aber in dieser Beziehung wie Wasserstoff zu betrachten, da sich alle Isotope eines Elements bezüglich ihres chemischen Verhaltens und ihrer Gefährlichkeit sehr ähnlich sind.
Einzelnachweise
- Air Liquide: Deuterium.
- Eintrag zu Deuterium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2022.
- Eintrag zu Deuterium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Derek Lowe, Das Chemiebuch, Librero 2017, S. 286
- K. Altwegg, H. Balsiger, A. Bar-Nun, J. J. Berthelier, A. Bieler: 67P/Churyumov-Gerasimenko, a Jupiter family comet with a high D/H ratio. In: Science. Band 347, Nr. 6220, 23. Januar 2015, ISSN 0036-8075, S. 1261952, doi:10.1126/science.1261952 (science.org [abgerufen am 3. März 2022]).
- goehler-hplc.de: UV-Photometerlampen (Deuteriumlampen), abgerufen am 27. Mai 2013.
- H. C. Urey, G. Failla: Concerning the Taste of Heavy Water. In: Science Bd. 81, Nr. 2098, S. 273, doi:10.1126/science.81.2098.273-a.
- Human Taste Buds Can Tell The Difference Between Normal And 'Heavy' Water, Beitrag von Peter Dockrill vom 11. April 2021 auf Science Alert, abgerufen am 11. April 2021.

