Tetrahydrofuran
Tetrahydrofuran (THF) ist ein organisches Lösungsmittel und gehört zur Stoffklasse der (cyclischen) Ether.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrahydrofuran | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 72,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,89 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
64 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser,[1] Ethanol, Aceton und Diethylether[2] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,4070[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung und Gewinnung
Für die Herstellung von Tetrahydrofuran gibt es verschiedene Produktionsverfahren. Das am häufigsten angewendete Verfahren ist das schon in den 1930er Jahren entwickelte Reppe-Verfahren.[6] Ausgehend von Acetylen 1 und Formaldehyd wird zunächst das 2-Butin-1,4-diol (2) gebildet. Nach dessen Hydrierung zum 1,4-Butandiol (3) wird durch eine säurekatalysierte Cyclisierung das THF 4 erhalten.[6]

Ein weiteres Herstellverfahren geht vom 1,3-Butadien (5) aus.[6][7] Dieses wird oxidativ bei 80 °C und 3 MPa mit Essigsäure über einen Palladium-Tellur-Katalysator zum 2-Buten-1,4-dioldiacetat (6) umgesetzt. Nach der Hydrierung zum 1,4-Butandioldiacetat (7) und gezielter Hydrolyse des Esters 8 wird das THF 4 gebildet. Alternativ kann der Prozess zum 1,4-Butandiol als Endprodukt geführt werden.

THF kann weiterhin durch die Hydrierung von Furan gewonnen werden.[8][9][10] Eine neuere Synthese basiert auf der Gasphasenhydrierung von Maleinsäuredimethylester.[11] Hierbei läuft eine Reaktionssequenz über die Zwischenstufen Dimethylsuccinat, γ-Butyrolacton und 1,4-Butandiol.
Eigenschaften
Physikalische Eigenschaften
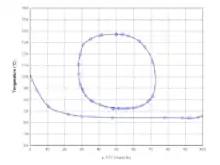
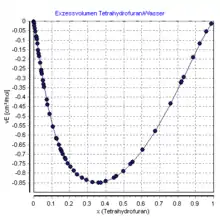
Tetrahydrofuran ist eine farblose, brennbare Flüssigkeit mit etherartigem Geruch. Es ist mit Wasser bis zu einer Temperatur von 71,8 °C vollständig mischbar, oberhalb dieser Temperatur bildet sich eine kleine Mischungslücke aus, die sich bei 137,1 °C wieder schließt.[12][13] Die Mischung mit Wasser erfolgt unter Volumenkontraktion.[14] Mit Alkoholen, Ketonen und Ethern ist THF unbegrenzt mischbar.
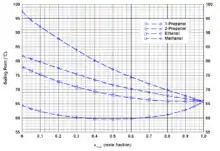
Bei einem Wassergehalt von 19,9 Mol% wird bei Atmosphärendruck ein azeotroper Siedepunkt von 63,8 °C beobachtet.[15] Bei Alkoholen werden nur mit Methanol und Ethanol bei Atmosphärendruck azeotrope Phasendiagramme beobachtet.[16] Die Phasendiagramme mit höheren Alkoholen wie 1-Propanol und 2-Propanol sind zeotrop.[16] Die azeotropen Siedepunkte bei Normaldruck liegen für Methanol bei 60,7 °C bei einem THF-Anteil von 49,7 Mol% bzw. für Ethanol bei 65,7 °C bei einem THF-Anteil von 85 Mol%.[16] Diese Azeotrope sind deutlich druckabhängig und verschwinden für Ethanol bei niedrigeren Drücken.[17] Weitere Azeotrope werden mit den Lösungsmitteln n-Hexan bei 63 °C mit einem THF-Anteil von 50 Ma%, mit Cyclohexan bei 60 °C mit einem THF-Anteil von 97 Ma% und mit Aceton bei 64 °C mit einem THF-Anteil von 8 Ma% gebildet.[18]
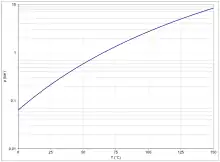
Die Dampfdruckkurve (Abb. 4) lässt sich im Temperaturbereich von 296 K bis 373 K mit der Antoine-Gleichung als log10(p) = A−(B/(T+C)) (p in bar, T in K) mit A = 4,12118, B = 1202,942 und C = −46,818 beschreiben.[19]
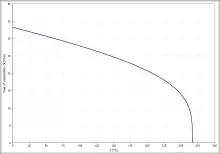
Die Temperaturabhängigkeit der Verdampfungsenthalpie (Abb. 5) ergibt sich entsprechend der Gleichung ΔVH0=A·exp(−β·Tr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 46,11 kJ/mol, β = 0,2699 und Tc = 540,2 K im Temperaturbereich zwischen 302 K und 339 K.[20]
Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Formelzeichen | Wert (Bemerkung) |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0(g) | −184,2 kJ·mol−1[21] |
| Standardentropie | S0(l) S0(g) |
203,9 J·mol−1·K−1 (Flüssigkeit)[22] 301,7 J·mol−1·K−1 (Gas)[23] |
| Verbrennungsenthalpie | ΔcH0(l) | −2505,8 kJ·mol−1[24] |
| Wärmekapazität | cp | 124,1 J·mol−1·K−1 (als Flüssigkeit bei 25 °C)[25] 1,72 J·g−1·K−1 (als Flüssigkeit bei 25 °C)[25] |
| Schmelzenthalpie | ΔfH0 | 8,540 kJ·mol−1 (am Schmelzpunkt)[22] |
| Schmelzentropie | ΔfS0 | 51,8 kJ·mol−1 (am Schmelzpunkt)[22] |
| Verdampfungsenthalpie | ΔvH0 | 29,8 kJ·mol−1 (am Normaldrucksiedepunkt)[20] |
| Tripelpunkt | Ttriple ptriple |
164,76 K[22] 101,33 kPa[22] |
| Kritische Temperatur | Tc | 268 °C[26] |
| Kritischer Druck | pc | 51,9 bar[26] |
| Kritisches Volumen | Vc | 0,225 l·mol−1[26] |
| Azentrischer Faktor | ωc | 0,22535[27] |
Tetrahydrofuran bildet mit Wasser ein festes Hydrat mit der Zusammensetzung THF·16,9H2O, welches bei 5 °C schmilzt.[28]
Sicherheitstechnische Kenngrößen
Tetrahydrofuran bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −20 °C. Der Explosionsbereich liegt zwischen 1,5 Vol.‑% (46 g/m3) als untere Explosionsgrenze (UEG) und 12,4 Vol.‑% (370 g/m3) als obere Explosionsgrenze (OEG).[1] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −23 °C sowie einen oberen Explosionspunkt von 13 °C. Die Grenzspaltweite wurde mit 0,83 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[1] Mit einer Mindestzündenergie von 0,54 mJ sind die Tetrahydrofurandampf-Luft-Gemische extrem zündfähig.[29][30] Die Zündtemperatur beträgt 230 °C.[31] Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 4,6·10−8 S·m−1 eher gering.[32]
Entsprechend den Gefahrgutvorschriften ist Tetrahydrofuran der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).[1]
Chemische Eigenschaften
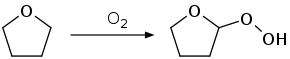
Wie viele Ether bildet auch THF beim längeren Stehen an der Luft und unter Lichteinwirkung durch Autoxidation ein Peroxid. Dieses kann beim Abdestillieren von THF als hochexplosiver Rückstand zurückbleiben. Es empfiehlt sich daher vor jeder Destillation von THF einen Peroxidtest durchzuführen. Mit Peroxid versetztes THF sollte aus Sicherheitsgründen entsorgt werden.
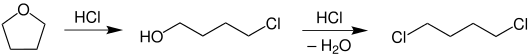
Beim Erhitzen in Anwesenheit von Salzsäure wird der Ether leicht unter Bildung von 4-Chlorbutanol und später 1,4-Dichlorbutan gespalten.[33]
Verwendung
Tetrahydrofuran wird als Lösungsmittel für PVC, Polystyrol, Polyurethane, Cellulosenitrat, Klebstoffe und Lacke verwendet; es ist ein Zwischenprodukt bei der Polyamid-, Polyester- und Polyurethan-Herstellung, und es dient zur Gewinnung von Tetrahydrothiophen und Pyrrolidin. Es ist ein wichtiges Vorprodukt für Polytetrahydrofuran. In zahlreichen organischen Reaktionen wird es aufgrund seiner Donorwirkung als Lösungsmittel eingesetzt.
Neben Diethylether ist Tetrahydrofuran eines der wichtigsten Lösungsmittel für Reaktionen mit basischen und neutralen Reaktanten, da es gute Lösungseigenschaften besitzt und weitgehend inert ist. Bei Reaktionen mit stark (lewis-)sauren Reaktanten muss man mit Etherspaltung rechnen. Bei schwächer (lewis-)sauren Reaktanten geht Tetrahydrofuran oft Säure-Base-Addukte ein.
Ein verwandter cyclischer Ether ist 1,4-Dioxan.
Risikobewertung
Tetrahydrofuran wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Tetrahydrofuran waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung. Die Neubewertung fand ab 2013 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[34][35]
Die Internationale Agentur für Krebsforschung (IARC) stufte Tetrahydrofuran im Jahr 2017 als möglicherweise krebserzeugend ein.[36]
Weblinks
- Sicherheitsdatenblatt Tetrahydrofuran beim Gefahrstoffinformationssystem der BG RCI und der BGHM
Einzelnachweise
- Eintrag zu Tetrahydrofuran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2020. (JavaScript erforderlich)
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1585.
- Eintrag zu Tetrahydrofuran. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Tetrahydrofuran im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 109-99-9 bzw. Tetrahydrofuran), abgerufen am 2. November 2015.
- H. Müller.: Tetrahydrofuran. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2005. doi:10.1002/14356007.a26_221
- T. Onoda: US 3 922 300, 1975 (Mitsubishi Chem.).
- Yoshinao Nakagawa, Keiichi Tomishige: Total hydrogenation of furan derivatives over silica-supported Ni–Pd alloy catalyst. In: Catalytic Comm. 12, 2010, S. 154–156. doi:10.1016/j.catcom.2010.09.003.
- D. Starr, R. M. Hixon: Tetrahydrofuran In: Organic Syntheses. 16, 1936, S. 77, doi:10.15227/orgsyn.016.0077; Coll. Vol. 2, 1943, S. 566 (PDF).
- Bourguignon: In: Chem. Zentralblatt. 1908, I, 1630.
- S. Marz, S. P. Müller, B. Kraushaar-Czarnetzki: Prozessintensivierung bei der Gasphasenumsetzung von Dimethylmaleat zu Tetrahydrofuran. In: Chem. Ing. Techn. 85, 2013, S. 535–539. doi:10.1002/cite.201200230.
- J. Matous, J. Hrancirik, J. P. Novak, J. Sobr: Liquid-liquid equilibrium in the system water-tetrahydrofuran. In: Collect. Czech. Chem. Commun. 35, 1970, S. 1904–1905. doi:10.1135/cccc19701904.
- J. Matous, J. P. Novak, J. Sobr, J. Pick: Liquid-liquid equilibrium in the system water-tetrahydrofuran (2). In: Collect. Czech. Chem. Commun. 37, 1972, S. 2653–2663. doi:10.1135/cccc19722653.
- Dortmunder Datenbank.
- W. Hayduk, H. Laudie, O. H. Smith: Viscosity, freezing point, vapor-liquid equilibriums, and other properties of aqueous-tetrahydrofuran solutions. In: J. Chem. Eng. Data. 18 (4), 1973, S. 373–376. doi:10.1021/je60059a027.
- Yoshio Yoshikawa, Akira Takagi, Masahiro Kato: Indirect Determination of Vapor-Liquid Equilibria by a Small Ebulliometer. Tetrahydrofuran-Alcohol Binary Systems. In: J. Chem. Eng. Data. 25 (4), 1980, S. 344–346. doi:10.1021/je60087a017.
- E. Brunner, A. G. R. Scholz: Isobaric vapor-liquid equilibria of the tetrahydrofuran/ethanol system at 25, 50, and 100 kPa. In: J. Chem. Eng. Data 29 (1), 1984, S. 28–31. doi:10.1021/je00035a011.
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 217.
- D. W. Scott: Tetrahydrofuran: vibrational assignment, chemical thermodynamic properties, and vapor pressure. In: J. Chem. Thermodyn. 2 (6), 1970, S. 833–837. doi:10.1016/0021-9614(70)90026-1.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- A. S. Pell, G. Pilcher: Measurements of heats of combustion by flame calorimetry. Part 3.-Ethylene oxide, trimethylene oxide, tetrahydrofuran and tetrahydropy. In: Trans. Faraday Soc. 61, 1965, S. 71–77. doi:10.1039/TF9656100071.
- B. V. Lebedev, I. B. Rabinovich, V. I. Milov, V. Ya. Lityagov: Thermodynamic properties of tetrahydrofuran from 8 to 322 K. In: J. Chem. Thermodyn. 10 (4), 1978, S. 321–329. doi:10.1016/0021-9614(78)90064-2.
- G. A. Clegg: Thermodynamics of polymerization of heterocyclic compounds. II. The heat capacity, entropy, enthalpy and free energy of polytetrahydrofuran. In: Polymer. 9, 1968, S. 501–511. doi:10.1016/0032-3861(68)90060-8.
- R. C. Cass, S. E. Fletcher, C. T. Mortimer, H. D. Springall, T. R. White: Heats of combustion and molecular structure. Part V. The mean bond energy term for the C-O bond in ethers, and the structures of some cyclic ethers. In: J. Chem. Soc. 1958, S. 1406–1410. doi:10.1039/JR9580001406.
- M. Costas, D. Patterson: Heat capacities of water + organic-solvent mixtures. In: J. Chem. Soc., Faraday Trans. 1. 81, 1965, S. 2381–2398. doi:10.1039/F19858102381.
- K. A. Kobe, A. E. Ravicz, S. P. Vohra: Critical Properties and Vapor Pressures of Some Ethers and Heterocyclic Compounds. In: J. Chem. Eng. Data. 1 (1), 1956, S. 50–56. doi:10.1021/i460001a010.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, S. 796–812. doi:10.1002/cite.201000202.
- D. G. Leaist, J. J. Murray, M. L. Post, D. W. Davidson: Enthalpies of Decomposition and Heat Capacities of Ethylene Oxid and Tetrahydrofuran Hydrates. In: J. Phys. Chem. 86, 1982, S. 4175–4178, doi:10.1021/j100218a017.
- J. B. Fenn: Lean flammability limit and minimum spark ignition energy. In: Ind. Eng. Chem. 43, 1951, S. 2865–2869.
- H. F. Calcote, C. A. Gregory, C. M. Barnett, R. B. Gilmer: Spark Ignition - Effect of Molecular Structure. In: Ind. Eng. Chem. 44, 1952, S. 2656–2662.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 3-527-31148-3.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Tetrahydrofuran, abgerufen am 26. März 2019.
- Yann Grosse, Dana Loomis, Kathryn Z Guyton, Fatiha El Ghissassi, Véronique Bouvard, Lamia Benbrahim-Tallaa, Heidi Mattock, Kurt Straif: Some chemicals that cause tumours of the urinary tract in rodents. In: The Lancet Oncology. 18, 2017, S. 1003–1004. doi:10.1016/S1470-2045(17)30505-3.


