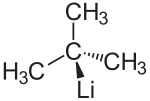
tert-Butyllithium
tert-Butyllithium (t-BuLi) ist eine tertiäre metallorganische Verbindung des Elements Lithium (Organolithium-Verbindung). Daneben gibt es noch die isomeren Formen n-Butyllithium und sec-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. t-BuLi ist somit die stärkste Base in dieser Reihe. t-BuLi zerfällt bei Raumtemperatur in Lithiumhydrid und Isobuten. Das entstandene Isobuten wird durch weiteres t-BuLi in der Allylstellung deprotoniert, was zu einer weiteren Konzentrationserniedrigung des t-BuLi führt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | tert-Butyllithium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9Li | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, pyrophorer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 64,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
140 °C (Zersetzung)[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Im Handel ist es ausschließlich als Lösung in Alkanen (zumeist in Pentan oder Heptan) erhältlich, wobei eine Konzentration von 1,7 mol/l üblich ist. Ether wie THF oder Diethylether sind als Lösemittel zur Lagerung ungeeignet, da sie rasch zersetzt werden. t-BuLi ist auch in Lösung äußerst pyrophor und verbrennt an der Luft mit einer typisch roten Flamme.
Reaktionen
Die Lithium-Kohlenstoff-Bindung im tert-Butyllithiummolekül ist stark polarisiert. Das Kohlenstoffatom trägt dabei eine negative und das Lithiumatom eine positive Partialladung. tert-Butyllithium verhält sich daher chemisch ähnlich wie ein entsprechendes Carbanion. Durch Formulierung einer mesomeren Grenzstruktur lässt sich dieses Verhalten veranschaulichen:[4]
Ähnlich wie n-Butyllithium kann auch t-BuLi für den Lithium-Halogenaustausch und zum Deprotonieren von Aminen und aktivierten C-H-Verbindungen verwendet werden. t-BuLi kann zudem die Alpha-Position der Ether angreifen.
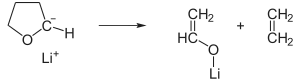
Dies zeigt das Beispiel Tetrahydrofuran, welches bereits bei Raumtemperatur innerhalb von Minuten zersetzt wird:
Diese Methode wird zum Beispiel benutzt, wenn deprotonierter Acetaldehyd benötigt wird.
Verwendung
t-BuLi hat in der modernen synthetischen organischen Chemie Bedeutung als ultrastarke Base bzw. als Lithiierungsreagenz erlangt. Da es wesentlich pyrophorer als n-BuLi ist, wird es weniger oft eingesetzt. In einigen Fällen wird es wegen der höheren Basizität oder aus sterischen Gründen (der t-Butylrest ist räumlich relativ groß) verwendet.
Sicherheitshinweise
t-BuLi ist auch in Lösung äußerst pyrophor. Die Handhabung und Lagerung muss daher stets unter Schutzgas stattfinden. t-BuLi reagiert zudem heftig mit Wasser zu Lithiumhydroxid und Isobutan. Bei längerer Lagerung bildet sich ein Bodensatz aus ebenfalls pyrophorem Lithiumhydrid (aus der Selbstzersetzung) und Lithiumhydroxid (eingedrungene Feuchtigkeit).
Quellen
- Eintrag zu Butyllithium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. Mai 2014.
- Ulrich Wietelmann, Richard Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15_393.
- Datenblatt tert-Butyllithium, nominally 1.5M in n-pentane, packaged under Argon in resealable ChemSeal bottles bei AlfaAesar, abgerufen am 27. September 2018 (PDF) (JavaScript erforderlich).
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 3. Auflage. Wiley-VCH, 2005, ISBN 978-3-527-29819-8.