Grignard-Reaktion
Bei der Grignard-Reaktion [ɡriˈɲaːr-] handelt es sich um eine Namensreaktion in der Organischen Chemie, welche nach ihrem Entdecker, dem französischen Chemiker Victor Grignard benannt wurde, der für diese Entdeckung 1912 mit dem Nobelpreis ausgezeichnet wurde.[1] Die Grignard-Reaktion ist eine metallorganische chemische Reaktion, bei der Alkyl- oder Aryl-Magnesiumhalogenide (siehe Grignard-Verbindung) als Nucleophil mit elektrophilen Gruppen wie z. B. Carbonylgruppen reagieren. Sie dient zum Aufbau von Kohlenstoff-Kohlenstoff-Einfachbindungen.[2]
Die Grignard-Reaktion ist eine sehr wichtige Reaktion zum Knüpfen von Kohlenstoff-Kohlenstoff-, Kohlenstoff-Phosphor-, Kohlenstoff-Zinn-, Kohlenstoff-Silicium- oder Kohlenstoff-Bor-Bindungen.[3][4] Die Magnesium-organische Grignard-Verbindung ist keine ionische Verbindung. Stattdessen liegen je nach Lösungsmittel unterschiedliche Strukturen vor, welche sich in einem Gleichgewicht zueinander befinden, siehe Schlenk-Gleichgewicht.[5]
Da Grignard-Verbindungen empfindlich gegen protische Lösungsmittel sind, muss die Grignard-Reaktion wasserfrei, üblicherweise in getrockneten Ethern wie Diethylether oder Tetrahydrofuran durchgeführt werden. Die kurz zuvor veröffentlichte Barbier-Reaktion dagegen toleriert wässrige Lösungsmittel und läuft als Eintopfreaktion ab.
Übersichtsreaktion
Bei der Grignard-Reaktion reagiert eine Grignard-Verbindung (metallorganische Verbindung, hier mit Brom als Beispiel für ein Halogen) als Nukleophil mit einer elektrophilen Verbindung – hier z. B. der Carbonylgruppe in einem Aldehyd oder Keton – zu einem Alkohol:

Mechanismus
Mechanistisch gesehen handelt es sich bei der Grignard-Reaktion um eine nukleophile Addition, in der das negativ polarisierte Kohlenstoffatom (Carbanion) der Grignard-Verbindung an das Kohlenstoff-Atom einer Carbonylgruppe addiert wird. Somit wird eine neue Kohlenstoff-Kohlenstoff-Bindung ausgebildet. Es wird angenommen, dass am Übergangszustand der Reaktion zwei Moleküle der Grignard-Verbindung beteiligt sind, wodurch sich ein sechsgliedriger Übergangszustand ergibt.[6] Das Sauerstoff-Atom der Carbonylverbindung übernimmt das Metall unter Bildung eines Metallalkoxids. Im nächsten Schritt wird dieses Sauerstoff-Atom durch verdünnte wässrige Säure protoniert.[7]
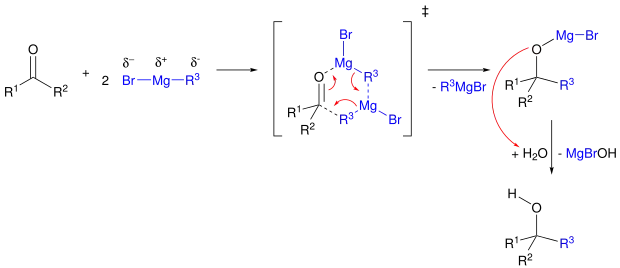
Umsetzungen
Im Folgenden wird häufig die allgemeine Formel RMgX für die Grignard-Verbindung verwendet, wobei das X für eines der Halogene Brom, Chlor oder Iod steht. Die Grignard-Reaktion liefert abhängig von der eingesetzten Carbonylverbindung primäre, sekundäre oder tertiäre Alkohole.
Ester ergeben unter Addition von zwei äquivalenten Grignard-Verbindungen tertiäre Alkohole, wobei durch einmalige Addition zunächst als Intermediat ein Keton entsteht. Dieses kann jedoch nicht isoliert werden, da es schneller mit der Grignard-Verbindung reagiert als der eingesetzte Ester.
Neben Aldehyden, Ketonen und Estern können auch Kohlendioxid, Nitrile, Imine, Epoxide, Thioester etc. mit Grignard-Verbindungen umgesetzt werden:
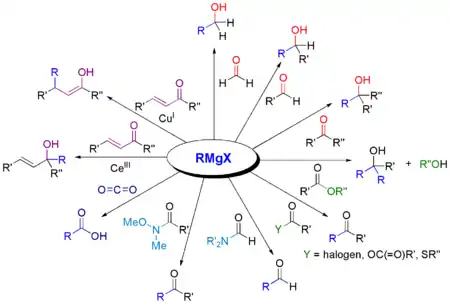
Die bedeutsamste Anwendung ist jedoch die Umsetzung einer Grignard-Verbindung mit Aldehyden, Ketonen oder Estern, um Alkohole herzustellen.
| Edukt | Produkt |
|---|---|
| Formaldehyd | primärer Alkohol |
| Aldehyd | sekundärer Alkohol |
| Keton | tertiärer Alkohol |
| Ameisensäureester | sekundärer Alkohol |
| Carbonsäureester | tertiärer Alkohol |
| Kohlenstoffdioxid | Carbonsäure |
| Nitril | Keton |
| Orthoameisensäureester (Bodroux-Tschitschibabin-Aldehydsynthese) | Aldehyd |
| N,N-dialkylierte Formamide (Bouveault-Aldehyd-Synthese) | Aldehyd |
| Kohlenstoffdisulfid | Dithiocarbonsäure |
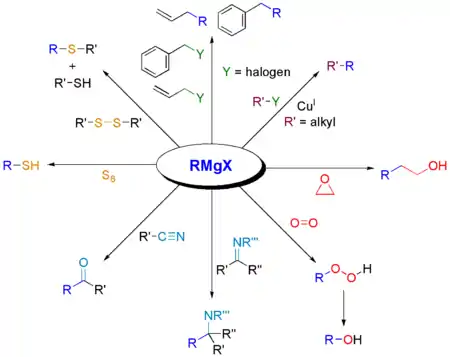
Eine Grignard-Reaktion kann mit einer ganzen Reihe weiterer Kohlenstoff-Elektrophilen durchgeführt werden.[8]
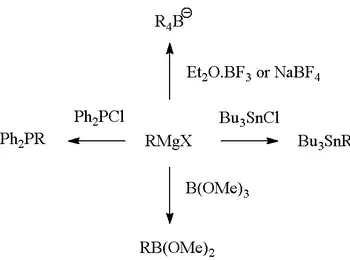
Die Grignard-Reaktion kann auch zur Herstellung von verschiedenen anderen Element-Kohlenstoffbindungen verwendet werden. Besonders hervorzuheben sind hier Bor-Verbindungen, die beispielsweise für die Suzuki-Kupplung benötigt werden.[9]
Früher hatte die Grignard-Reaktion eine große industrielle Bedeutung bei der Herstellung des Kraftstoffadditivs Tetraethylblei, welche aber aufgrund des Verbotes heute bedeutungslos ist.[10]
Aryl-Alkyl-Kupplungen
Mit Hilfe der Grignard-Reaktion lassen sich in Anwesenheit von Eisen(III)-acetylacetonat Aryl-Alkyl-Kupplungen durchführen.[11]
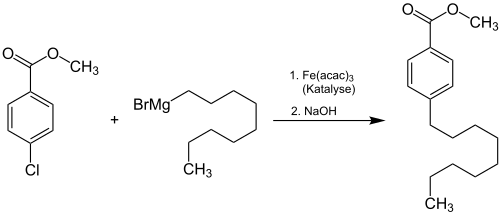
Ebenfalls sind Nickelchlorid (Kumada-Kupplung) oder Dilithiumtetrachlorocuprat (in situ hergestellt aus Lithiumchlorid und Kupfer(II)-chlorid in Tetrahydrofuran) gute Katalysatoren für derartige Kupplungsreaktionen.
Stereoselektive Grignard-Reaktion
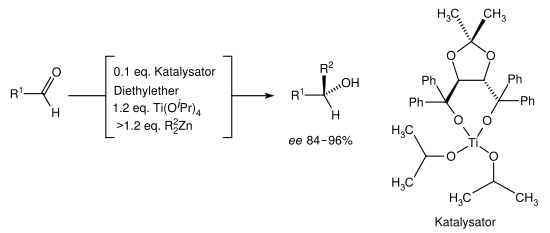
Da viele Ketone und alle Aldehyde (außer Formaldehyd) prochirale Verbindungen sind, entstehen bei einer Grignard-Reaktion sehr häufig Enantiomeren-Paare oder bei einem schon vorhandenen Stereozentrum Diastereomere. Um die Grignard-Reaktion stereoselektiv zu erweitern, hat Dieter Seebach das chirale Reagenz TADDOL, ein Weinsäure-Derivat, entwickelt. Unter Ausnutzung des Schlenk-Gleichgewichtes wurden bei der Umsetzung mit Aldehyden Enantiomerenüberschüsse von 84–96 % erreicht.[12]
Konkurrenzreaktionen
Bei sterisch aufwendigen Grignard-Verbindungen oder sterisch gehinderten Carbonylverbindungen können Nebenreaktionen ablaufen. Die wichtigsten sind die Reduktion der Carbonylkomponente, bezeichnet als Grignard-Reduktion,[13] und bei vorhandenem α-Wasserstoffatom, die Enolisierung der Carbonylverbindung.
Praktische Umsetzung
Im Labor werden die benötigten Grignard-Verbindungen meist in situ in einem Ether als Lösungsmittel hergestellt und unmittelbar mit der anderen Komponente umgesetzt. Anschließend wird die Reaktionsmischung in leicht oder stark saurer wässriger Lösung aufgearbeitet und das Reaktionsprodukt daraus isoliert.
Verwendung
Eine Anwendung der Grignard-Reaktion zur quantitativen Bestimmung CH-acider Verbindung ist die Zerewitinow-Reaktion.
Siehe auch
Weblinks
Einzelnachweise
- Nobelprize.org zur Preisverleihung an V. Grignard.
- V. Grignard: Sur quelques nouvelles combinaisons organométalliques du magnèsium et leur application à des synthèses d'alcools et d'hydrocarbures. In: CR Hebd. Séances Acad. Sci., Ser. C. Band 130, 1900, S. 1322–1324 (Digitalisat auf Gallica – frz.; dt. Über einige neue metallorganische Verbindungen von Magnesium und deren Anwendung auf Synthesen von Alkoholen und Kohlenwasserstoffen).
- D. A. Shirley: In: Organic Reactions. Vol. 8, 1954, S. 28–58.
- D. M. Huryn: In Comp. Org. Syn. 1, 1991, S. 49–75.
- C. Elschenbroich, A. Salzer: Organometallics – A Concise Introduction. 2nd Ed., Wiley-VCH, Weinheim 1995, ISBN 3-527-28164-9, S. 43–44.
- Kazuhiro Maruyama, Toshimasa Katagiri: Mechanism of the Grignard reaction. In: Journal of Physical Organic Chemistry. Band 2, Nr. 3, 1989, S. 205–213, doi:10.1002/poc.610020303.
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. Hrsg.: H. Buntenschön. 4. Auflage. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8, S. 351.
- Jerry March: Advanced Organic Chemistry. John Wiley & Sons, New York 1985, ISBN 0-471-88841-9.
- A. Suzuki, P. J. Stang (Ed.), F. Diedrich (Ed.): Metal-Catalyzed Cross-coupling Reactions. Wiley-VCH, Weinheim 1998.
- C. Elschenbroich, A. Salzer: Organometallics – A Concise Introduction. 2nd Ed., Wiley-VCH, Weinheim 1995, ISBN 3-527-28164-9, S. 139.
- A. Fürstner, A. Leitner, G. Seidel: 4-Nonylbenzoic Acid In: Organic Syntheses. 81, 2005, S. 33–42, doi:10.15227/orgsyn.081.0033 (PDF).
- Joanna Linda von dem Bussche-Hünnefeld, Dieter Seebach: Enantioselective preparation of sec. Alcohols from aldehydes and dialkyl zinc compounds, generated in situ from Grignard reagents, using substoichiometric amounts of TADDOL-titanates. In: Tetrahedron. Band 48, Nr. 27, 3. Juli 1992, S. 5719–5730, doi:10.1016/0040-4020(92)80023-9.
- Reinhard Brückner: Reaktionsmechanismen. 3. über. und aktual. Auflage, Spektrum Akademischer Verlag, München 2004,ISBN 3-8274-1579-9, S. 429f.