Lithiumperchlorat
Lithiumperchlorat ist das Lithiumsalz der Perchlorsäure und wie viele Perchlorate bei erhöhter Temperatur ein starkes Oxidationsmittel. Es ist ein farbloser, in Wasser, Alkoholen und einigen anderen Lösungsmitteln leicht löslicher Feststoff.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
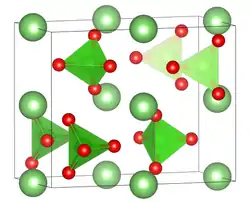 | |||||||||||||||||||
| _ Li+ _ Cl7+ _ O2− | |||||||||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) [1] | ||||||||||||||||||
| Gitterparameter |
a = 8,657 Å, b = 6,912 Å, c = 4,832 Å[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumperchlorat | ||||||||||||||||||
| Andere Namen |
Perchlorsaueres Lithium | ||||||||||||||||||
| Verhältnisformel | LiClO4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 106,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung bei 400 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Lithiumperchlorat kristallisiert als Trihydrat LiClO4 · 3 H2O im hexagonalen Kristallsystem in der Raumgruppe P63mc (Raumgruppen-Nr. 186). Die Gitterparameter betragen a = 7,719 Å und c = 5,455 Å.[8] Bei 98 - 100 °C geht es unter Wasserabspaltung in ein Monohydrat LiClO4 · H2O über. Das Anhydrat entsteht bei 130 - 150 °C,[7] es ist hygroskopisch[2] und kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Raumgruppe Pnma (Raumgruppen-Nr. 62) und den Gitterparametern a = 8,657 Å, b = 6,912 Å und c = 4,832 Å. In der Elementarzelle befinden sich vier Formeleinheiten.[1]
Lithiumperchlorat ist in Wasser und polaren organischen Lösungsmitteln gut bis sehr gut löslich.[9]
Löslichkeit in verschiedenen Lösungsmitteln bei 25 °C[9][10] Lösungsmittel Wasser Methanol Ethanol n-Propanol Aceton Ethylacetat Diethylether Löslichkeit in g/100 g Lösungsmittel 59,71 182,25 151,76 105,00 136,52 95,12 113,72
Bei 380 °C zersetzt sich reines Lithiumperchlorat zunächst in Lithiumchlorat, Lithiumchlorid und Sauerstoff.[7] Das gebildete Lithiumchlorat zersetzt sich in einer Folgereaktion in Lithiumchlorid und Sauerstoff:
Die Gesamtreaktion lautet demnach:
Verunreinigtes Lithiumperchlorat kann sich schon unterhalb von 300 °C in heftiger Reaktion zersetzen.
Handhabung
Hitze, offene Flammen, starke Reduktionsmittel und entzündliche Substanzen sollten aufgrund der Explosionsgefahr vermieden werden.
Einsatzbereiche
Lithiumperchlorat wird technisch nur begrenzt eingesetzt, da es teuer und schwer zu handhaben ist. Da es in vielen organischen Lösungsmitteln, einschließlich Ethanol und Ether, relativ gut löslich ist, wird es als Elektrolyt verwendet, wobei insbesondere die Anwendung in Lithiumbatterien bedeutend ist. Ein weiteres Beispiel für eine Verwendung als Elektrolyt in nichtwässrigen Lösungen ist die Herstellung von Polypyrrol, das dann auch mit Lithiumperchlorat dotiert werden kann.
Da Lithiumperchlorat unter allen bisher bekannten Perchloraten das günstigste Masse-Volumen-Verhältnis an Sauerstoff aufweist, wird es in der Luft- und Raumfahrt als Sauerstoffträger geschätzt.
Einzelnachweise
- M. S. Wickleder: Crystal Structure of LiClO4 in Zeitschrift für anorganische und allgemeine Chemie, 2003, 629(9), S. 1466–1468. doi:10.1002/zaac.200300114.
- Datenblatt Lithium perchlorate, anhydrous bei AlfaAesar, abgerufen am 15. Dezember 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Lithium perchlorate trihydrate (PDF) bei Strem, abgerufen am 14. Mai 2017.
- Eintrag zu Lithiumperchlorat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 14. (PDF)
- Datenblatt Lithium perchlorate bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 137. Volltext
- A. Sequeira, I. Bernal, I.D. Brown, R. Faggiani: "The Structure of Lithium Perhclorate Trihydrate Li(H2O)3ClO4 - an X-ray and Neutron Diffraction Study" in Acta Cryst. 1975, B31, S. 1735. doi:10.1107/S0567740875006000.
- Long, J.R.: Perchlorate safety: Reconciling inorganic and organic guidelines in Chem. Health Safety 9 (2002) 12–18, doi:10.1016/S1074-9098(02)00294-0.
- Willard, H.H.; Smith, G.F.: The Perchlorates of the Alkali and Alkaline Earth Metals and Ammonium. Their Solubility in Water and Other Solvents in J. Am. Chem. Soc. 45 (1923) 286–297, doi:10.1021/ja01655a004.

