Dopamin
Dopamin (DA, Kunstwort aus DOPA und Amin) ist ein biogenes Amin aus der Gruppe der Katecholamine und ein wichtiger, überwiegend erregend wirkender Neurotransmitter des zentralen Nervensystems. Dopamin wird auch Prolaktostatin oder PIH (Prolactin-Inhibiting Hormone) genannt. Dopamin ist ein Hormon, das in (postganglionären sympathischen) Nervenendigungen und im Nebennierenmark als Vorstufe von Noradrenalin gebildet wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
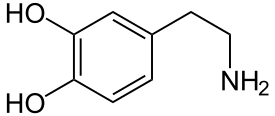 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dopamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H11NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Prismen, mit charakteristischem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C01CA04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 153,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,93[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Volksmund gilt es als Glückshormon. Die tatsächliche psychotrope Bedeutung des Dopamins wird allerdings hauptsächlich im Bereich der Antriebssteigerung und Motivation vermutet.[4]
Dopamin wird auch als Arzneistoff verwendet, beispielsweise zur Behandlung des Herz-Kreislauf-Schocks.
Physiologie
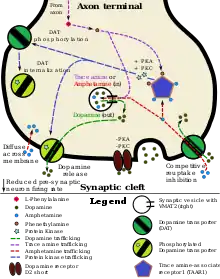
Nervenzellen, in denen Dopamin vorkommt, werden dopaminerg genannt. Dopaminerge Neuronen befinden sich im Zentralnervensystem (ZNS) und hier vor allem im Mittelhirn. Vom Mittelhirn aus steigen wichtige dopaminerge Systeme ins Endhirn und ins Zwischenhirn auf. Die zugehörigen Neuronenpopulationen finden sich in der Substantia nigra, in der Area tegmentalis ventralis und in den retro-rubralen Regionen. Dopamin ist aber auch ein Neurotransmitter in einigen Systemen des vegetativen Nervensystems und reguliert hier die Durchblutung innerer Organe. Es wird für eine Vielzahl von lebensnotwendigen Steuerungs- und Regelungsvorgängen benötigt.
Unter anderem beeinflusst Dopamin die extrapyramidale Motorik (hier besteht möglicherweise ein Zusammenhang mit der Parkinsonschen Erkrankung). Ebenso steht der Dopaminhaushalt im Zusammenhang mit der Neurobiologie von Psychosen und anderer Störungen. Auch in die Regulation des Hormonhaushaltes greifen dopaminerge Systeme ein. So hemmt Dopamin aus Neuronen, die entlang des 3. Hirnventrikels lokalisiert sind, an der Hypophyse die Ausschüttung des Hormones Prolaktin. Weiter regelt es die Durchblutung der Bauchorgane, insbesondere ist Dopamin an der Steuerung der Nieren beteiligt.
Die Wirkung einer Dopaminausschüttung durch eine präsynaptische Endigung auf das postsynaptische Neuron hängt vom Dopamin-Rezeptortyp in der Postsynapse ab. Zurzeit unterscheidet man fünf Dopamin-Rezeptoren (D1–D5). Bindet Dopamin an D1 oder D5, wird die nachgeschaltete Zelle depolarisiert (exzitatorisches postsynaptisches Potential). Eine Bindung an die Rezeptoren D2–D4 bewirkt eine Hyperpolarisierung der Postsynapse (inhibitorisches postsynaptisches Potential). Die letzteren Rezeptortypen werden zusammengefasst auch als D2-Gruppe bezeichnet. Es gibt zudem Hinweise darauf, dass Dopaminrezeptoren des Typs D1 und des Typs D2 sogenannte Heterodimere bilden können, was zu einer Aktivierung des Phospholipase-Signalwegs und schließlich einem Anstieg der intrazellulären Ca-Konzentration führt.[5] Die physiologische Bedeutung davon ist jedoch noch unklar.
Im ZNS gibt es im Wesentlichen vier dopaminerge Verarbeitungspfade:
- Das Mesostriatale System (auch Nigro-Striatale System) nimmt seinen Ursprung in der Substantia nigra im Mittelhirn und projiziert v. a. zu den Basalganglien, die eine wichtige Rolle bei der Bewegungssteuerung spielen. Diesem Pfad wird eine wesentliche Rolle bei den hypokinetischen Symptomen bei Morbus Parkinson sowie den häufig auftretenden extrapyramidalen Störungen als Nebenwirkung von Neuroleptika zugeschrieben.
- Das mesolimbische System entspringt ebenfalls in der Area tegmentalis ventralis und projiziert v. a. zum limbischen System (Hippocampus, Amygdala, Corpus mamillare, Fornix usw.). Dieser Pfad trägt sehr wahrscheinlich wesentlich zu den sogenannten „positiven“ Symptomen bei schizophrenen Störungen bei. Es gilt als das „Belohnungssystem“, bei dessen Funktionsreduktion Patienten lust- und antriebslos werden (Anhedonie, oft bei Parkinsonpatienten). An diesem System setzt z. B. die intrakranielle Selbststimulation an, bei der Mäuse sich bis zur völligen Erschöpfung über implantierte Elektroden selbst stimulieren. Auch bestimmte Drogen, wie Kokain und Amphetamine, wirken auf dieses System.
- Das Mesocorticale System verläuft von der Area tegmentalis ventralis zum Frontallappen. Nach derzeitigem Verständnis hat das Funktionieren dieser Bahn eine Bedeutung für die sogenannten exekutiven Funktionen, sowie die Motivation. Im Zusammenhang mit Psychosen des schizophrenen Formenkreises wird hier eine Unteraktivität gesehen, die man mit den mit diesen Erkrankungen oft einhergehenden kognitiven Störungen in Verbindung bringt.
- Das tuberoinfundibuläre System, dessen Neuronen vom Nucleus arcuatus zum Hypophysenvorderlappen ziehen und dort die Freisetzung von Prolactin hemmen.
Dopamin wird eine wichtige Rolle bei Suchterkrankungen zugeschrieben. So kommt es beim Gebrauch von verschiedenen Rauschdrogen zur Wirkungsverstärkung von Dopamin, Serotonin und Gamma-Aminobuttersäure. Hierbei ist die Störung im Dopaminspiegel für einen Teil der Entzugssymptome verantwortlich.
Bei ADHS besteht möglicherweise ein Dopaminmangel (vorwiegend) im Striatum. Die typischen ADHS-Medikamente (Stimulanzien wie Methylphenidat oder Amphetamine) bewirken auf verschiedene Weisen (Methylphenidat als Dopaminwiederaufnahmehemmer, Amphetamin als Dopaminfreisetzungsverstärker) eine Erhöhung des Dopaminspiegels im synaptischen Spalt – bei richtiger Dosierung auf das Maß, das wie bei Nichtbetroffenen eine störungsfreie Signalübertragung gewährleistet. Bei Überdosierung (zu hoher Dopaminspiegel) entstehen Signalübertragungsprobleme, die nahezu dieselben Symptome verursachen wie ein zu geringer Dopaminspiegel.
Biosynthese
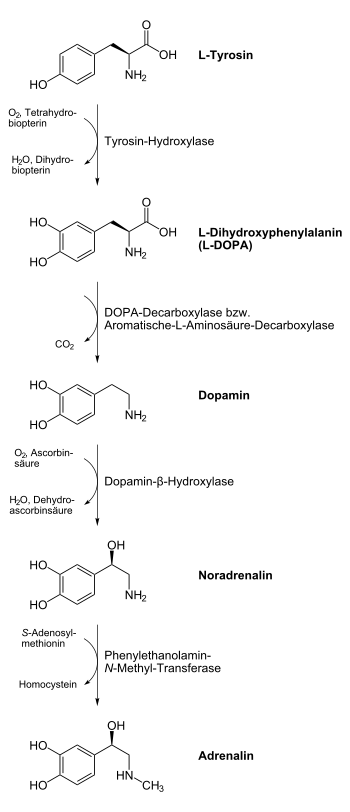
Dopamin ist ein Zwischenprodukt in der von der Aminosäure Tyrosin ausgehenden Biosynthese von Adrenalin. Tyrosin wird durch Tyrosinhydroxylase in Levodopa umgewandelt und dieses wiederum durch Aromatische-L-Aminosäure-Decarboxylase in Dopamin.
Medizinische Verwendung
Dopamin senkt den peripheren Widerstand durch Gefäßerweiterung und vergrößert so das Herzzeitvolumen[6] und damit auch die glomeruläre Filtrationsrate. Die therapeutische Anwendung von Dopamin als Katecholamin bei Schockzuständen, bei sehr niedrigem Blutdruck oder beim Nierenversagen tritt jedoch zunehmend in den Hintergrund, da es neben offensichtlichen unerwünschten Wirkungen wie Herzrhythmusstörungen auch zur Immunsuppression und zu endokrinologischen Störungen kommt, die gerade bei der Behandlung schwerstkranker Patienten in der Intensivmedizin problematisch sind. So wurde 2001[7] von einer Anwendung von Dopamin zur Verhinderung oder zur Behandlung des akuten Nierenversagens in niedriger Dosierung („Nierendosis“) als wissenschaftlich unbegründet abgeraten.
Zur Behandlung von Parkinson, bei der es wegen des Unterganges der Zellen in der Substantia nigra zu einem Mangel an Dopamin in den Basalganglien kommt, und des Restless-Legs-Syndroms wird Levodopa (L-DOPA), ein Prodrug des Dopamins, gegeben. Dopamin selbst würde nicht ins Zentralnervensystem gelangen, da es die Blut-Hirn-Schranke nicht passieren kann. Aus L-DOPA wird in den Basalganglien über Decarboxylierung Dopamin gebildet (siehe Abbildung). Dies würde auch schon vor dem Einfluten ins ZNS geschehen, weshalb es notwendig ist, L-DOPA mit einer Substanz zu kombinieren, die das für die Decarboxylierung verantwortliche (Aromatische-L-Aminosäure-Decarboxylase) Enzym hemmt. Zumeist erfolgt eine galenische Aufarbeitung des L-DOPAs zu einem Kombinationspräparat mit einem Decarboxylasehemmer wie Carbidopa oder Benserazid. Da weder Carbidopa noch Benserazid im Gegensatz zu L-DOPA die Blut-Hirn-Schranke überwinden können, wird die Umwandlung zu Dopamin im ZNS nicht blockiert.
Dopaminhypothese der Schizophrenie
Gemäß der Dopaminhypothese wird seit den 1960er Jahren ein übermäßig hoher Dopamin-Spiegel in bestimmten Hirnarealen mit den Symptomen der Schizophrenie (Psychosen) in Verbindung gebracht.[8] Der Gebrauch stark dopaminerger Substanzen (Pramipexol, Amphetamin) kann auch bei Gesunden entsprechende Symptome auslösen. Als Wirkprinzip von Medikamenten gegen Schizophrenie (Neuroleptika) wird eine Blockade der Dopamin-Rezeptoren postuliert.
Darreichungsformen, Fertigarzneimittel
Arzneilich verwendet wird das wasserlösliche Dopaminhydrochlorid. Es wird ausschließlich intravenös mit einer indikationsabhängigen Dosierung von 2–30 µg/kg/min[9] angewendet.
Als Fertigarzneimittel ist Dopamin als Infusionslösungskonzentrat meist unter seinem generischen Namen im Handel, in Österreich gibt es ferner ein Präparat namens Giludop oder Revivan in Italien.
Ausgangssubstanz der Alkaloidsynthese in Pflanzen
Dopamin ist unter anderem Baustein bei der Biosynthese von Isochinolinalkaloiden[10] z. B. des Berberins. Auch in tierischem Gewebe findet die Biosynthese von Morphin aus Dopamin über dieselben Zwischenstufen (Laudanosin, Reticulin und Thebain) wie in Pflanzen statt. Dies konnte anhand verschiedener Zellkulturen nachgewiesen werden.[11]
Literatur
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 47 f.
Weblinks
- Ilka Lehnen-Beyel: Verwirrung unter Gehirnbotenstoffen. In: wissenschaft.de, 8. April 2005: „Bei der Verwendung von Antidepressiva gerät das Gleichgewicht zwischen Serotonin und Dopamin durcheinander.“
- Dopamine Modulation. In: Scholarpedia. (englisch, inkl. Literaturangaben)
Einzelnachweise
- Eintrag zu Dopamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- Eintrag zu Dopamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Dopamine hydrochloride bei Sigma-Aldrich, abgerufen am 4. Dezember 2021 (PDF).
- UConn Researcher: Dopamine Not About Pleasure (Anymore), UConn Today.
- S. P. Lee, C. H. So u. a.: Dopamine D1 and D2 Receptor Co-activation Generates a Novel Phospholipase C-mediated Calcium Signal. In: Journal of Biological Chemistry. 279, 2004, S. 35671, doi:10.1074/jbc.M401923200.
- Praxisbuch Dopaminstörungen, Diagnose und Therapie. Sandoz AG, Nürnberg ohne Jahr, S. 9.
- J. A. Kellum, M. Decker J.: Use of dopamine in acute renal failure: a meta-analysis. In: Critical Care Medicine. Band 29, 2001, S. 1526–1531.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4. S. 94
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 44–48 und 76.
- GW. Kirby: Biosynthesis of the morphine alkaloids. In: Science, 1967 Jan 13, 155(3759), S. 170–173, PMID 5332945
- Chotima Poeaknapo, Jürgen Schmidt, Matthias Brandsch, Birgit Dräger, Meinhart H. Zenk: Endogenous formation of morphine in human cells. In: PNAS (Proc Natl Acad Sci USA), 2004 Sep 28; 101(39), S. 14091–14096, PMC 521124 (freier Volltext).