Borax
Der oder das[9] Borax, veraltet und allgemein ungebräuchlich auch Tinkal,[1] ist ein selten vorkommendes Mineral aus der Mineralklasse der Borate mit der chemischen Zusammensetzung Na2[B4O5(OH)4]·8H2O[3]. Alternativ kann die chemische Zusammensetzung auch mit der Formel Na2B4O7·10H2O[4][5] ausgedrückt werden. Borax ist damit chemisch gesehen ein Dinatriumtetraborat-Decahydrat[10] (kurz Natriumborat, lateinisch auch Natrium boracicum).
| Borax | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| Andere Namen |
Tinkal[1] |
| Chemische Formel | |
| Mineralklasse (und ggf. Abteilung) |
Borate (früher: Carbonate, Nitrate und Borate) |
| System-Nr. nach Strunz und nach Dana |
6.DA.10 (8. Auflage: Vc/B.05) 26.04.01.01 |
| Ähnliche Minerale | Kernit, Colemanit, Sassolin, Soda, Trona |
| Kristallographische Daten | |
| Kristallsystem | monoklin |
| Kristallklasse; Symbol | monoklin-prismatisch; 2/m[6] |
| Raumgruppe | C2/c (Nr. 15)[3] |
| Gitterparameter | a = 11,89 Å; b = 10,65 Å; c = 12,21 Å β = 106,6°[3] |
| Formeleinheiten | Z = 4[3] |
| Physikalische Eigenschaften | |
| Mohshärte | 2 bis 2,5[7] |
| Dichte (g/cm3) | gemessen: 1,715(5); berechnet: 1,70[7] |
| Spaltbarkeit | vollkommen nach {100}, unvollkommen nach {110}[7] |
| Bruch; Tenazität | muschelig; spröde |
| Farbe | farblos, weiß, grau, hellblau bis hellgrün, gelblich bis bräunlich |
| Strichfarbe | weiß[7] |
| Transparenz | durchsichtig bis undurchsichtig |
| Glanz | Glasglanz, Harzglanz, erdig matt |
| Kristalloptik | |
| Brechungsindizes | nα = 1,447[8] nβ = 1,469[8] nγ = 1,472[8] |
| Doppelbrechung | δ = 0,025[8] |
| Optischer Charakter | zweiachsig negativ |
| Achsenwinkel | 2V = 39 bis 40° (gemessen); 32 bis 40° (berechnet)[8] |
| Pleochroismus | farblos[6] |
| Weitere Eigenschaften | |
| Chemisches Verhalten | in Wasser und Glycerin löslich |
Borax kristallisiert im monoklinen Kristallsystem und entwickelt meist kurze, prismatische oder tafelige Kristalle mit harz- bis glasähnlichem Glanz auf den Oberflächen. Er kommt aber auch in Form erdiger, körniger oder massiger Mineral-Aggregate vor. In reiner Form ist Borax farblos und durchsichtig. Durch vielfache Lichtbrechung aufgrund von Gitterbaufehlern oder polykristalliner Ausbildung kann er aber auch durchscheinend weiß sein und durch Fremdbeimengungen eine hellgraue, hellblaue oder hellgrüne Farbe annehmen. Mit einer Mohshärte von 2 bis 2,5 gehört Borax zu den weichen Mineralen, die sich ähnlich wie das Referenzmineral Gips (Härte 2) mit dem Fingernagel ritzen lassen.
Borax ist ein wichtiger Rohstoff zur Herstellung verschiedener Borverbindungen, die unter anderem in der Glas- und Keramikindustrie (Glasuren, Email) sowie als Flussmittel beim Löten verwendet werden.
Etymologie und Geschichte
Borax, früher auch Baurach genannt, bezeichnete im Mittelalter unterschiedliche Nitrate (Salpeter) sowie das Metalllötmittel chrysocolla (Malachit oder basisches Kupferkarbonat; vergleiche auch Chrysokoll) und wohl erst im 17. Jahrhundert den heutigen Borax (Natriumsalz der Borsäure). Borax wurde zuerst 1748 durch den schwedischen Mineralogen Johan Gottschalk Wallerius wissenschaftlich beschrieben.
Der Name leitet sich von dem persisch-arabischen Wort bauraq/būrak (zu persisch būrāh/būraq: Pottasche, Salpeter und andere Nitrate, Borax, eventuell auch borsaures Natron)[11] ab und bezieht sich möglicherweise auf die arabische Bedeutung „weiß“.[6]
Borax wurde schon in der Antike in China für Glasuren und in Ägypten zum Einbalsamieren benutzt.
In den Vereinigten Staaten entdeckte der Mineraloge John Allen Veatch das erste Vorkommen von Borax am 8. Januar 1856. Im September desselben Jahres gelangte er zum kalifornischen Borax Lake.[12]
Klassifikation
In der veralteten 8. Auflage der Mineralsystematik nach Strunz gehörte der Borax zur gemeinsamen Mineralklasse der „Carbonate, Nitrate und Borate“ und dort zur Abteilung der „Gruppenborate (Soroborate)“, wo er zusammen mit Tincalconit sowie im Anhang mit Halurgit und Hungchaoit die „Tincalconit-Borax-Gruppe“ mit der System-Nr. Vc/B.05 bildete.
Im zuletzt 2018 überarbeiteten und aktualisierten Lapis-Mineralienverzeichnis nach Stefan Weiß, das sich aus Rücksicht auf private Sammler und institutionelle Sammlungen noch nach dieser klassischen Systematik von Karl Hugo Strunz richtet, erhielt das Mineral die System- und Mineral-Nr. V/H.10-30. In der „Lapis-Systematik“ entspricht dies ebenfalls der Abteilung „Gruppenborate“ (planare und tetraedrische Gruppen [B3O5]1- bis [B6O10]2-), wo Borax zusammen mit Diomignit und Tincalconit eine eigenständige, aber unbenannte Gruppe bildet.[13]
Die seit 2001 gültige und von der International Mineralogical Association (IMA) bis 2009 aktualisierte[14] 9. Auflage der Strunz'schen Mineralsystematik ordnet den Borax in die hier eigenständige Klasse der „Borate“ und dort in die Abteilung der „Tetraborate“ ein. Diese ist zudem weiter unterteilt nach der Art der Kristallstruktur, so dass das Mineral entsprechend seinem Aufbau in der Unterabteilung „Insel-Tetraborate (Neso-Tetraborate)“ zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe 6.DA.10 bildet.
Die Systematik der Minerale nach Dana ordnet den Borax wie die veraltete Strunz'sche Systematik in die gemeinsame Klasse der „Carbonate, Nitrate und Borate“ und dort in die Abteilung der „Wasserhaltigen Borate mit Hydroxyl oder Halogen“ ein. Hier ist er als einziges Mitglied in der unbenannten Gruppe 26.04.01 innerhalb der Unterabteilung der „Wasserhaltigen Borate mit Hydroxyl oder Halogen“ zu finden.
Kristallstruktur
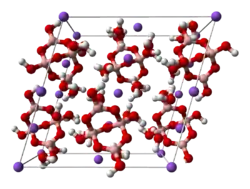
Borax kristallisiert monoklin in der Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterparametern a = 11,89 Å; b = 10,65 Å; c = 12,21 Å und β = 106,6° sowie 4 Formeleinheiten pro Elementarzelle.[3]

In den Anionen des Borax liegen Tetraborat-Ionen vor, bei denen jedes Boratom mit zwei oder drei (bei zwei Atomen) weiteren Boratomen über eine Sauerstoffbrücke miteinander verbunden ist. Zusätzlich ist jedes Boratom durch eine Hydroxygruppe nach außen abgesättigt, so dass sich eine Formel von [B4O5(OH)4]2− für das Anion ergibt.[15]
Eigenschaften
Tetrabordinatriumheptaoxid-Hydrat bildet in wässriger Lösung dieselben Verbindungen wie Dinatriumtetraborat-Decahydrat.[16][17]
Dehydratation
Beim Erhitzen verliert es bei etwa 100 °C einen Teil seines Kristallwassers und bildet ein Pentahydrat. Oberhalb von 400 °C erhält man wasserfreies Natriumtetraborat.[10]
Sicherheitshinweise
Borax (Natriumtetraborat-Decahydrat) hat die CAS-Nummer 1303-96-4.[18] Es ist als Gefahrstoff eingestuft, der die Fruchtbarkeit beeinträchtigt und als fruchtschädigend gilt. Weitere Sicherheitshinweise und Gefahrstoffkennzeichnung siehe Natriumtetraborat und Borate.
Die mittlere letale Dosis (LD50-Wert) wird für Borax mit 2 bis über 6 Gramm pro Kilogramm Körpergewicht angegeben.[19]
Bildung und Fundorte


Borax kommt in der Natur in kristalliner oder massiver Form ähnlich wie Anhydrit oder Gips als Evaporit vor, entsteht also bei der Austrocknung von Salzseen, die dann auch als Boraxseen bezeichnet werden. Daneben findet sich das Mineral auch als Bodenausblühung in ariden Gebieten oder als Sinterabsatz an Thermalquellen. Als Begleitminerale treten unter anderem Calcit, Gips, Halit, Soda und weitere Borate, Carbonate und Sulfate auf.[4][20]
Als seltene Mineralbildung konnte Borax nur an wenigen Orten weltweit nachgewiesen werden, wobei bisher rund 80 Fundorte dokumentiert sind (Stand: 2021).[21]
Früher wurde Borax von den Venetianern aus Ostindien (als Tinkal) importiert und (zu Borax veneta) raffiniert.[22] Bekannte Fundorte sind heute unter anderem die „Loma Blanca Borat-Lagerstätte“ (Coranzuli, Jujuy) und die „Tincalayu Mine“ (Salta) in Argentinien, der Salar de Surire in Chile, der Salar de Challviri in der bolivianischen Provinz Sur Lípez, der Chabyêr Caka Salzsee (Tibet) in China, die indische Region Ladakh, Larderello in der italienischen Provinz Pisa, Pachuca de Soto in Mexiko, die Sankaya Borat-Lagerstätte bei Kırka in der Türkei, die Halbinsel Kertsch in der Ukraine sowie Boron, der Borax Lake, der Searles Lake, das Death Valley und Calico in Kalifornien (USA).[23]
Verwendung
Als Rohstoff
Borax wird jährlich weltweit im Megatonnenbereich produziert und ist ein wichtiger Rohstoff zur Herstellung von Borsäure, zur Gewinnung von Boraten und Perboraten sowie weiterer Bor-Verbindungen.[19] Gewonnen wird Borax heute nahezu ausschließlich aus dem kristallwasserärmeren Boraxmineral Kernit.
In der Industrie und im Baubereich
Wasserfreier Borax wird als Zusatz für leichtschmelzende Glasuren (zumeist in Fritten) auf niedrig gebrannter Keramik (z. B. Raku, Steingut und andere Irdenwaren), zur Herstellung von Borosilikatglas und bei der Emailproduktion verwendet.
Seine Verwendung als Flussmittel beim Hartlöten von Metallen sowie beim Feuerschweißen beruht auf seiner oxidlösenden Wirkung.[24]
Borax ist gelegentlich Bestandteil von Düngemitteln und wird als Zuschlagstoff von Zement und Isolierstoffen eingesetzt.[19]
Des Weiteren wirkt Borax als vorbeugendes Holzschutzmittel gegen Schimmel und Insekten[24] und wird zu etwa 5 bis 20 Gewichtsprozent der Gesamtmenge als Flammschutzmittel, hier vorwiegend für Dämmstoffe auf Zellulosebasis, eingesetzt.[25][26] In letztgenannter Anwendung werden seine Eigenschaften als teilweise problematisch angesehen und eine Minderung als sinnvoll erachtet.[27] Eine im Auftrag des Umweltbundesamtes erstellte Studie bemerkt hierzu: "Zusammenfassend wird festgestellt, dass die Anwendung von Borax als Flammschutzmittel akzeptabel ist. Da jedoch die Hintergrundbelastung über die Nahrung bereits so hoch ist, dass die täglich duldbare Aufnahmemenge ausgeschöpft ist, muss gewährleistet sein, dass es durch die Anwendung des Borats als Flammschutzmittel nicht zu einer nennenswerten Zusatzbelastung des Menschen kommt."[28] Bis zu einer Menge von 8,5 Masse-% Borax-Äquivalent bzw. 5,5 Masse-% Borsäure-Äquivalent ist der Zusatz nicht deklarationspflichtig.[29]
In der Chemie
In der Schmelze von Borax lösen sich zahlreiche Metalloxide unter Bildung charakteristischer Färbungen und bilden nach dem Abkühlen eine glasartige Perle, die Boraxperle. Diese Färbungen werden als Nachweis für Kationen beim Kationentrennungsgang eingesetzt und stehen im Rang einer Vorprobe.
Die bei der Verbrennung von Methanol mit Borax auftretende grüne Flammenfärbung, die durch Borsäuretrimethylester hervorgerufen wird, ist ein einfacher Nachweis für Methanol.
Daneben wird Borax für Pufferlösungen (Borat- sowie Borat-Phosphat-Puffer) und in der Borax-Karmin-Lösung (Grenachers-Lösung) als Farbstoff in der Mikroskopie verwendet.
In Haushalt und Gewerbe
Im Haushalt und Wäschereien findet Borax Anwendung in Seife, in Wasserenthärtern und als Ausgangsmaterial zur Gewinnung von Perboraten in Waschmitteln.[30] Borax wird in Desinfektions-, Putz- und Bleichmitteln, Kosmetikprodukten sowie als Insektizid (bei Ameisenfallen) eingesetzt. Die Abgabe von Borax an private Endverbraucher ist allerdings in Deutschland seit dem 1. Juni 2009 durch die Chemikalien-Verbotsverordnung untersagt.[31] Produkte, die „Borax“ im Markennamen tragen, werden daher seither ohne Borax zubereitet.[32]
Als Lebensmittelzusatzstoff hat es die Bezeichnung E 285, ist aber in der EU ausschließlich für echten Kaviar zugelassen und in den USA ganz verboten.[33]
Borax ist neben Polyvinylalkohol, destilliertem Wasser und Lebensmittelfarbe eine Grundsubstanz zur Herstellung des populären Spielzeugs Slime (Schleim) gewesen.[34]
Heilkunde
In der Alternativmedizin wird Borax als Heilmittel gegen Arthritis, Osteoporose, Alzheimer-Demenz, Wechseljahresbeschwerden, zur Vorbeugung gegen Krebs und zur Verbesserung der geistigen Leistungsfähigkeit verkauft. Für diese Heilversprechen gibt es keine wissenschaftlichen Belege.[35][36][37] Von den Befürwortern wird behauptet, Bor sei ein Spurenelement, dessen Mangel zu obigen Beschwerden führen oder diese verschlimmern kann.[38]
In Nahrungsergänzungsmitteln sind EU-weit überhaupt nur zwei Bor-Verbindungen zugelassen: Borsäure und Natriumborat (= Natriumtetraborat).
Die folgenden Verbindungen sind in Europa nicht zugelassen und dürfen in Lebensmitteln nicht verwendet werden: Calcium-Fructo-Borat, Borcitrat, Bor-Aspartat, elementares Bor, Boron (als Boron Citrat, Boron Aspartat und Boron Glycinat Komplex). Es ist unklar, inwieweit die Studienergebnisse auf hier zugelassene Borverbindungen übertragbar sind. Aus dem Ausland importierte Nahrungsergänzungsmittel mit diesen Inhaltsstoffen können vom Zoll zurückgehalten werden.
Das Bundesinstitut für Risikobewertung (BfR) empfiehlt, pro Tag nicht mehr als 0,5 Milligramm Bor über Nahrungsergänzungsmittel aufzunehmen. Bei einigen marktüblichen Produkten liegt die vom Hersteller empfohlene tägliche Verzehrmenge bereits bei durchschnittlich 3 Milligramm.[39]
Siehe auch
Literatur
- Georgius Agricola: De Re Metallica. Borax. 1. Auflage. Dover Publications, New York 1950, S. 560 (rruff.info [PDF; 221 kB; abgerufen am 21. Oktober 2019] Latein: De Re Metallica. 1556. Übersetzt von Herbert Clark Hoover, Lou Henry Hoover).
- Johan Gottschalk Wallerius, Johann Daniel Denso: Mineralogie oder Mineralreich. Borax. Berlegts Christoph Gottlieb Nicolai, Berlin 1750, S. 246–250 (rruff.info [PDF; 1,8 MB; abgerufen am 21. Oktober 2019]).
- Graeme J. Gainsford, Tim Kemmitt, Caleb David Higham: Redetermination of the borax structure from laboratory X-ray data at 145 K. In: Acta Crystallographica. E64, Mai 2008, S. i24–i25, doi:10.1107/S1600536808010441 (englisch, Autoren und Abstract bei researchgate.net).
- Petr Korbel, Milan Novák: Mineralien-Enzyklopädie (= Dörfler Natur). Edition Dörfler im Nebel-Verlag, Eggolsheim 2002, ISBN 978-3-89555-076-8, S. 133.
Weblinks
- Borax. In: Mineralienatlas Lexikon. Stefan Schorn u. a., abgerufen am 5. März 2021.
- Borax search results. In: rruff.info. Database of Raman spectroscopy, X-ray diffraction and chemistry of minerals (RRUFF), abgerufen am 21. Oktober 2019.
- American-Mineralogist-Crystal-Structure-Database – Borax. In: rruff.geo.arizona.edu. Abgerufen am 21. Oktober 2019.
- Informationen zu Lebensmittelzusatzstoffen – E285 Borax. In: zusatzstoffe-online.de. Abgerufen am 21. Mai 2020.
- Borax. (PDF 137 kB) In: bfr.bund.de. Bundesinstitut für Risikobewertung (BfR), 18. Januar 2019, abgerufen am 21. Oktober 2019.
- Datenblatt Borax (PDF) bei Merck, abgerufen am 19. Januar 2011.
Einzelnachweise
- Hans Lüschen: Die Namen der Steine. Das Mineralreich im Spiegel der Sprache. 2. Auflage. Ott Verlag, Thun 1979, ISBN 3-7225-6265-1, S. 192.
- Malcolm Back, William D. Birch, Michel Blondieau und andere: The New IMA List of Minerals – A Work in Progress – Updated: January 2021. (PDF; 3,4 MB) In: cnmnc.main.jp. IMA/CNMNC, Marco Pasero, Januar 2021, abgerufen am 5. März 2021 (englisch).
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 346.
- Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4. durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie (VEB), Leipzig 1987, ISBN 3-342-00288-3, S. 724.
- Borax. In: pubchem.ncbi.nlm.nih.gov. National Library of Medicine, abgerufen am 5. März 2021.
- David Barthelmy: Borax Mineral Data. In: webmineral.com. Abgerufen am 9. Januar 2019 (englisch).
- Borax. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (englisch, handbookofmineralogy.org [PDF; 69 kB; abgerufen am 21. Oktober 2019]).
- Borax. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 5. März 2021 (englisch).
- Borax, der oder das. Duden online, abgerufen am 10. März 2021.
- Eintrag zu Natriumtetraborat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Mai 2021. (JavaScript erforderlich)
- Dietlinde Goltz: Studien zur Geschichte der Mineralnamen in Pharmazie, Chemie und Medizin von den Anfängen bis Paracelsus. (Mathematisch-naturwissenschaftliche Dissertation, Marburg an der Lahn 1966) Wiesbaden 1972 (= Sudhoffs Archiv. Beiheft 14), S. 248–252.
- John Randolph Spears: Illustrated Sketches of Death Valley and Other Borax Deserts of the Pacific Coast. BiblioBazaar, 2008, ISBN 978-0-554-70751-8, S. 172.
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften. Stand 03/2018. 7., vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2018, ISBN 978-3-921656-83-9.
- Ernest H. Nickel, Monte C. Nichols: IMA/CNMNC List of Minerals 2009. (PDF; 1,82 MB) In: cnmnc.main.jp. IMA/CNMNC, Januar 2009, abgerufen am 5. März 2021 (englisch).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1108.
- Tetrabordinatriumheptaoxid, Hydrat. In: reach-clp-biozid-helpdesk.de. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, abgerufen am 5. März 2021.
- Bernd Glassl: REACH-Veranstaltung „Auswirkungen der Kandidatenliste – Aufwand und Nutzen“. In: reach-clp-biozid-helpdesk.de. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA), 11. April 2011, archiviert vom Original am 22. September 2018; abgerufen am 21. Oktober 2019.
- Sodium borate, decahydrate. In: chemcas.com. ChemCAS, abgerufen am 21. Oktober 2019 (englisch).
- Studie zum Umgang mit Bor bei der Altlastenbeurteilung im Auftrag des Kantons Aargau, Schweiz. (PDF 430 kB) In: ag.ch. BMG Engineering AG, 22. Januar 2013, abgerufen am 21. Oktober 2019.
- Helmut Schröcke, Karl-Ludwig Weiner: Mineralogie. Ein Lehrbuch auf systematischer Grundlage. de Gruyter, Berlin; New York 1981, ISBN 3-11-006823-0, S. 563–564.
- Anzahl der Fundorte für Borax. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 5. März 2021 (englisch).
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 137.
- Fundortliste für Borax beim Mineralienatlas und bei Mindat, abgerufen am 21. Oktober 2019.
- 64000 Borax, Tinkal. (PDF 34 kB) In: naturfarben-leipzig.de. Kremer-Pigmente, abgerufen am 21. Oktober 2019.
- Lars Nierobis: Vergleich der wichtigsten Dämmstoffe. In: waermedaemmstoffe.com. 17. August 2007, abgerufen am 21. Oktober 2019.
- Schadstoffberatung Tübingen: Welche Vor- und Nachteile haben verschiedene Dämmmaterialien? (Memento vom 4. März 2010 im Internet Archive), abgerufen am 23. Februar 2010.
- André Leisewitz, Hermann Kruse, Engelbert Schramm: Ergebnisse und zusammenfassende Übersicht zur Substitution umweltrelevanter Flammschutzmittel. In: Erarbeitung von Bewertungsgrundlagen zur Substitution umweltrelevanter Flammschutzmittel. Band 1, Dezember 2000, S. 121 ff. (umweltbundesamt.de [PDF; 1,7 MB; abgerufen am 21. Oktober 2019]).
- André Leisewitz, Hermann Kruse, Engelbert Schramm: Ergebnisse und zusammenfassende Übersicht. In: Erarbeitung von Bewertungsgrundlagen zur Substitution umweltrelevanter Flammschutzmittel. Band 1, Dezember 2000, S. 1–2 (umweltbundesamt.de [PDF; 13 kB; abgerufen am 21. Oktober 2019] Forschungsbericht 20408542 (alt) 29744542 (neu), Umweltforschungsplan des Bundesministers für Umwelt, Naturschutz und Reaktorsicherheit, im Auftrag des Umweltbundesamtes).
- Produktgruppeninformation Zellulose-Dämmstoffe. In: wecobis.de. WECOBIS, abgerufen am 21. Oktober 2019 (30th ATP of Council Directive 67/548/EEC on the classification, labelling of dangerous substances, Kapitel 2.3.2.4).
- Eintrag zu Sodium borate decahydrate (borax) in der Consumer Product Information Database, abgerufen am 19. Dezember 2019.
- Keine Abgabe von Borax in Apotheken. PTA – Aktuelle Meldungen, 17. November 2008, archiviert vom Original am 27. April 2015; abgerufen am 2. April 2018.
- „Kaiser Borax“ enthält kein Borax. In: orf.at, 8. September 2012, abgerufen am 27. Oktober 2020.
- Informationen zu Lebensmittelzusatzstoffen – E285 Borax. In: zusatzstoffe-online.de. Abgerufen am 21. Oktober 2019.
- Uni Bayreuth – Effektexperimente: Slime (Memento vom 27. September 2007 im Internet Archive)
- Borax: das gesundheitsschädliche Heilmittel. In: Medizin Transparent, 12. August 2016, abgerufen am 29. Juni 2021.
- Wunderwaffe Bor? In: Deutsche Apotheker Zeitung, 15. Dezember 2016, abgerufen am 29. Juni 2021.
- Borax – Psiram. Abgerufen am 29. Juni 2021.
- Mangel an Bor. Abgerufen am 29. Juni 2021.
- Bor: ein Gesundheitsrisiko? Abgerufen am 30. August 2021.