Lithiumsulfat
Lithiumsulfat ist eine chemische Verbindung des Lithiums aus der Gruppe der Sulfate.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
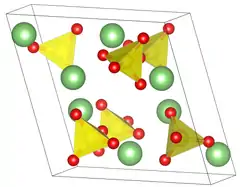 | |||||||||||||
| _ Li+ _ S6+ _ O2− | |||||||||||||
| Kristallsystem |
monoklin | ||||||||||||
| Raumgruppe |
P21/a (Nr. 14, Stellung 3)[1] | ||||||||||||
| Gitterparameter |
a = 8,239 Å, b = 4,954 Å, c = 8,474 Å, β = 107,98° | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Lithiumsulfat | ||||||||||||
| Andere Namen |
Dilithiumsulfat | ||||||||||||
| Verhältnisformel | Li2SO4 | ||||||||||||
| Kurzbeschreibung |
weißes Pulver[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code |
N05AN01 | ||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 109,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
2,22 g·cm−3[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
gut in Wasser (342 g·l−1 bei 25 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Lithiumsulfat wird durch Umsetzung von Lithiumcarbonat mit Schwefelsäure dargestellt.[4]
Eigenschaften
Lithiumsulfat kommt auch als Monohydrat vor, welches sich bei 130 °C zum Anhydrat umwandelt.[5] Das Monohydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21 (Raumgruppen-Nr. 4).[6] Das Anhydrat kristallisiert ebenfalls im monoklinen Kristallsystem, jedoch in der Raumgruppe Raumgruppe P21/c (Raumgruppen-Nr. 14) und 4 Formeleinheiten in der Elementarzelle.[7]
Verwendung
Lithiumsulfat wird in schnellbindendem Zement und in der Lithiumtherapie eingesetzt.[4] Markenname für Medikamente sind Lithionit und Durettes.[8]
Lithiumsulfat-Einkristalle werden zudem in der Piezoelektrik, Akustik, für Ultraschall-Sender sowie zur Lichtablenkung genutzt.[9]
Einzelnachweise
- A. G. Nord: Crystal structure of β-Li2SO4. In: Acta Crystallographica Section B. Band 32, 1976, S. 982–983, doi:10.1107/S0567740876004433.
- Eintrag zu Lithiumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Dezember 2019. (JavaScript erforderlich)
- Datenblatt Lithium sulfate bei Sigma-Aldrich, abgerufen am 3. September 2017 (PDF).
- Ulrich Wietelmann, Richard J. Bauer: Lithium and Lithium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15_393.
- Eintrag zu Lithium sulfate in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 22. Januar 2014.
- L. Bayarjargal, L. Bohatý: Nonlinear optical properties of lithium sulfate monohydrate, Li2SO4.H2O. In: Acta Crystallographica Section A: Foundations of Crystallography. Band 61, A1, 2005, S. 393–394, doi:10.1107/S0108767305083339.
- Y. N. Zhuravlev, L. V. Zhuravleva, O. V. Golovko: Chemical bond in alkali metal sulfates. In: Journal of Structural Chemistry. Band 48, Nr. 5, 2007, S. 789–795, doi:10.1007/s10947-007-0120-y.
- E. Widerlöv: A comparative double-blind study of the side effects of Litarex and Lithionit Durettes. In: Acta Psychiatrica Scandinavica. Band 54, Nr. 4, 1976, ISSN 0001-690X, S. 294–302, doi:10.1111/j.1600-0447.1976.tb00123.x, PMID 793305.
- Eintrag zu Lithiumsulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
