Strukturformel
Der Begriff Strukturformel stellt in der Chemie einen Sammelbegriff für chemische Darstellungsweisen dar, die Information darüber liefern, wie Atome in einem Molekül verbunden und im Raum angeordnet sind.[1] Strukturformeln zeigen die kovalenten Bindungen und – teilweise – die chemische Struktur. Sie werden besonders in der organischen Chemie verwendet. Als Strukturformeln zunehmender Komplexität können Elektronenformeln, Valenzstrichformeln, Keilstrichformeln und Skelettformeln angesehen werden. Eine Sonderstellung nehmen zudem Projektionsformeln (z. B. die Fischerprojektion und die Newmanprojektion) ein.
Geschichtliches zu Strukturformeln
Nach Vorarbeiten von Charles Frédéric Gerhardt, Hermann Kolbe und Edward Frankland konnte August von Kekulé im Jahr 1857 für viele chemische Elemente die Zahl der möglichen Bindungen zu anderen Atomen angeben. Die Zahl der Bindungen eines Atomes zu anderen Atomen wird seit 1860 (nach einem Vorschlag von Emil Erlenmeyer) Wertigkeit genannt. Kekulé formulierte für das Kohlenstoffatom die Vierwertigkeit. Im Jahr 1865 erkannte Kekulé die chemische Struktur von aromatischen Verbindungen wie Benzol und Naphthalin.
Alexander Butlerow benutzte auf der Naturforscherversammlung in Speyer im Jahr 1861 den Namen chemische Struktur.
Alexander Crum Brown verwendete im Jahr 1864 erstmals eine Strukturformel (für Essigsäure), in der die Bindungen zwischen den Atomen durch Striche gekennzeichnet wurden.
Übersicht
| Strukturformeln | Andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronenformel | Valenzstrichformel | Keilstrichformel | Skelettformel | Konstitutionsformel | Summenformel | Verhältnisformel | |
| Methan | 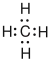 |
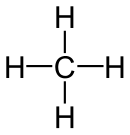 |
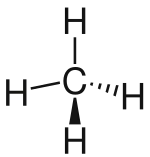 |
existiert nicht | CH4 | CH4 | CH4 |
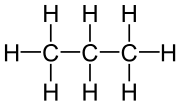
| Propan | 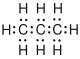 |
 |
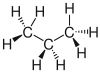 |
CH3–CH2–CH3 | C3H8 | C3H8 | |
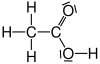
| Essigsäure | 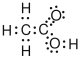 |
 |
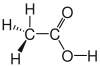 |
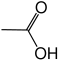 |
CH3–COOH | C2H4O2 | CH2O |
| Wasser | existiert nicht | existiert nicht | H2O | H2O | |||
Aufbau
In der organischen Chemie wird häufig die sogenannte Skelettformel verwendet, bei der C- und H-Atome nicht ausgeschrieben, sondern impliziert (vorausgesetzt) werden. Die Darstellung des Kohlenstoffgerüstes erfolgt über das Zeichnen der Bindungen zwischen den Kohlenstoffatomen. Für jedes Kohlenstoffatom wird eine Ecke gezeichnet. Da Kohlenstoffatome normalerweise 4 Kovalente Bindungen ausbilden, wird die Anzahl der angelagerten Wasserstoffatome berechnet, indem die Anzahl der Bindungen des Kohlenstoffatoms von 4 subtrahiert wird. In aromatischen Ringen ist zudem die Zahl der delokalisierten Elektronen zu berücksichtigen. Im Benzolring befinden sich beispielsweise 6 delokalisierte Elektronen. Folglich ist an jedem der sechs Kohlenstoffatome des Rings nur ein Wasserstoffatom gebunden und nicht zwei wie beim Cyclohexan.
Beispiel
Ein Beispiel ist die Darstellung von Hexamethylentetramin in der Skelettformel:
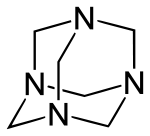 |
_1964%252C_MiNr_440.jpg.webp)
Wie die Formel zeigt, ist es bei der Skelettformel üblich, auf die Darstellung der Kohlenstoffatome und der Wasserstoffatome zu verzichten. Da ein Kohlenstoffatom vier Bindungen und ein Wasserstoffatom eine Bindung eingehen kann, lässt sich die Zahl der Wasserstoffatome berechnen, die an ein Kohlenstoffatom gebunden sind. An jedem Kohlenstoffatom sind im Beispiel also weitere Wasserstoffatome gebunden. Der Name Hexamethylentetramin resultiert aus der Zahl der Methylengruppen (6=Hexa) und der Zahl der Amingruppen (4=Tetra), vgl. griechische Zahlwörter.
Lange unklar war die Struktur von Benzol und damit auch seine Strukturformel: Die Summenformel dieses aromatischen Kohlenwasserstoffes lautet C6H6. Die Konstruktion der entsprechenden Strukturformel erfolgte 1865 durch Friedrich August Kekulé von Stradonitz. Anders als in der Abbildung auf der Briefmarke rechts hat der Benzolring weder Einfach- noch Doppelbindungen an festgelegten Positionen (Mesomerie) – alle C-C-Bindungen im Ring sind identisch.
Räumliche Darstellung
Strukturformeln geben zwar die exakten Bindungsverhältnisse an, bieten jedoch teilweise nur begrenzte Informationen über die genaue räumliche Struktur eines Moleküls. Die für die Reduzierung auf zwei Dimensionen notwendigen Stauchungen führen dazu, dass Bindungslängen und -winkel verzerrt werden.
Um die räumliche Darstellung von Molekülen in einer Zeichnung zu verdeutlichen, können Bindungen als Keile oder gestrichelte Linien gezeichnet werden. Ein Keil stellt eine Bindung dar, die aus der Papierebene heraus steht, während eine gestrichelte Linie eine Bindung darstellt, die in die Papierebene hinein geht. Dies ist vor allem für die Darstellung der Struktur chiraler Substanzen von Bedeutung.
Eine genaue räumliche Darstellung kann über das Kalottenmodell erzielt werden. Früher wurden dazu Bausätze verwendet, heute ist die dreidimensionale Darstellung am Computer üblich (siehe Molekulare Modellierung).
Halbstrukturformel
In Ergänzung und zur Vereinfachung der Darstellung werden Halbstrukturformeln verwendet.
Aus Summenformeln lässt sich oft nicht erkennen, um welche Substanz es sich handelt. Da es jedoch oft nicht nötig oder sehr aufwändig ist, die Strukturformel eines Moleküls zu zeichnen, wurden Halbstrukturformeln eingeführt.
Die Summenformel C3H8O gibt nur die Anzahl der in einem Molekül vorkommenden Atome an, liefert jedoch keine Informationen zur Stoffklasse der Verbindung. Die Halbstrukturformeln CH3–CH2–CH2–OH (1), CH3–CH(OH)–CH3 (2) und CH3–CH2–O–CH3 (3), die in der Summe die gleiche Anzahl von Atomarten enthalten, veranschaulichen dies und sagen aus, dass es sich bei (1) und (2) um Alkohole handelt, bei (3) um einen Ether. In dieser Form entspricht die Halbstrukturformel der Konstitutionsformel.
Außer den „echten“ Halbstrukturformeln (CH3–CH2–CH2–OH) hat sich im Laboralltag die zwischen der Summenformel (C3H8O) und der Halbstrukturformel liegende gängige Form C3H7OH eingebürgert, obwohl diese oft nicht eindeutig ist. Im Beispiel C3H7OH bleibt offen, ob es sich hier um 1-Propanol (n-Propanol) oder um das isomere 2-Propanol (iso-Propanol) handelt. Eindeutig ist hingegen die Schreibweise n-C3H7OH für 1-Propanol bzw. iso-C3H7OH oder i-C3H7OH für 2-Propanol. Als eindeutige Zwischenformen findet man für 1-Propanol gelegentlich auch CH3-(CH2)2-OH oder H3C-(CH2)2-OH.
Siehe auch
- SMILES (chemischer Strukturcode)
- Chemical Markup Language (Dokumentenformat für Strukturformeln)
Einzelnachweise
- Eintrag zu structural formula. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S06061 – Version: 2.1.5.