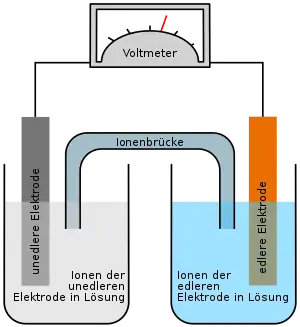
Daniell-Element
Das Daniell-Element (auch Daniell’sches Element) ist eine historische galvanische Zelle, die aus einer Zink- und einer Kupfer-Halbzelle besteht. Sie ist nach John Frederic Daniell benannt, der sie 1836 entwickelte.[1]

Aufbau
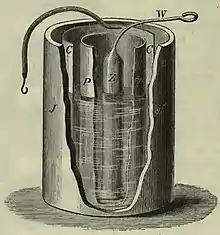
Ein Zinkstab (Z in der Abbildung) im Inneren der Zelle taucht in einer Lösung aus verdünnter Schwefelsäure. Diese befand sich in historischen Bauformen in einem Behälter aus porösem Steingut (P), welcher seinerseits im Außenbereich in eine konzentrierte oder noch besser gesättigte Lösung aus Kupfersulfat getaucht ist. In die Kupfersulfatlösung taucht die zweite Elektrode aus Kupfer, C, ausgeführt als zylinderförmig gebogenes Kupferblech. Die gesamte Zelle ist in einem Außenbehälter J untergebracht.
Das Diaphragma, auch als Salzleiter oder Salzbrücke bezeichnet und in der ursprünglichen Bauform in Form eines Tiegels aus Steingut realisiert, dient dazu, die Diffusionsdurchmischung der unterschiedlichen Metallkationen aus den beiden Lösungen zu verhindern und dennoch einen Ladungsausgleich durch Anionen durch das poröse Material zu ermöglichen.
In der ursprünglichen Bauform mit Steingut als Diaphragma beträgt der Innenwiderstand einer Zelle rund 10 Ω, was bei einer Elementspannung von 1,1 V einen maximalen Entladestrom im Bereich von 100 mA zulässt. Zur Vermeidung dieses hohen Innenwiderstandes wurden verschiedene Gravity-Daniell-Elemente entwickelt, welche als wesentlichen Unterschied das poröse Diaphragma weglassen. Die Sicherstellung der vertikal übereinander angeordneten Sulfatlösungen wird in verschiedenen konstruktiven Ansätzen wie dem Meidinger-Element, Callaud-Element oder Lockwood-Element durch unterschiedliche Dichten der Sulfatlösungen und durch die Gravitation erreicht.
Zur Herstellung eines Daniell-Elements, dessen Spannung der Differenz der Standardpotentiale entspricht, sollten eine Zinksulfatlösung und eine Kupfersulfatlösung mit einer Aktivität von jeweils 1 mol pro Liter verwendet werden, näherungsweise können stattdessen die Konzentrationen 1 mol pro Liter betragen. Für eine Potentialmessung kann die Verbindung der beiden Sulfatlösungen in getrennten Behältern auch über ein spezielles U-Rohr mit Diaphragma als Ionenleiter verbunden werden. Soll nicht die Differenz der Standardpotentiale gemessen, sondern eine möglichst hohe Spannung und eine möglichst hohe Kapazität erreicht werden, so wird die Kupfersulfatkonzentration so hoch wie möglich gewählt, d. h. die Lösung wird gesättigt und sollte möglichst noch ungelöstes CuSO4 enthalten. Der Einfachheit halber wird auf der Zinkseite oft eine Lösung von Zinksulfat verwendet. Ist das Ziel hingegen, mit einer neuen Zelle eine möglichst hohe Spannung zu erzielen, muss die Zinkkonzentration so gering wie möglich gewählt werden, d. h., beim Aufbau der Zelle auf der Zinkseite verdünnte Schwefelsäure oder eine Natriumsulfatlösung einzufüllen. Die Schwefelsäure muss verdünnt sein, da sich Zink ansonsten unter Wasserstoffentwicklung löst.
Funktion
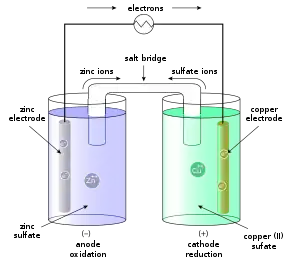
Zink hat ein geringeres Standardpotential als Kupfer, d. h., Zink ist unedler als Kupfer und die Lösungstension von Zink ist größer. Deshalb gehen am Zinkstab verhältnismäßig viele Zinkionen in die Lösung, während sich am Kupferstab nur relativ wenige Kupferionen ablösen und ihre Elektronen im Metall zurücklassen. In der Zinkelektrode, dem negativen Pol und in diesem Fall der Anode, werden mehr Elektronen zurückgelassen, weswegen sie negativer geladen ist als der Kupferstab, was den Aufbau einer elektrischen Spannung bedeutet.
Die überschüssigen Elektronen im oxidierenden Zink (Zn) wandern über einen Leiter vom Zink zum Kupfer (Cu). Dabei lässt sich bei Standardbedingungen eine Spannung von 1,10 V messen. Dies ist die elektrische Quellenspannung, die sich aus dem Redoxpotential von Kupfer (E0(Cu) = +0,34 V) und dem von Zink (E0(Zn) = −0,76 V) zusammensetzt.
Die gelösten Kupferionen nehmen die Elektronen auf und lagern sich als Kupfer an der Elektrode, in diesem Fall der Kathode, ab. Da auf der einen Seite positive Zinkionen in Lösung gehen und sich auf der anderen Seite Kupfer ablagert, muss ein Ladungsausgleich stattfinden. Über die Salzbrücke wandern Sulfat-Anionen [SO4]2− zum Anodenraum und Zink-Kationen Zn2+ in entgegengesetzte Richtung. So wird der Stromkreis geschlossen.
Die beiden Teilvorgänge der Redoxreaktion können also räumlich getrennt werden. Die Elektronen gehen nicht direkt vom System Zn/Zn2+ auf das System Cu/Cu2+ über, sondern wandern zuerst über einen Draht vom Zink zum Kupfer. Es fließt ein Elektronenstrom.
Die beiden getrennten Teilsysteme nennt man „Halbzellen“. Die Zinkelektrode löst sich mit der Zeit infolge der Korrosion auf, während die Kupferelektrode an Masse zunimmt. Es liegen 2 Redoxpaare (Zn/Zn2+ sowie Cu/Cu2+) vor.
Reaktionsgleichung:
- Zellendiagramm: Zn/Zn2+//Cu2+/Cu
- Reduktion:
- Oxidation:
- Gesamtreaktion (Redoxreaktion):
Weblinks
Einzelnachweise
- William Edward Ayrton: Practical Electricity, London, Cassell, 1891 Online