Redoxpotential
Das Redoxpotential (korrekte Bezeichnung nach DIN 38404-6 „Redox-Spannung“) bezeichnet eine Messgröße in der Chemie zur Beschreibung von Redoxreaktionen. Bei der Messgröße handelt es sich um das Reduktions-/Oxidations-Standardpotential eines Stoffes, gemessen unter Standardbedingungen gegen eine Standard-Referenz-Wasserstoffhalbzelle. In biochemischen Systemen ist das Standardredoxpotential definiert beim pH 7,0 gegen eine Standard-Wasserstoffelektrode und bei einem Partialdruck von Wasserstoff von 1 bar.[1]
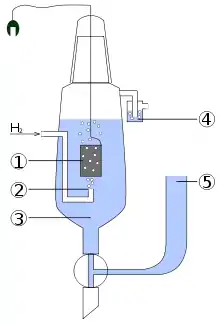
1 – Platinelektrode
2 – Wasserstoffeinstrom
3 – Lösung mit Säure (H+ = 1 mol/l)
4 – Abschluss zur Vermeidung von Störungen durch Sauerstoff
5 – Reservoir
Grundlagen
Bei Redoxreaktionen reagieren zwei Partner miteinander: Im Verlauf wird der eine Partner reduziert, der andere oxidiert. Während bei Säure-Base-Reaktionen, H+-Ionen (Protonen) von einem Partner zum anderen wechseln, wechseln bei Redox-Reaktionen Elektronen den Partner. Der Partner, welcher Elektronen aufnimmt (Oxidationsmittel), wird reduziert, der andere (Reduktionsmittel) wird oxidiert. Somit kann die Redoxreaktion in zwei Halbreaktionen (Redox-Paare) aufgeteilt werden. In einer Reaktion wird oxidiert mit dem Oxidationspotential als Triebkraft, in der anderen wird reduziert mit dem Reduktionspotential als Triebkraft. Das Redoxpotential der beiden Partner ergibt sich als Summe von Oxidationspotential und Reduktionspotential. Je „leichter“ ein Partner oxidiert wird und je „leichter“ der andere Partner reduziert wird, desto höher ist der Wert des gemeinsamen Redoxpotentials.[1] Die Reduktionskraft einer einzelnen Substanz (Element, Kation, Anion) wird durch ihr Redoxpotential beschrieben: diese Größe ist ein Maß für die Bereitschaft, Elektronen abzugeben und damit in die oxidierte Form überzugehen.
- Je negativer ein Redoxpotential, desto stärker ist die Reduktionskraft der Substanz. So ist z. B. das Metall Lithium mit einem Redoxpotential von −3,04 V ein sehr starkes Reduktionsmittel und das Nichtmetall Fluor mit einem Redoxpotential von +2,87 V das stärkste aller Oxidationsmittel.
- Elektronen fließen vom Redoxpaar mit negativerem Potential zum Redoxpaar mit dem positiveren Potential
Standardpotentiale

Da Redoxpotentiale von äußeren Bedingungen wie Druck, Temperatur oder dem pH-Wert abhängig sind, wurde zur besseren Vergleichbarkeit ein Standardzustand definiert, in dem sich die in der Elektrochemischen Spannungsreihe stehenden Halbelemente befinden. In diesem Zustand herrschen die Standardbedingungen: Der Druck beträgt 101,325 kPa, die Temperatur 298,15 K (25 °C), die Aktivität beträgt eins.
Beispiel: Kaliumpermanganat ist ein starkes Oxidationsmittel; die Oxidationskraft und damit das Redoxpotential hängen aber beträchtlich vom pH-Wert ab. Wird Kaliumpermanganat mit einem Reduktionsmittel versetzt, so entstehen bei pH = 1 Mangan(II)-Kationen, bei pH = 7 Mangan(IV)-oxid (Braunstein) und bei pH = 14 Manganat(VI)-Ionen.
Die Umrechnung vom Standardzustand zu jedem beliebigen anderen Zustand gelingt über die Nernst-Gleichung.
Messung und Quantifizierung
Neben der oben erwähnten Berechnung über die Nernst’sche Gleichung stehen noch verschiedene Messmethoden zur Bestimmung von Redoxpotentialen zur Verfügung:
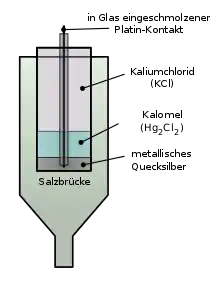
Das Standard-Redoxpotential eines Systems lässt sich durch Aufbau eines Galvanischen Elements mit der Wasserstoffelektrode und Messung der elektrischen Spannung ermitteln. Dafür müssen aber beide Systeme im Standardzustand vorliegen.
Redoxpotentiale sind auch durch Ermittlung der Spannung beim Zusammenschalten mit anderen Halbelementen, deren Redoxpotential bereits bekannt ist, zugänglich. Aus diesem Grund wird in der Praxis oft auf andere Halbelemente als Bezugselemente zurückgegriffen. Gängig ist beispielsweise die Kalomel-Elektrode, da mit ihr Potentialschwankungen durch Temperaturänderungen zu geringeren Messfehlern als bei der Wasserstoffelektrode führen.
| Temperatur | Potentialdifferenz |
|---|---|
| + 18 °C | + 0,2511 V |
| + 20 °C | + 0,2496 V |
| + 22 °C | + 0,2481 V |
Wie aus der Tabelle ersichtlich wird, schwanken die Redoxpotentiale bei Erhöhung oder Erniedrigung um 2 K jeweils nur um rund 0,6 %.
Redoxpotentiale in der Biochemie
Für biochemische Vorgänge rechnet man mit den auf pH 7 bezogenen Potentialen Eo'. Für Reaktionen, an denen Protonen beteiligt sind, ergibt sich somit eine Potentialdifferenz von 0,413 V, wie in der nachfolgenden Tabelle angegeben.
- Bitte beachten: Werden Redoxpotentiale als Eo oder Eo' angegeben (Tabelle), so bezeichnen sie formal das Potential relativ zur Normal-Wasserstoffelektrode. Das Redoxpotential jeder anderen Reaktion, ΔEo bzw. ΔEo', ergibt sich dann durch Differenzbildung der zutreffenden Eo- bzw. Eo'-Werte. Das n bezeichnet die Anzahl der Elektronen, die während der Redoxreaktion übertragen werden. Nach allgemeiner Konvention bezieht sich das Formalpotential E0, bzw. E0' auf das Reduktionspotential. Daher steht die Reduktionsreaktion in der Tabelle auf der linken Seite.
| Oxidierte Form / Reduzierte Form | n | Eo in V bei pH 0 | Eo' in V bei pH 7 |
|---|---|---|---|
| Ferredoxin Fe3+/Fe2+ | 1 | −0,43 | −0,43 |
| 2 H+/ H2 | 2 | 0 | −0,413 |
| NAD+, 2H+/NADH,H + | 2 | +0,09 | −0,32 |
| Liponsäure: Lipons., 2 H+/Lipons.-H2 | 2 | +0,21 | −0,29 |
| Acetaldehyd 2 H+/Ethanol | 2 | +0,21 | −0,20 |
| Flavin-Nukleotide (FAD, FMN): F, 2H+/F–H2 | 2 | +0,22 | −0,191) |
| Glutathion: (GS)2, 2 H+/2GSH | 2 | +0,31 | −0,10 |
| Fumarat, 2 H+/Succinat | 2 | +0,38 | +0,03 |
| Dehydroascorbat/Ascorbat, 2 H+ | 2 | +0,35 | +0,08 |
| Ubichinon, 2 H+/Hydrochinon | 2 | +0,51 | +0,10 |
| ½O2, 2 H+/H2O | 2 | +1,23 | +0,82 |
| Häm-Eisen-Proteine | |||
| Katalase Fe3+/Fe2+ | 1 | −0,5 | −0,5 |
| Peroxidase Fe3+/Fe2+ | 1 | −0,2 | −0,2 |
| Cytochrom b562 Fe3+/Fe2+ | 1 | −0,1 | −0,1 |
| Cytochrom b Fe3+/Fe2+ (Mitochondrien) | 1 | +0,077 | +0,077 |
| Cytochrom b5 Fe3+/Fe2+ | 1 | +0 | +0 |
| Hämoglobin, Myoglobin Fe3+/Fe2+ | 1 | +0,1 | +0,12) |
| Cytochrom c1 Fe3+/Fe2+ | 1 | +0,22 | +0,22 |
| Cytochrom c Fe3+/Fe2+ | 1 | +0,235 | +0,235 |
| Cytochrom a Fe3+/Fe2+ | 1 | +0,29 | +0,29 |
| Cytochrom a3 Fe3+/Fe2+ | 1 | +0,385 | +0,385 |
- 1) Flavin-Nucleotide sind fest gebundene prosthetische Gruppen, deren genaues Redoxpotential vom Proteinpartner abhängt.2) Bemerkenswert ist die geringe Bereitschaft von Hämoglobin, Elektronen abzugeben: Dies würde zum Funktionsverlust führen.
Einzelnachweise
- Eintrag zu redox potential. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.RT06783.
- Rolf Dolder: Stabilisation oxydationsempfindlicher Arzneistoffe als Redoxsysteme. Dissertation Zürich 1950 (PDF; 4,3 MB)