Funktionelle Gruppe
In der Organischen Chemie versteht man unter einer funktionellen Gruppe (auch charakteristische Gruppe) die Atomgruppe in einer Verbindung, die die Stoffeigenschaften und das Reaktionsverhalten der Verbindung maßgeblich bestimmt. Eine Verbindung kann auch mehrere funktionelle Gruppen mit unterschiedlichen Eigenschaften tragen.[1] Verbindungen, die gleiche funktionelle Gruppen, aber unterschiedliche Alkyl- oder Arylreste haben, werden auf Grund ihrer ähnlichen Eigenschaften zu Stoffklassen zusammengefasst.
Funktionelle Gruppen werden anhand der beteiligten Atome in funktionelle Gruppen mit Heteroatomen (meist O, N, S, P, Halogene) und solche ohne Heteroatome (z. B. C=C-Doppelbindungen, C≡C-Dreifachbindungen oder Aromaten) eingeteilt. Auch wenn Letztere manchmal nicht als „vollwertige“ funktionelle Gruppen, sondern nur als Strukturbausteine betrachtet werden, so zeigen sie doch ein besonderes und typisches Reaktionsverhalten, das die Bezeichnung funktionelle Gruppe und die jeweilige Zusammenfassung zu Stoffklassen rechtfertigt.
Im Fall von anorganischen oder metallorganischen Verbindungen werden auch einfache Alkyl- oder Arylgruppen als funktionelle Gruppen angesehen. Alle organischen Seitenketten und funktionellen Gruppen werden dann unter der allgemeinen Bezeichnung Organylgruppe zusammengefasst.
Für funktionelle Gruppen gibt es zur Vereinfachung der Schreibung in Strukturformeln und Texten Abkürzungen, die in der Liste der Abkürzungen in der organischen Chemie aufgelistet sind.
Eigenschaften
Nach der Definition beeinflusst eine funktionelle Gruppe die chemischen und physikalischen Eigenschaften der sie enthaltenden Ausgangsverbindung meist erheblich. Die Art der Beeinflussung wird am Beispiel des Alkans Butan und drei seiner strukturellen Abkömmlinge mit gleicher Anzahl von C-Atomen vor Augen geführt:
| Struktureller Abkömmling mit gleicher Anzahl von C-Atomen |
Verbindung | Halbstrukturformel | Eigenschaften |
|---|---|---|---|
| Ausgangsverbindung | Butan | H3C–CH2–CH2–CH3 | gasförmig |
| Carboxyverbindung | Butansäure, auch Buttersäure | H3C–CH2–CH2–COOH | flüssig, übelriechend, reagiert sauer |
| Aminoverbindung | Butan-2-amin, auch 2-Butylamin | H3C–CH(NH2)–CH2–CH3 | flüssig, übelriechend, reagiert basisch |
| Carboxy- und Aminoverbindung | 4-Aminobutansäure, auch 4-Aminobuttersäure oder γ-Aminobuttersäure (GABA) |
H2N–CH2–CH2–CH2–COOH | fest, liegt in wässriger Lösung als Zwitterion H3N+–CH2–CH2–CH2–COO− vor |
Verschiedene funktionelle Gruppen und deren Nomenklatur
Grundsätzlich ist die substitutive Nomenklatur, die im Folgenden beschrieben wird, zur Benennung von Substanzen heranzuziehen. Nach dieser Nomenklatur ist die funktionelle Gruppe entweder als Vorsilbe (Präfix) oder als Endung (Suffix) im Namen der Gesamtverbindung enthalten.
Siehe auch: Nomenklatur
Funktionelle Gruppen (nach abnehmender Priorität geordnet)
Für die Bezeichnung dieser Gruppen in einer Verbindung werden entweder Präfixe oder Suffixe verwendet. Die ranghöchste Gruppe wird dabei als Endung verwendet und alle anderen, alphabetisch geordnet, als Vorsilben. Die verschiedenen Verbindungsklassen sind in der folgenden Tabelle nach abnehmender Priorität geordnet.[2]
Zum Teil gibt es unterschiedliche Bezeichnungen, je nachdem ob das angegebene Kohlenstoffatom einen Teil des Stammsystems (siehe Stichwort Nomenklatur) darstellt (Darstellung: R-CXYZ) oder nicht (Darstellung: R-CXYZ). Wie in der Chemie üblich, steht der Buchstabe R für einen organischen Rest. Der Platzhalter X steht hier für Halogenide.
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe (Präfix) | Endung (Suffix) | Beispiele |
|---|---|---|---|---|---|
| R• bzw. R: | Radikale | Ylo- | -yl -yliden |
z. B. Cl• oder Triplett-Carben | |
| Kationen | -ium -onium -ylium |
z. B. Kationische Tenside, Methyltriphenylphosphonium | |||
| R–COOH R–COOH |
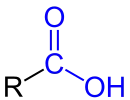 Allgemeine Struktur der Monocarbonsäure mit der blau markierten Carboxy-Funktion |
Carbonsäuren | Carboxy- - |
-carbonsäure -säure |
z. B. Ameisensäure, Essigsäure, Buttersäure, Aminosäuren |
| R–COOOH R–COOOH |
Allgemeine Struktur der Peroxycarbonsäure mit dem blau markierten Peroxycarboxyl-Rest |
Peroxycarbonsäuren | Hydroperoxycarbonyl- - |
-peroxycarbonsäure -Peroxy....säure |
z. B. Peroxyessigsäure |
| R–CS–OH R–CS–OH R–CO–SH R–CO–SH R–CS–SH R–CS–SH |
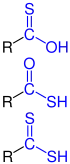 Allgemeine Strukturen der Thiocarbonsäuren |
Thiocarbonsäuren | Hydroxy(thiocarbonyl)- Thiocarboxy- - Sulfanylcarbonyl- Thiocarboxy- - (Dithiocarboxy)- - |
-carbothio-O-säure -thio-O-säure -carbothio-S-säure -thio-S-säure -carbodithiosäure -dithiosäure |
|
| R–SO2–OH | 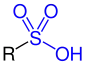 Allgemeine Struktur der Sulfonsäure |
Sulfonsäuren | Sulfo- | -sulfonsäure | z. B. Benzolsulfonsäure |
| R–SO–OH | 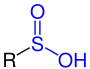 Allgemeine Struktur der Sulfinsäure |
Sulfinsäuren | Sulfino- | -sulfinsäure | |
| R1–CO–S–R2 | 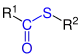 Allgemeine Struktur der Thiolester |
Thiolester | R1oyl-thio- | S-R2yl-R1-thioate | |
| R–S–OH | Allgemeine Struktur der Sulfensäure |
Sulfensäuren | Sulfeno- | -sulfensäure | |
| R1–SO–R2 | 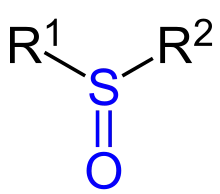 Allgemeine Struktur von Sulfoxiden mit der blau markiertenSulfinylgruppe |
Sulfoxide | sulfinyl- | -sulfoxid | z. B. Dimethylsulfoxid |
| R–COO−M+ R–COO−M+ |
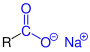 Allgemeine Struktur von Carbonsäuresalzen |
Carbonsäuresalze | Metallcarboxylato- - |
Metall-...-carboxylat Metall-...-oat |
z. B. Acetat |
| R–SO2–O−M+ | Allgemeine Struktur von Sulfonsäuresalzen |
Sulfonsäuresalze | Metallsulfonato- | Metall-...-sulfonat | |
| R–SO–O−M+ | 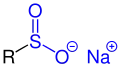 Allgemeine Struktur von Sulfinsäuresalzen |
Sulfinsäuresalze | Metallsulfinato- | Metall-...-sulfinat | |
| R–S–O−M+ | Allgemeine Struktur von Sulfensäuresalzen |
Sulfensäuresalze | Metallsulfenato- | Metall-...-sulfenat | |
| R1–CO–O–CO–R2 | 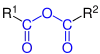 Allgemeine Struktur des Carbonsäureanhydrids |
Carbonsäureanhydride | - | ...-säure...-säureanhydrid bei gleichen Säuren: ...-säureanhydrid |
z. B. Essigsäureanhydrid |
| R1–CO–O–R2 | Allgemeine Struktur des Carbonsäureesters |
Carbonsäureester | (R yl-)oxycarbonyl |
(R yl-)...-carboxylat (R yl-)...-oat - |
z. B. Ethylacetat |
| R1–SO2–O–R2 | Allgemeine Struktur des Sulfonsäureesters |
Sulfonsäureester | (R yl-)oxysulfonyl- | (R yl-)...-sulfonat | |
| R–O–NO2 | Allgemeine Struktur des Salpetersäureesters mit der blaumarkierte Salpetersäureester-(Nitrat-)Gruppe |
Salpetersäureester | -nitrat | z. B. Nitroglycerin, Nitrocellulose | |
| R–CO–X R–CO–X |
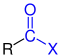 Allgemeine Struktur der Carbonsäurehalogenide mit dem blau markierten Halogencarbonyl-Rest |
Carbonsäurehalogenide | Halogencarbonyl- - |
-carbonylhalogenid -oylhalogenid |
z. B. Benzoylchlorid |
| R–SO2–X | Allgemeine Struktur der Sulfonsäurehalogenide mit dem blau markierten Halogensulfonyl-Rest |
Sulfonsäurehalogenide | Halogensulfonyl- | -sulfonylhalogenid | |
| R–CO–NH2 R–CO–NH2 |
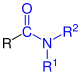 Allgemeine Struktur der Carbonsäureamide mit dem blau markierten Carbamoyl-Rest. R = H oder Organylgruppe |
Carbonsäureamide | Carbamoyl- - |
-carboxamid -amid |
|
| R–SO2–NH2 | 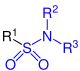 Allgemeine Struktur der Sulfonsäureamide mit dem blau markierten Sulfamoyl-Rest. R = H oder Organylgruppe |
Sulfonsäureamide | Sulfamoyl- | -sulfonamid | |
| R–CO–NH–NH2 R–CO–NH–NH2 |
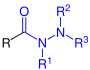 Allgemeine Struktur der Carbonsäurehydrazide mit dem blau markierten Hydrazinocarbonyl-Rest. R = H oder Organylgruppe |
Carbonsäurehydrazide | Hydrazinocarbonyl- | -carbohydrazid -ohydrazid |
|
| R–C≡N R–C≡N |
Allgemeine Struktur der Nitrile |
Nitrile | Cyan- - |
-carbonitril -nitril |
z. B. Acetonitril |
| R–CO–H R–CO–H |
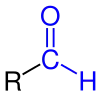 Allgemeine Struktur der Aldehyde mit der blau markierten Aldehyd-(Formyl-)Gruppe |
Aldehyde | Formyl- Oxo- |
-carbaldehyd -al |
z. B. Formaldehyd, Acetaldehyd |
| R–CS–H R–CS–H |
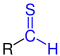 Allgemeine Struktur der Thioaldehyde mit der blau markierten Thioaldehyd-Gruppe |
Thioaldehyde | Thioformyl- Thioxo- |
-carbothialdehyd -thial |
|
| R1–CO–R2 | 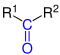 Allgemeine Struktur der Ketone mit der blau markierten Carbonylgruppe |
Ketone | Oxo- | -on | z. B. Aceton |
| R1–CS–R2 | 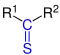 Allgemeine Struktur der Thioketone mit der blau markierten Thiocarbonylgruppe |
Thioketone | Thioxo- | -thion -thioketon |
|
| R1R2–C=N–OH | 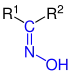 Allgemeine Struktur der Oxime mit der blau markierten Oximgruppe. R = H oder Organylgruppe |
Oxime | Hydroxyimino- | -aloxim -(carb)aldehydoxim -onoxim |
|
| R1R2–C=N–NH2 | 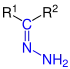 Allgemeine Struktur der Hydrazone mit der blau markierten Hydrazo-Gruppe. R = H oder Organylgruppe |
Hydrazone | Hydrazono- | -alhydrazon -(carb)aldehydhydrazon -onhydrazon |
|
| R–OH | Allgemeine Struktur der Hydroxygruppe (blau markiert) |
Alkohole und Phenole | Hydroxy- | -ol | Alkohole z. B. Methanol, Ethanol, Isopropanol, Phenol |
| R–SH | Allgemeine Struktur der Thiole mit der blau markierten Thio-(Mercapto-)Gruppe |
Thiole | Sulfanyl- alt: Mercapto- |
-thiol -mercaptan |
Thioalkohole, Thiophenole z. B. Methylmercaptan |
| R–NH2 | 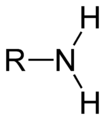 Allgemeine Struktur der Amine mit der blau markierten Amino-Gruppe |
Amine | Amino- | -amin | z. B. Anilin, Aminosäuren |
| R1R2–C=N–R3 |  Allgemeine Struktur der Imine mit der blau markierten Imino-Gruppe. R = H oder Organylgruppe |
Imine | Imino- | -imin | |
| R–NH–NH2 | Allgemeine Struktur der Hydrazine mit der blau markierten Hydrazino-Gruppe |
Hydrazine | Hydrazino- | -hydrazin | |
| R1–O–R2 | Allgemeine Struktur der Ether |
Ether | (R2yl)-oxy- | (R1yl)-(R2yl)-ether | z. B. Diethylether, Dioxan |
| R1–S–R2 | Allgemeine Struktur der Thioether |
Thioether | (R2yl)-thio- | (R1yl)-(R2yl)-sulfid | |
| R–(O)C–NR–C(O)–R | Imide | ||||
Funktionelle Gruppen ohne Priorität
Grundsätzlich nur als Vorsilben (Präfixe) werden folgende funktionelle Gruppen verwendet:
| Halbstrukturformel | Strukturformel | Stoffklasse | Vorsilbe | Beispiele |
|---|---|---|---|---|
| R–X | Allgemeine Struktur der Halogenkohlenwasserstoffe mit blaumarkierten Halogen = F, Cl, Br, I |
Halogenkohlenwasserstoffe | Halogen- | Fluorchlorkohlenwasserstoffe z. B. Frigen, Chloroform |
| R–NO2 | 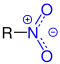 Allgemeine Struktur der Nitroverbindungen mit der blaumarkierten Nitro-Gruppe |
Nitroverbindungen | Nitro- | Nitrite z. B. Trinitrotoluol (TNT) |
| R–NO | Allgemeine Struktur der Nitrosoverbindungen mit der blaumarkierten Nitroso-Gruppe |
Nitrosoverbindungen | Nitrosyl- | |
| R1–NN–R2 |  Allgemeine Struktur der Azoverbindungen mit der blaumarkierten Azo-Gruppe |
Azoverbindungen | Azo- | Azofarbstoffe z. B. Gelborange S |
| R1R2–CNN |  Allgemeine Struktur der Diazoverbindungen mit der blaumarkierten Diazo-Gruppe. R = H oder Organylgruppe |
Diazoverbindungen | Diazo- | z. B. Diazomethan |
| R–NN+ Z− | Allgemeine Struktur der Diazoniumsalze mit einem nicht näher spezifizierten Anion Z |
Diazoniumsalze | Diazonium- | |
| R–NC | Allgemeine Struktur der Isocyanide |
Isocyanide | Isocyan- | |
| R–OCN | Allgemeine Struktur der Cyanate |
Cyanate | Cyanato- | |
| R–NCO | Allgemeine Struktur der Isocyanate |
Isocyanate | Isocyanato- | |
| R–SCN | Allgemeine Struktur der Thiocyanate |
Thiocyanate | Thiocyanato- | |
| R–NCS | Allgemeine Struktur der Isothiocyanate |
Isothiocyanate | Isothiocyanato- | |
| R–OOH | Allgemeine Struktur der Hydroperoxide |
Hydroperoxide | Hydroperoxy- | |
| R1–OO–R2 | Allgemeine Struktur der Peroxide mit der blaumarkierten Peroxid-Gruppe |
Peroxide | (R-)dioxy- | |
Sonderfall Mehrfachbindungen
Ebenfalls zu den funktionellen Gruppen gerechnet werden die Mehrfachbindungen zwischen zwei Kohlenstoffatomen:
| Halbstrukturformel | Name | Vorsilbe | Endung | Beispiele |
|---|---|---|---|---|
| R–C=C–R | Doppelbindung | "-enyl" | „-en“ | z. B. Ethen |
| R–C≡C–R | Dreifachbindung | "-inyl" | „-in“ | z. B. Ethin |
Aus Sicht der Nomenklatur werden Mehrfachbindungen aber im Allgemeinen als Teil des Stammsystems aufgefasst.
Alternative Nomenklatursysteme
Neben diesem Nomenklatursystem gibt es noch weitere, weniger gebräuchliche oder veraltete Nomenklatursysteme. Eines davon ist z. B. die radikofunktionelle Nomenklatur, nach der z. B. Chlormethan als Methylchlorid oder Ethanol als Ethylalkohol bezeichnet werden.
Einzelnachweise
- Eintrag zu functional group. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02555.
- Rainer Beckert et al.: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3, S. 137.
Literatur
- Günter Baars, Roland Franik, Walter Jansen, Hans Pickel, Georg Schwedt, Herbert Sommerfeld: Handbuch der experimentellen Chemie: Sekundarbereich II. Band 10: Funktionelle Gruppen, Fette, Farbstoffe. (Herausgeber: Walter Jansen, Rudolf G Weissenhorn, Wolfgang Glöckner), Aulis, Hallbergmoos 2008, ISBN 978-3-7614-2388-2.
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie: Eine Gebrauchsanweisung. 4. Auflage. Springer, Berlin 1998, ISBN 3-540-63221-2.
Weblinks
- Offizielle Seite der International Union of Pure and Applied Chemistry (englisch)
- IUPAC-Regeln zur Nomenklatur in der organischen Chemie (englisch)