Simmons-Smith-Reaktion
Die Simmons-Smith-Reaktion ist eine Namensreaktion in der Organischen Chemie, die nach ihren Entwicklern Howard E. Simmons und Ronald D. Smith benannt wurde.[1][2] Sie dient der Synthese von Derivaten des Cyclopropans und ist eine Additionsreaktion, wobei ein Carben an eine Doppelbindung addiert wird, ohne dass freies Carben im Reaktionsgemisch vorhanden ist.[3]
Übersichtsreaktion
Ein Alken reagiert mit den Reagenzien Diiodmethan und Zink zu einem Cyclopropan und Zinkiodid.

Mechanismus
Zunächst wird aus Diiodmethan und überschüssigem aktivierten Zink, welches durch Verwendung des Zink-Kupfer-Paares erhältlich ist, ein Zinkcarben (Carbenoid) erzeugt. Diese Organozinkverbindung ist vergleichbar mit der Grignard-Verbindung. Abhängig vom Lösungsmittel hat das Substrat eine unterschiedliche Struktur, welche dem Schlenk-Gleichgewicht bei der Grignard-Reaktion entspricht.
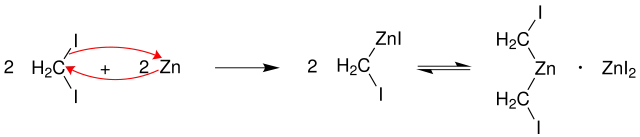
Im nächsten Reaktionsschritt reagiert das Carbenoid mit einem Alken. Die Methylengruppe des Carbenoid addiert dabei in einer konzertierten Reaktion an die Doppelbindung des Alkens. In einem Übergangszustand werden Elektronen verschoben, woraufhin Cyclopropan und Zinkiodid entstehen.
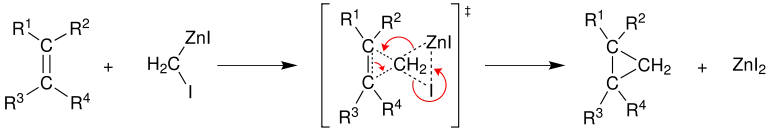
Die Simmons-Smith-Reaktion verläuft stereospezifisch. Das bedeutet, dass bei Verwendung von cis-Alkenen cis-Cyclopropanderivate erhalten werden und bei Verwendung eines trans-Alkens die entsprechenden trans-Derivate. Anstelle des Zink-Kupfer-Paares kann auch Diethylzink als Zinkquelle verwendet werden.[4][5]
Stereoselektivität
Diastereoselektivität
Die Simmons-Smith-Reaktion verläuft unter Verwendung von asymmetrisch substituierten Alkenen (Chiralitätszentrum mit einer funktionelle Gruppe in einer Nachbarposition zum Alken) hoch diastereoselektiv. Eine Erklärung für diesen Befund liefert eine koordinative Wechselwirkung des Zinks mit der funktionellen Gruppe im Übergangszustand der Reaktion. Durch eine gewisse Vorkoordinierung kann so die Stereoinformation induziert werden, die zur bevorzugten Bildung eines Diastereoisomers führt.[6] Setzt man beispielsweise den folgenden cyclischen Allylalkohol ein, so erfolgt die Cyclopropanierung bevorzugt auf der Vorderseite, da dort die Wechselwirkung des Zinks mit dem Sauerstoffatom der Hydroxy-Gruppe stattfinden kann. Bei Ausbeuten um 63 % erreicht man so nahezu quantitative Diastereoselektivitäten (ds).[7]
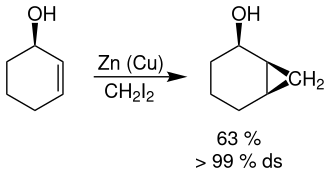
Durch sterisch anspruchsvolle Reste kann der Angriff von dieser Seite gehindert werden und die Cyclopropanierung findet bevorzugt von der anderen Seite statt.[8]
Enantioselektivität
Durch Verwendung chiraler Liganden kann die Simmons-Smith-Reaktion auch enantioselektiv geführt werden. Dies gelang erstmals 1992 unter Verwendung chiraler Disulfonamid-Liganden.[9]
Varianten
Furukawa-Variante
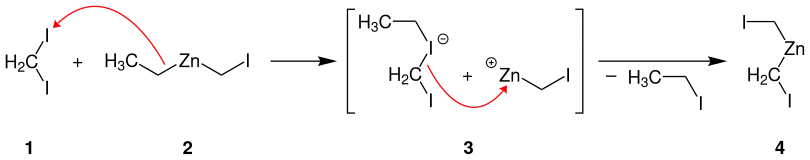
Eine modifizierte Variante der Simmons-Smith-Reaktion stellt die Furukawa-Variante dar. Diese unterscheidet sich im Wesentlichen in dem eingesetzten Carbenoid und dessen Herstellung. Dazu setzt man zunächst Diiodmethan (1) mit Diethylzink (2) um, wobei eine Ethyl-Gruppe auf ein Iod-Atom übertragen wird und das Zwischenprodukt (3) gebildet wird. Dieses zerfällt unter Abspaltung von Ethyliodid zum Furukawa-Carbenoid (4).[10]

Das Furukawa-Carbenoid wird dabei in situ während der Simmons-Smith-Reaktion erzeugt. Ein Alken (1) oder allgemein eine C–C-Doppelbindung in einem Molekül wird zunächst mit Diiodmethan und Diethylzink unter Abspaltung von Ethyliodid zum Furukawa-Carbenoid umgesetzt, welches in einem dreigliedrigen Übergangszustand (2) mit der Doppelbindung reagiert. Dabei spaltet sich Zinkethyliodid unter Bildung eines Cyclopropan-Derivats (3) ab.[10]
.svg.png.webp)
Auch die Furukawa-Variante verläuft stereoselektiv und stereospezifisch.[10]
Sawada-Denmark-Variante
Eine weitere Variante der Simmons-Smith-Reaktion ist die Sawada-Denmark-Variante. Das dazugehörige Sawada-Denmark-Carbenoid (4) erhält man durch Umsetzung von Diiodmethan (1) mit dem Furukawa-Carbenoid (2) unter Abspaltung von Ethyliodid über die Zwischenstufe (3):
Das Sawada-Denmark-Carbenoid wird dabei in situ während der Simmons-Smith-Reaktion erzeugt. Ein Alken (1) oder allgemein eine C–C-Doppelbindung in einem Molekül wird zunächst mit Diiodmethan und dem Furukawa-Carbenoid unter Abspaltung von Ethyliodid zum Sawada-Denmark-Carbenoid umgesetzt, welches in einem dreigliedrigen Übergangszustand (2) mit der Doppelbindung reagiert. Dabei spaltet sich Iodzinkethyliodid unter Bildung eines Cyclopropan-Derivats (3) ab.[10]
.svg.png.webp)
Wie auch die herkömmliche Simmons-Smith-Reaktion verläuft die Sawada-Denmark-Variante stereoselektiv und stereospezifisch.
Verwendung
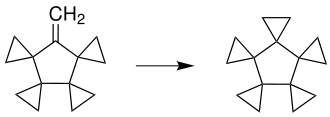
Die Simmons-Smith-Reaktion wird zum Beispiel zur Herstellung von Spiroverbindungen verwendet. Die Abbildung zeigt die Synthese des Rotans.
Eine weitere Anwendung ist die indirekte α-Methylierung von Ketonen.[11]
Literatur
T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen. 4. Auflage, Teubner, Wiesbaden 2004, ISBN 3-519-33526-3.
Einzelnachweise
- H. E. Simmons Jr., R. D. Smith: A new Synthesis of Cyclopropanes from Olefins, in: J. Am. Chem. Soc. 1958, 80, 5323–5324.
- H. E. Simmons, R. D. Smith: A New Synthesis of Cyclopropanes, in: J. Am. Chem. Soc. 1959, 81, 4256–4264.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 307–309.
- A. B. Charette, H. Lebel: (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol In: Organic Syntheses. 76, 1999, S. 86, doi:10.15227/orgsyn.076.0086; Coll. Vol. 10, 2004, S. 613 (PDF).
- Y. Ito: One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one In: Organic Syntheses. 59, 1979, S. 113, doi:10.15227/orgsyn.059.0113; Coll. Vol. 6, 1988, S. 327 (PDF).
- Grieco et al. J. Org. Chem. 1977, 42, 4113.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organic Chemistry. 2. Auflage. Oxford University Press, 2012, ISBN 978-0-19-927029-3, S. 1017.
- H. E. Simmons, T. L. Cairns, S. A. Vladuchick, C. M. Hoiness: Cyclopropanes from Unsaturated Compounds, Methylene Iodide, and Zinc-Copper Couple, Org. React. 1973, 20, 1-131, doi:10.1002/0471264180.or020.01
- H. Takahashi, M. Yoshioka, M. Ohno, S. Kobayashi: A catalytic enantioselective reaction using a C2-symmetric disulfonamide as a chiral ligand: cyclopropanation of allylic alcohols by the Et2Zn-CH2I2-disulfonamide system, Tetrahedron Lett. 1992, 33, 2575–2578.
- Reinhard Brückner: Reaktionsmechanismen – Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Springer Spektrum, Berlin-Heidelberg 2015, ISBN 978-3-662-45683-5, S. 117.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 307–309.