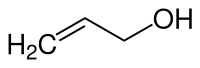
Allylalkohol
Allylalkohol, auch als 2-Propen-1-ol bezeichnet, ist eine farblose, klare und bei Raumtemperatur flüssige chemische Verbindung. Sie bildet heftig reizende Dämpfe von fadem, stechendem Geruch. Sie besteht aus einer Kette von drei Kohlenstoffatomen mit einer Doppelbindung, sowie Wasserstoffatomen und einer Hydroxygruppe (OH-Gruppe). Allylalkohol ist damit ein ungesättigter Alkohol und zählt zu den Alkenolen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Allylalkohol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,85 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
97 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
15,5 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4135 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Die erste Darstellung von Allylalkohol erfolgte 1856 durch Cahours und Hofmann ausgehend von Allyliodid.[7]
Industrielle Synthesen
Die technische Herstellung von Allylalkohol kann durch Isomerisierung von Propylenoxid bei Temperaturen von 270–320 °C und geringen Überdrücken von 1–2 bar an geträgerten Lithiumphosphat-Katalysatoren erfolgen.[8]
.svg.png.webp)
Man leitet dabei ein Gasgemisch aus Propylenoxid und einem Inertgas oder auch reines Propylenoxid in einen Festbettreaktor. Der Propylenoxid-Umsatz wird bevorzugt auf etwa 70–75 % eingestellt. Die Selektivität zum Allylalkohol beträgt dann 95–97 %. Als wesentliche Nebenprodukte entstehen geringe Mengen an Aceton und Propionaldehyd.[9]
Weiterhin kann Allylalkohol auch durch alkalische Hydrolyse von Allylchlorid, durch Hydrolyse/Methanolyse von Allylacetat oder aber durch eine Selektivhydrierung von Acrolein (z. B. an Silberkatalysatoren) erfolgen.[7][10]
Labormaßstab
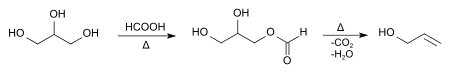
Im Labor lässt sich Allylalkohol durch die Umsetzung von Glycerin mit Ameisensäure darstellen.[11]
Daneben ist Allylalkohol durch eine Meerwein-Ponndorf-Verley-Reduktion von Acrolein bzw. als Nebenprodukt einer Tischtschenko-Reaktion zugänglich.[12]
Verwendung (Auswahl)
Allylalkohol ist ein wichtiges Zwischenprodukt in zahlreichen organisch-chemischen Synthesen. Durch gezielte Oxidation erhält man Acrolein, aus dem > 400 000 t/Jahr der Aminosäure DL-Methionin hergestellt werden; Weltmarktführer dafür ist Evonik Industries. Der Arzneistoff Dimercaprol wird in zwei Stufen aus Allylalkohol hergestellt.[13]
Sicherheitshinweise
Allylalkohol ist entzündlich und giftig beim Einatmen, Verschlucken und Berührung mit der Haut. Er sollte bei maximal 15 °C und damit in einem Kühlschrank für Chemikalien gelagert werden.
Literatur
- Eintrag zu Allylalkohol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
Einzelnachweise
- Eintrag zu Allylalkohol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dissociation Constants of Organic Acids and Bases, S. 8-43.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-12.
- Eintrag zu Allyl alcohol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-18-6 bzw. Allylalkohol), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2000 doi:10.1002/14356007.a01_425.
- Stefan Marz: Gasphasenumsetzung von Dimethylmaleat zu Tetrahydrofuran: Prozessintensivierung und Kinetik. In: KIT Scientific Publishing. Karlsruher Institut für Technologie, 20. Februar 2014, S. 20, doi:10.5445/KSP/1000036268
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 330.
- J. Hohmeyer: Charakterisierung von Silberkatalysatoren für die Selektivhydrierung mittels DRIFT-Spektroskopie, Adsorptionskalorimetrie und TAP-Reaktor. Dissertation, Fritz-Haber-Institut Berlin / Technische Universität Darmstadt, 2009.
- O. Kamm, E. R. Taylor: Allyl alcohol In: Organic Syntheses. 1, 1921, S. 15, doi:10.15227/orgsyn.001.0015; Coll. Vol. 1, 1941, S. 42 (PDF).
- H. Beyer, W. Walter Lehrbuch der Organischen Chemie, 23. Aufl., Hirzel Verlag, Stuttgart, 1998.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, S. 662–663, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.