Boudouard-Gleichgewicht
Das Boudouard-Gleichgewicht ist das nach Octave Leopold Boudouard (1872–1923) benannte Gleichgewicht zwischen Kohlenstoffdioxid (CO2) und Kohlenstoffmonoxid (CO), das sich bei der Umsetzung mit glühendem Kohlenstoff einstellt.
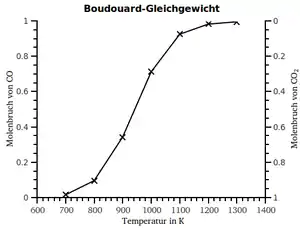
| Temperatur in °C | CO2 in % | CO in % |
| 450 | 98 | 2 |
| 600 | 77 | 23 |
| 700 | 42 | 58 |
| 800 | 6 | 94 |
| 900 | 3 | 97 |
| 1000 | 1 | 99 |
| Boudouard-Gleichgewicht bei 105 Pa | ||
Die Bildungsenthalpie von Kohlendioxid ist −393,5 kJ/mol. Bei der Reduktion mit Kohlenstoff bilden sich zwei Mol Kohlenmonoxid (= −110,5 kJ/mol), der Prozess in der Gasphase ist stark endotherm (ber. +172,5 kJ/mol).[2]
Hohe Temperaturen verschieben das Gleichgewicht aufgrund der endothermen Reaktion auf die Produktseite (CO), eine Erhöhung des Drucks verschiebt es auf die Seite der Edukte, da die Anzahl der gasförmigen Moleküle dadurch abnimmt. (Siehe dazu Prinzip vom kleinsten Zwang). Bei Raumtemperatur wird die Umwandlungsgeschwindigkeit unmessbar klein: Kohlenmonoxid ist metastabil.
Die Reaktion wird bei der Erzeugung von Generatorgas angewandt und stellt einen wichtigen Teilprozess bei der Verhüttung von Eisenerz im Hochofen dar.
Siehe auch
Weblinks
- Video: Berechnung des BOUDOUARD Gleichgewichts für verschiedene Temperaturen. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15706.
Quellen
- David R. Lide: CRC Handbook of Chemistry and Physics. 90. Auflage. Taylor & Francis, 2009, ISBN 978-1-4200-9084-0.
- Referenzdaten für Bildungsenthalpien finden sich im CRC Handbook of Chemistry and Physics: STANDARD THERMODYNAMIC PROPERTIES OF CHEMICAL SUBSTANCES (Memento vom 25. Februar 2015 im Internet Archive) (Kapitel 5.4) sowie Benson-Methode