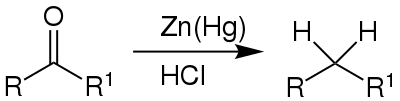
Clemmensen-Reduktion
Die Clemmensen-Reduktion ist eine Reaktion aus dem Bereich der Organischen Chemie. Sie wurde nach ihrem Entdecker Erik Christian Clemmensen benannt, der sie 1913 erstmals in einer Veröffentlichung beschrieb. Mithilfe dieser Reaktion können Ketone und Aldehyde durch Umsetzung mit amalgamiertem Zink in Salzsäure zu den zugrundeliegenden Alkanen reduziert werden.[1]
Mechanismus
Im Allgemeinen wird so vorgegangen, dass in einem ersten Schritt das Zink mit Quecksilbersalzen amalgamiert und mit Salzsäure gewaschen wird, um eine oxidische Passivierung zu entfernen. Dann wird mit frischer konzentrierter Salzsäure versetzt und in der Siedehitze die Carbonylkomponente zugegeben. Typische Reaktionszeiten liegen bei über 20 Stunden.
Als Substrate dienen Aldehyde, aliphatische Ketone und araliphatische Ketone (mit einem aliphatischen und einem aromatischen Rest), wobei Diarylketone im Allgemeinen schlecht reagieren[2] Die Clemmensen-Reduktion ist eher für niedermolekulare Verbindungen geringer sterischer Hinderung geeignet. Eine Variante verwendet aktiviertes Zink in einer auf 0 °C gekühlten etherischen Lösung, in welche Chlorwasserstoff-Gas geleitet wird. Beide Varianten sind naturgemäß beschränkt auf säurestabile Verbindungen. Acyloine und α,β-ungesättigte Carbonylverbindungen sind ungeeignete Substrate. Komplementär ist die Wolff-Kishner-Reaktion, die wiederum für basenstabile Verbindungen geeignet ist.
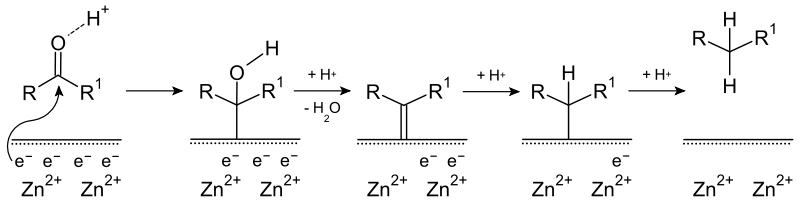
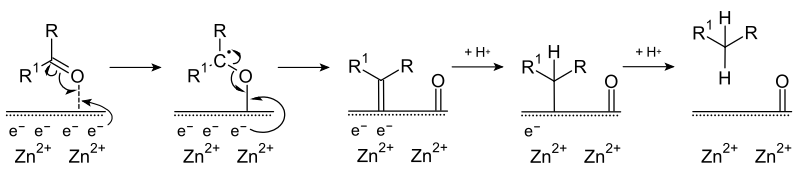
Der Mechanismus ist nicht abschließend gesichert. Es werden zwei Mechanismen diskutiert. Sicher ist:
- Die Reaktion verläuft an der Metalloberfläche.
- Die Reaktion verläuft nicht über den freien Alkohol, da ein solcher Alkohol, der als Substrat absichtlich zugesetzt wird, nicht reduziert werden kann.
- Es handelt sich um einen wiederholten Ein-Elektron-Transfer (engl.: single electron transfer = SET), in dessen Verlauf ein Zink-Carben-Komplex entsteht.
Mechanismus 1: Durch die Säure wird der Sauerstoff der Carbonylgruppe protoniert. Dann wird unter Elektronentransfer eine Zink-Kohlenstoff-Bindung ausgebildet. Nach erneuter Protonierung und Elektronentransfer wird Wasser abgespalten und der Zink-Carben-Komplex gebildet. Durch zweimalige Protonierung und zweimaligen Elektronentransfer wird der Kohlenwasserstoff freigesetzt.
Mechanismus 2: Es wird ein Elektron auf den Carbonylkohlenstoff übertragen. Dadurch bildet sich eine Sauerstoff-Zink-Bindung aus und gleichzeitig entsteht ein Kohlenstoff-Radikal-Anion. Durch zweimaligen Elektronentransfer wird der Sauerstoff auf das Zink übertragen und ein Kohlenstoff-Zink-Carben gebildet. Dann wird wie oben durch Protonierung und Elektronentransfer der Kohlenwasserstoff freigesetzt.
In beiden Fällen wird (hier nicht dargestellt) die entsprechende Menge Zink in Form von Zinkchlorid freigesetzt.
Siehe auch
Einzelnachweise
- Erik Clemmensen: Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure. In: Berichte der deutschen chemischen Gesellschaft. 46, Nr. 2, 1913, S. 1837–1843, doi:10.1002/cber.19130460292
- Heinz G. O. Becker, Rainer Beckert, Günter Domschke, Egon Fanghänel, Wolf D. Habicher, Peter Metz, Dietrich Pavel, Klaus Schwetlick: Organikum, 21. Auflage, Wiley-VCH, Weinheim, 2001, S. 590.