α-Carboanhydrasen
Die α-Carboanhydrasen (Abkürzung α-CA) sind Enzyme, die die Hydratisierung von Kohlenstoffdioxid (CO2) zu Kohlensäure (H2CO3) und umgekehrt katalysieren. Sie kommen in Tieren, Pflanzen, Bakterien und Grünalgen vor. Kohlenstoffdioxid lässt sich im Körper leichter in Form von Hydrogencarbonat transportieren, daher ist eine reversible Umwandlung sinnvoll. Außerdem wird über die Reaktion der pH-Wert des Blutplasmas und der Magensäure geregelt. Bei Tieren sind elf paraloge Isoformen des Enzyms bekannt, sowie vier weitere ohne Enzymaktivität.[1][2]
| Α-Carboanhydrasen | ||
|---|---|---|
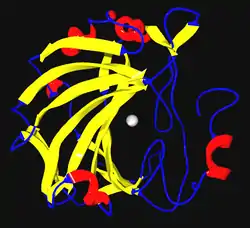
| ||
| Bändermodell der CA2, Zink im Zentrum, nach PDB 1MOO | ||
| Kofaktor | Zink | |
| Bezeichner | ||
| Gen-Name(n) | CA1, CA2, CA3, CA4, CA5A, CA5B, CA6, CA7, CA9, CA12, CA13, CA14 | |
| Enzymklassifikation | ||
| EC, Kategorie | 4.2.1.1, Lyase | |
| Reaktionsart | (De-)Hydratisierung | |
| Substrat | Kohlenstoffdioxid + Wasser | |
| Produkte | Hydrogencarbonat + Wasserstoffion | |
Die elf Isoformen werden nach Lokalisation unterteilt in:
- zytosolisch (CA-I, CA-II, CA-III, CA-VII, CA-XIII)
- mitochondriell (CA-VA, CA-VB)
- sezerniert (CA-VI)
- membran-assoziiert (CA-IV, CA-IX, CA-XII, CA-XIV)
Das Enzym wurde 1932 etwa gleichzeitig von William Christopher Stadie (1886–1959) und Helen O'Brien in den USA und Norman Urquhart Meldrum (1907–1933) und Francis John Worsley Roughton (1899–1972) in Großbritannien entdeckt.[3]
Katalysiertes Gleichgewicht
Kohlenstoffdioxid wird zu Kohlensäure hydratisiert und umgekehrt. Kohlensäure dissoziiert in wässrigen Lösungen zu Hydrogencarbonat und einem Proton:
Carboanhydrase ist ein Enzym, das diese Reaktion sehr schnell katalysiert: Sie kann bis zu 106 Moleküle Kohlenstoffdioxid pro Sekunde hydratisieren und beschleunigt die Reaktion auf das 107-fache. Ihr kcat-Wert liegt bei 1.000.000 pro Sekunde.[4] Die Michaelis-Konstante Km beträgt dabei 0,012 M.
Für die Rückreaktion ist kcat-Wert=400.000 pro Sekunde und Km=0,026 M.
Aufbau
CA wurde als erstes Enzym entdeckt, das in seinem aktiven Zentrum ein Metall als Cofaktor benötigt. Das Protein enthält als Cofaktor ein Zink-Ion, welches die eigentliche katalytische Aktivität des Enzyms bedingt. Es ist an drei Imidazolreste der Aminosäure Histidin gebunden. Die vierte Koordinationsstelle ist von einem Hydroxo-Liganden besetzt.
In seltenen Fällen ist Cadmium als Cofaktor im aktiven Zentrum des Enzyms gebunden (z. B. bei Thalassioria weissflogii[5]).
Funktionen im Organismus
Atmung
Bei der Atmung fällt Kohlenstoffdioxid (CO2) als Stoffwechselendprodukt an. Kohlenstoffdioxid wird ins Blut freigesetzt und muss zu den Lungen (bei komplexen Organismen) transportiert werden. In wässrigen Lösungen, wie z. B. im Blut oder im Zytoplasma, reagiert CO2 indes mit Wasser zu Hydrogencarbonat. Obwohl diese Reaktionen auch ohne Katalysator spontan ablaufen, finden sich Carboanhydrasen in fast allen Organismen. Ob CO2 aufgenommen bzw. abgegeben wird, hängt vom pH-Wert des Zellplasmas ab. Im tierischen Organismus ist CA in Erythrozyten (roten Blutzellen) zu finden, wo sie am Kohlenstoffdioxidtransport beteiligt ist. Kohlenstoffdioxid diffundiert in den Kapillaren in die Erythrozyten, wird dort mit Wasser zu Kohlensäure umgesetzt und reagiert schließlich zu Hydrogencarbonationen und Protonen. Das Hydrogencarbonat wird im sogenannten Hamburger-Shift gegen Chlorid aus dem Plasma ausgetauscht, um die Elektroneutralität zu wahren.
Auge
Im Ziliarkörper des Auges ist die Carboanhydrase CA_IV ein Schlüsselenzym für die Produktion des Kammerwassers. Eine zu starke Produktion oder ein gestörter Abfluss des Kammerwassers wird als eine der pathogenetischen Grundlagen des Glaukoms angesehen. Die medikamentöse Hemmung der Carboanhydrase mit Wirkstoffen wie Dorzolamid oder Azetazolamid ist daher heute eine bewährte Option in der Glaukomtherapie.[6] Mutationen am CA4-Gen können zu einer Form der Retinitis pigmentosa (RP17) führen.
Nierenfunktion
CA ist unter anderem entscheidend für die Regulation des Säure-Base-Haushaltes durch die Niere. Für diese Regulation ist wichtig, dass im Primärharn filtriertes Hydrogencarbonat zu etwa 90 Prozent rückresorbiert wird. Andernfalls entstünde eine Azidose. Ohne die CA würde die Hydrogencarbonat-Rückresorption aus dem Primärharn nicht funktionieren. Der Mechanismus: Aus den proximalen Tubuluszellen der Niere werden von intrazellulär nach extrazellulär (in das Lumen des Nierentubulus) Protonen (H+) im Austausch gegen Na+ ausgeschieden. Durch die Wirkung der CA reagiert filtriertes Hydrogencarbonat mit Protonen zu Kohlensäure, diese dann zu Wasser und Kohlenstoffdioxid. Das Kohlenstoffdioxid kann (im Unterschied zum Hydrogencarbonat) leicht durch die Zellmembran vom Tubuluslumen (Primärharn) in die Tubuluszelle gelangen. Dort katalysiert die intrazelluläre CA die umgekehrte Reaktion. Aus dem Kohlenstoffdioxid werden so in der Tubuluszelle Protonen und Hydrogencarbonat gebildet. Das Hydrogencarbonat wird aus der Zelle ins Blut abgegeben, das Proton steht erneut für die gleiche Reaktion zur Verfügung. Gehemmt werden kann die Carboanhydrase durch das Medikament Acetazolamid. Die Hemmung führt zu Bicarbonatverlust über den Harn und somit zu einer Azidose. Dies kann zur Behandlung von metabolischen Alkalosen eingesetzt werden.
Magenfunktion
Sie ist das Schlüsselenzym für die Produktion der Magensäure. Die Carboanhydrase befindet sich in den Belegzellen (Parietalzellen) des Magenepithels. Protonen werden an der apikalen Membran der Epithelzelle durch eine Protonen-Kalium-ATPase (V-ATPase) in das Magenlumen transportiert. Dabei wird Kalium im Austausch in die Zelle transportiert. In der Zelle stellt die CA Protonen und Bicarbonat aus Wasser und Kohlenstoffdioxid her. An der basolateralen Membran wird Bicarbonat daraufhin im Austausch gegen Chlorid aus der Zelle in das Blutgefäßsystem gebracht. Das Chlorid gelangt an der apikalen Membran durch einen Chloridkanal in das Magenlumen und bildet dort mit den Protonen die Magensäure.
Die V-ATPase und Carboanhydrase in den Belegzellen des Magens wird durch Protonenpumpenhemmer wie z. B. Omeprazol oder Pantoprazol gehemmt.[7]
Bauchspeicheldrüse
In der Bauchspeicheldrüse dient die Carboanhydrase der Hydrogencarbonat-Sekretion.
Nebenwirkungen von Medikamenten
Die heute nur noch selten verwendeten Sulfonamide hemmen ebenfalls die Carboanhydrase.
Pflanzen
Bei Pflanzen wird Kohlenstoffdioxid für die Photosynthese benötigt und dafür durch die Spaltöffnungen der Blätter aufgenommen. Dieses gelangt schließlich in die Thylakoide und wird im Zuge der Photosynthese zu Glucose umgesetzt. Pflanzen mit Crassulaceen-Säurestoffwechsel und C4-Stoffwechsel benötigen Carboanhydrasen, damit das im Cytosol gelöste Kohlenstoffdioxid schneller zu Hydrogencarbonat (HCO3−) umgesetzt wird. HCO3− wird als Substrat von einem anderen Enzym verwendet und dient als erste, vorläufige Kohlenstoffdioxidfixierung.
Weitere Funktionen
Bei Süßwasserfischen ermöglicht die Carboanhydrase in darauf spezialisierten Zellen des Kiemenepithels die Salzresorption und dient damit der Osmoregulation.
Reaktionsmechanismus der Carboanhydrase
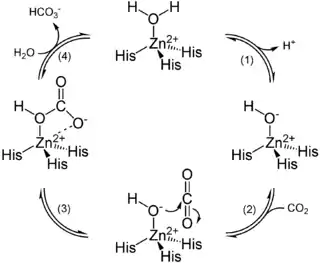
- An das Zink(II) Ion, welches an die drei Stickstoffdonorzentren des Imidazolringes der drei Histidin-Aminosäuren koordiniert ist, kann sich ein Molekül Wasser anlagern. Infolge der Koordination an das Zinkion wird der pKs Wert des Wassermoleküls gesenkt – so weit, dass auch bei dem physiologischen pH-Wert, wie er in der Umgebung der Carboanhydrase zu finden ist, ein Proton abgespalten werden kann (1).
- Dabei ist die am Sauerstoff zurückbleibende negative Ladung mesomeristabilisiert, da sie auf das Zink(II)ion übertragen werden kann.
- In einem nächsten Schritt (2) lagert sich ein Molekül Kohlenstoffdioxid im aktiven Zentrum des Enzyms so an, dass es mit dem Hydroxidion reagieren kann.
- Die freien Elektronenpaare am Sauerstoff der OH-Gruppe greifen nukleophil das Kohlenstoffdioxidmolekül an, so dass ein Hydrogencarbonation entsteht (3)
- Schließlich kann ein Wassermolekül an das aktive Zentrum gebunden werden, so dass das Hydrogencarbonation freigesetzt wird (4).
Durch diese Regenerierung des aktiven Zentrums kann ein neuer Zyklus beginnen.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6.
Einzelnachweise
- PROSITE documentation PDOC00146. Swiss Institute of Bioinformatics (SIB), abgerufen im Jahr 2011 (englisch).
- Interpro: Carboanhydrasen
- Derek Lowe, Das Chemiebuch, Librero 2017, S. 288
- Reginald Garrett, Charles M. Grisham: Biochemistry. (International Student Edition). 4. Auflage. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2, S. 394.
- T.W. Lane, F.M. Morel: A biological function for cadmium in marine diatoms. In: Proc. Natl. Acad. Sci. U.S.A.. 97, Nr. 9, April 2000, S. 4627–4631. doi:10.1073/pnas.090091397. PMID 10781068. PMC 18283 (freier Volltext).
- Norbert Pfeiffer: Glaukom. Thieme Verlag, Stuttgart 2001, S. 87–99.
- I. Puscas, M. Coltau, M. Baican, G. Domuta: Omeprazole has a dual mechanism of action: it inhibits both H(+)K(+)ATPase and gastric mucosa carbonic anhydrase enzyme in humans (in vitro and in vivo experiments). In: J. Pharmacol. Exp. Ther.. 290, Nr. 2, August 1999, S. 530–534. PMID 10411559.
Weblinks
- Jennifer McDowall/ Interpro: Protein Of The Month: Carbonic Anhydrase. (engl.)