Zinkhütte
Unter einer Zinkhütte, also einem Hüttenwerk für die Zinkerzeugung, versteht man einen Industriebetrieb zur Gewinnung von metallischem Zink. Die dafür genutzten Rohstoffe können sowohl Primärrohstoffe, also Erze, als auch Sekundärrohstoffe wie Recyclingmaterialien, zinkhaltige Abfälle, Schlacken etc. sein. Der Ausdruck Hütte umfasst dabei die Gesamtheit aller Maschinen, Einrichtungen, Apparate und Anlagen, einschließlich der Gebäude und des Grundstückes. In Deutschland erzeugt nur noch eine einzige Hütte, die Nordenhamer Zinkhütte GmbH in Nordenham, Zinkmetall aus Erzen.


Die Geschichte der Zinkverhüttung
Obwohl das Zink unter den Metallen in relativ großen Mengen in der Erdkruste vorkommt, war es in der technischen Anwendung als reines Metall lange unbekannt. Dieses lag vor allem daran, dass die übliche Metallgewinnung durch die karbothermische Reduktion beim Zink schwierig ist. Bei den Reduktionstemperaturen von über 1000 °C liegt es bereits dampfförmig vor (Siedepunkt 907 °C). Das unedle Metall lässt sich aus der Gasphase nur schwierig ohne Rückoxidation niederschlagen.
In Indien konnte eine Gewinnung von Zink in größeren Mengen für das 13./14. Jahrhundert, in China für das 17. Jahrhundert nachgewiesen werden. Durch die Handelsseefahrt gelangte es in die Raritätenkabinette der Herrschaftshäuser in Europa.
In den mitteleuropäischen Montanzentren (z. B. Harz) war Zink ein Zufallsprodukt. Beim Schmelzen von Blei im Holzkohlenschachtofen kondensierte in geringeren Mengen Zink am kühleren oberen Teil des Ofenschachtes. Zink ist häufig mit Blei in den Erzen vergesellschaftet. Der Name des Metalls soll auch von den Zinken, die sich als Ansätze in Öfen bildeten, herrühren. Durch den Einbau einer Schieferplatte, dem Zinkstuhl, wurde schließlich erstmals systematisch Zink im 16. Jahrhundert gewonnen.
Älter ist dagegen die Nutzung des Zinks als Legierungsbestandteil von Kupferlegierungen (Messing): Da die Aktivität des Zinks in einer Schmelze mit anderen Metallen zurückgeht, gelang schon 1400–1000 vor Christus im Nahen Osten die Herstellung von Messing mit bis zu 23 % Zink. In der frühen Neuzeit schmolz man diese Legierung in Mitteleuropa aus karbonatischen Ofenansätzen (Ofengalmei) und Kupfer.
Im größeren Maßstab gelang die Zinkverhüttung nach erfolgreichen Versuchen des Hütteningenieurs Ruberg auf der Wessola-Hütte in Oberschlesien 1798 bis 1800. Die ersten reinen Zinkhütten entstanden neben denen in Oberschlesien im 19. Jahrhundert in Belgien und im Stolberg-Eschweiler Raum.
Zinkhütten wurden meistens wie andere Metallhütten entweder in der Nähe von Zinkerzlagerstätten (z. B. Stolberg, Harz), an verkehrsgünstiger Lage (z. B. Nordenham) und/oder in der Nähe von Zentren des Steinkohlenbergbaus (Ruhrgebiet) errichtet.
Zink eignete sich wegen des niedrigen Schmelzpunktes von 419 °C besonders für gegossene Gebrauchsgegenstände (z. B. Töpfe, Armaturen) und ließ sich gut zu Blechen walzen. Weiterhin wurde es in der Messingherstellung verwendet. Im 20. Jahrhundert entdeckte man die besondere Eignung des Zinks für aktive Korrosionsschutzüberzüge auf Stahl-/Eisenwerkstoffen. Infolgedessen stieg die Zinkverhüttung erheblich an.
Die Verfahren der industriellen Zinkverhüttung
Zink kommt in der Natur nie in reiner Form vor, sondern ist an Sauerstoff, Schwefel und/oder Kieselsäure in Zinkmineralen gebunden. Erst durch die chemische Abtrennung des Zinks in den Hüttenprozessen erhält man ein Metall, das für die Weiterverarbeitung bzw. technische Anwendung geeignet ist.
Die wichtigsten Zinkminerale
| Name | Chemische Formel | Zinkgehalt in % |
|---|---|---|
| Zinkblende | ZnS | 67 |
| Marmarit | (Zn, Fe)S | 45 |
| Smithsonit (Zinkspat, Galmei) | ZnCO3 | 52 |
| Hemimorphit (Kieselgalmei) | Zn2SiO4 * H2O | 54 |
| Willemit | Zn2SiO4 | 58 |
| Zinkit (Rotzinkerz) | ZnO | 80 |
In den aus natürlichen Lagerstätten stammenden Erzen sind in der Regel nur 4 bis 20 % Zink enthalten. Nach einer nassmechanischen Aufbereitung (Flotation) erhält man Konzentrate von 45 bis 60 % Zinkgehalt. Blei- und Zinkerze kommen sehr häufig zusammen vor. Da beide Metalle in der Flotation nur ungenügend voneinander trennbar sind, erhält man jeweilige Mischkonzentrate. So dienen Schlacken aus der Bleiverhüttung nach entsprechender Vorbehandlung nicht selten auch als Rohstoff für die Zinkgewinnung.
Vorbereitung der Erze (Rösten)
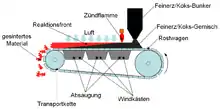
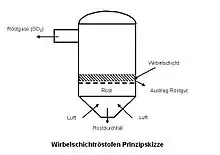
Alle bekannten Zinkhüttenverfahren setzen eine Vorbehandlung der Erzkonzentrate voraus. Sulfidische Zinkerze werden durch Rösten entschwefelt, karbonatische werden gebrannt (kalziniert) um das Kohlenstoffdioxid zu entfernen. In der Regel werden Stückerze auf Sinterbändern (Dwight-Lloyd-Verfahren) geröstet, Feinerze in Wirbelschichtröstöfen. Etagen- oder Handfortschaufelungsöfen sind veraltete Apparate, die in den letzten Jahrzehnten nicht mehr angewendet worden sind. Beim Rösten wird der Schwefel als Schwefeldioxid verflüchtigt, an seine Stelle tritt Luftsauerstoff:
Aus Schwefeldioxid entsteht in einem katalytischen Prozess als Nebenprodukt Schwefelsäure.
Das Brennen von Galmei erfolgte in Schachtöfen oder Drehrohröfen:
Sekundäre Zinkvorstoffe
Unter sekundären Vorstoffen versteht man Zwischenprodukte, Rest- und Abfallstoffe, die aufgrund ihres Metallinhaltes eine wirtschaftliche Metallgewinnung erlauben. Gerade in den letzten Jahrzehnten hat die Wertstoffrückgewinnung aus solchen Materialien an Bedeutung zugenommen. Dieses liegt vor allem daran, dass der Gehalt des nutzbaren Metalls in den meisten Fällen den von natürlichen Erzen übersteigt und häufig eine weitere Aufbereitung vor der Verhüttung nicht erforderlich ist. Darüber hinaus schreiben stetig schärfere Umweltgesetze ein Recycling zur Einsparung von Energie und Rohstoffen, sowie zur Vermeidung gewässer- und bodenschädlicher Deponierung vor.
Beim Zink sind die wesentlichsten Sekundärvorstoffe:
- Metallische Schrotte, wie Dachrinnen, Zinkplatten oder Druckgusserzeugnisse.
- Oberschlacken. Diese bestehen aus einer intermetallischen Verbindung zwischen Zink und Eisen (Hartzink) und fallen bei der kontinuierlichen Bandverzinkung an.
- Zinkhaltige Schlacken aus der Gewinnung anderer Metalle, insbesondere von Blei oder von Zink selbst (Räumaschen).
- Krätzen, Trass oder andere oxidische Zinkrückstände, die durch die Oberflächenoxidation von Zinkschmelzen bei der Feuerverzinkung, beim Umschmelzen oder der Zinkgewinnung anfallen.
- Galvanikschlämme oder Rückstände aus der Abwasserbehandlung von Zink verarbeitenden Betrieben.
- Stahlwerksflugstäube, Kupolofenstäube und Hochofengichtstäube. In die Eisenmetallurgie gelangt das Zink durch den hohen Anteil von verzinktem Schrott, teils auch durch Fremdeintrag von Druckgussteilen aus dem Automobilrecycling. Durch die vorherrschenden Temperaturen wird es in den Filterstaub überführt.
Die metallischen Sekundärvorstoffe Schrott und Oberschlacke werden direkt in der Zinkhütte eingesetzt und gegebenenfalls vorher zerkleinert oder paketiert, damit sie in die metallurgischen Apparate passen. In der Regel reicht ein einfaches Umschmelzen mit anschließender Raffination (siehe unten).
Schlacken werden überwiegend flüssig durch Einblasen von Luftsauerstoff und Koks behandelt (Anaconda-Verfahren). Dabei entsteht ein zinkoxidreicher Staub. Räumaschen wurden früher im Drehrohrofen oder in Schachtöfen angereichert. Dieses ist aber heutzutage nicht mehr wirtschaftlich, bzw. es werden keine Räumaschen mehr erzeugt.
Ist der Zinkgehalt hoch genug (30 bis 40 %), werden Krätzen, Trass und Flugstäube direkt in die Zinkverhüttungsprozesse eingeschleust. Bei hohen Chlorgehalten (z. B. durch die Beizrückstände beim Verzinken) ist eine vorherige Behandlung notwendig. Bis in die 1980er Jahre wurde diese im Drehrohrofen durchgeführt, wo der Chloranteil verflüchtigt und in einem Nasswäscher mit anschließender Sodafällung aufgefangen wurde. In den letzten Jahrzehnten wird hierzu eine Nassbehandlung (Laugung) mit erwärmter Sodalösung angewendet.
Für ärmere oxidische Zinkvorstoffe, vor allem Stahlwerksflugstaub hat sich das Wälzverfahren durchgesetzt. Eine geringere Bedeutung haben wegen des hohen apparativen Aufwandes und Energiebedarfes das Contop®-Verfahren im Zyklonofen und das Scan-Dust-Verfahren im Plasmaofen.
Pyrometallurgische Zinkhüttenverfahren
Das Grundprinzip der pyrometallurgischen Zinkgewinnung beruht auf der Reduktion von Zinkoxid durch Kohlenstoffmonoxid. Das Kohlenstoffmonoxid entsteht bei der Verbrennung von Kohlenstoffträgern zu Kohlenstoffdioxid nach dem Boudouard-Gleichgewicht.
-
- Reduktion des Zinks
-
- Boudouard-Gleichgewicht
Die Zinkverhüttung in der liegenden Muffel
Nach dem Liegenden-Muffel-Verfahren wurde metallisches Zink aus Röstblende, entschwefeltem (= oxidischem) Zinkerz oder Galmei hergestellt. Es handelte sich um das älteste industrielle Verfahren und wurde vom Beginn des 19. Jahrhunderts bis zuletzt Anfang der 1970er Jahre angewendet und stetig verbessert. Die Zinkvorstoffe wurden zusammen mit Stückkoks in rund 2 m lange Muffeln eingefüllt. Es handelte sich dabei um einseitig verschlossene Röhren aus Ton mit ovalem Querschnitt. Die Muffeln hatten einen Inhalt von 68 bis 110 Liter. Sie wurden indirekt in Einheiten von 120 bis 132 Stück leicht geneigt liegend in einem Ofengehäuse bei ca. 1400 °C mit Gas beheizt. Die letzten Hütten nach diesem Verfahren verfügten über 20 derartige Öfen und hatten eine Kapazität von rund 60.000 Tonnen Zink pro Jahr. Das Zink entstand dampfförmig und wurde in einer Vorlage kondensiert. Von dort wurde es etwa ein Mal pro Schicht in Transportpfannen abgestochen. Dem Kondensator nachgeschaltet war die Düte oder Allonge. Dort wurde Zinkstaub abgeschieden, der verfahrenstechnisch durch Rückoxidation entstand. Der in der Muffel zurückbleibende Rückstand, die Räumasche, musste periodisch (ca. alle 24 Stunden) ausgeräumt werden. Dabei erfolgte auch eine erneute Beladung mit Vorstoffen. Dazu wurde die Vorlage abgebaut (= Zinkmanöver).
Die Arbeit an den Zinköfen war bei der extremen Hitze für heutige Verhältnisse unvorstellbar schwer. In den letzten Jahren standen für das Beladen und Räumen der Muffeln Maschinen zur Verfügung, was die Arbeit erleichterte. Zu der eigentlichen Zinkhütte gehörte an einigen Standorten eine sogenannte Mufflerie, in der die Muffeln selbst produziert wurden. Der hohe apparative und Arbeitsaufwand, sowie der hohe spezifische Energieverbrauch in Verbindung mit einem geringen Ausbringen von Zinkmetall von nur etwa 60 % bei gleichzeitig hoher Umweltbelastung führte zum Aussterben dieses Verfahrens. Die letzten Betriebe in Deutschland wurden zu Beginn der 1970er Jahre stillgelegt.
Die Zinkverhüttung in der stehenden Muffel
_-de.svg.png.webp)
Das Stehende-Muffel-Verfahren, nach der ersten Anwendung auch New-Jersey-Vertical-Retort-Verfahren genannt, war eine konsequente Weiterentwicklung der Liegenden Muffel. In einem Ofengehäuse stand nun senkrecht eine einzelne Muffel mit wesentlich größeren Abmessungen von rund 8 m Höhe und einem flachen Querschnitt von 2,6 m × 0,3 m. Erst die Verfügbarkeit eines geeigneten Werkstoffes in Form von Siliziumkarbid machte die Entwicklung von großen Muffeln möglich. Durch die vertikale Anordnung konnte die Muffel von oben beschickt werden und die Schwerkraft zum Austrag der Räumasche am Fuß der Retorte genutzt werden. Die oberen 2 m waren nicht beheizt und dienten als Rückflusskühler für das unerwünschte Blei. Die Möllerung bestand aus Briketts, die aus zinkhaltigen Vorstoffen (Röstblende, Galmei oder zinkhaltige Recyclingmaterialien) und Koks zusammengesetzt waren. Vor dem Einsatz wurden die Briketts in speziellen Öfen verkokt. Dieses machte sie zum einen standfester und porös, was für die Reaktion Feststoff-Gas günstiger ist, zum anderen wurden sie vorgewärmt. Der in der Muffel entstehende Zinkdampf wurde in einem Kondensator niedergeschlagen. Der Kondensator war mit einem Schrägkanal mit der eigentlichen Muffel verbunden. Die modernere Variante des Kondensators, der Sprühkondensor, bestand aus einem geschlossenen Zinkbad, das durch Wasserkühlung auf etwa 500 °C gehalten wurde. In dieses Bad tauchte ein Schleuderrad, der sogenannte Impeller ein. Durch seine Rotation wurde flüssiges Zink vernebelt, an dem der Zinkdampf gut ohne Rückoxidation kondensieren konnte.
Auf den Zinkhütten standen die Öfen in Reihen von 20 bis 40 Stück.
Das Verfahren wurde letztmals in Europa auf der Zinkhütte Harlingerode im Jahr 2000 angewendet und ist heutzutage technisch überholt. Ein wesentliches Umweltproblem stellten die schwierig zu verwertenden bleihaltigen Räumaschen-Rückstände dar.
Das Imperial-Smelting-Verfahren
Beim Imperial-Smelting-Verfahren, kurz IS-Ofen, handelte es sich um einen Schachtofen, in dem durch die Einstellung definierter Ofenverhältnisse Zink und Blei gleichzeitig erzeugt werden konnte. Das Verfahren entstand in den 1950er Jahren und war einer der ersten Hüttenprozesse, der vollständig auf theoretischen Grundlagen entwickelt wurde. Der Schachtofen selbst ist ähnlich einem Eisenhochofen aufgebaut, nur in den Abmessungen deutlich kleiner. Über einen druckdichten Verschluss an der Ofengicht wird der Ofen von oben mit vorgewärmten Möller beschickt. Im unteren Drittel wird seitlich Heißwind mit 700 bis 950 °C eingeblasen. Diese Verbrennungsluft wird über Winderhitzer oder Cowper durch die hoch kohlenmonoxidhaltigen Ofengase aufgeheizt. Durch die Reaktion von Metalloxid mit Kohlenstoff bzw. Kohlenmonoxid entsteht Zinkdampf und flüssiges Blei. Während das Blei und die Schlacke periodisch abgestochen wird, wird der Zinkdampf in einem Kondensator durch Einsprühen von Flüssigblei niedergeschlagen. Dieses ist aus thermodynamischen Gründen nicht anders möglich, da sonst das Zink durch die Gichtgasatmosphäre rückoxidieren würde. Wegen der geringen Löslichkeit von Zink in Blei sind im Kondensator bis zu 400 t Blei im Umlauf, aus dem das Zink bei fallender Temperatur wieder abgeschieden wird (Seigerprozess).
Trotz des hohen apparativen Aufwandes hielt sich das Verfahren lange wegen der gleichzeitigen Bleigewinnung und einer guten Eignung für Sekundärrohstoffe. In Deutschland endete das IS-Verfahren mit der Insolvenz der Metallhütte Duisburg (MHD) 2005. Dort wurden in einem einzigen Ofen bis zu 100.000 t Zink und 30.000 t Blei im Jahr gewonnen.
Weitere seltenere pyrometallurgische Zinkhüttenverfahren
.svg.png.webp)
Hierbei handelt es sich um seltene oder einzeln angewandte Verfahren, die teilweise auch nicht mehr eingesetzt werden.
- Schnelle-Verfahren (Rotierende Retorte, innen- oder außenbeheizt)
- Josephstown-Verfahren (Elektrothermisches Verfahren der St. Joe Lead Co.)
- KIVCET-Verfahren (Zink und Blei gleichzeitig, elektrothermisch)
Die Erzeugung von Feinzink (Raffination)
Die Herstellung von Druckgusslegierungen auf der Basis von Zink und Kupfer erfordert ein besonders reines Zink von mindestens 99,99 %. Bereits kleinere Anteile von Blei und Cadmium führen zu einer interkristallinen Korrosion und damit zu einer Zerstörung des Werkstückes, auch Zinkpest genannt. Während bei der hydrometallurgischen Gewinnung von Zink keine weitere Raffination notwendig ist, musste pyrometallurgisch hergestelltes Hüttenzink einer Nachbehandlung unterzogen werden. Wegen der vergleichsweise geringen Siedepunkte von Zink und Cadmium war eine fraktionierte Destillation oder Rektifikation naheliegend. Dieses Verfahren wurde in den USA ebenfalls von der New Jersey Zinc. Co in Palmerton entwickelt und bestand aus zwei Stufen. In einem ersten Schritt (Bleisäule) wurde flüssiges Rohzink in das obere Drittel einer rund 15 m hohen Destillierkolonne aus Siliziumkarbidschüsseln eingeleitet. Die unteren 2/3 wurden indirekt durch Gas auf etwa 1100 °C beheizt, der obere Teil diente als Rückflusskühler. Am Fuß der Säule trat ein vermehrt bleihaltiges, cadmiumarmes Waschzink aus. Aus dem Waschzink erfolgte die Abtrennung der Verunreinigung durch Seigern in Form eines bleireichen Zink-Blei-Gemisches. Im Kondensator wird cadmiumreicheres Zink niedergeschlagen. Dieses Kondensat wurde einer zweiten Destilliersäule (Cadmiumsäule) zugeführt, deren Brennkammer auf 950 °C beheizt wurde. Der Rückflusskühler wurde auf Temperaturen zwischen 765 und 907 °C gehalten, um das cadmiumfreie Zink in der Säule zurückzuhalten und am Fuß abzuführen. Das mit Zink verunreinigte Cadmium fiel als Staub im Kondensator an.
In den 1990er Jahren kam es bei der Metaleurop S.A. in Noyelles-Godault in Frankreich infolge einer Überbeladung zum Zusammenbruch einer Zinkraffiniersäule. Die spontane Verbrennung des austretenden Zinkdampfes führte zur vollständigen Zerstörung der Anlage und kostete mehrere Mitarbeiter das Leben.
Um im Rohzink eventuell enthaltenes Arsen zu entfernen wurde anfänglich Aluminium eingerührt. Das dabei entstandene Aluminiumarsenid neigte aber schon beim Kontakt mit der Luftfeuchtigkeit zu Bildung des hochgiftigen Arsenwasserstoffgases. Daher verwendete man später Natrium unter Entstehung von Natriumarsenid. Dieses oxidiert zu ungefährlicherem Natriumarsenat.
Die hydrometallurgische Zinkgewinnung
Die hydrometallurgische Zinkgewinnung wurde in der Zeit des Ersten Weltkrieges entwickelt. Der erste Betrieb nach diesem Verfahren in Deutschland war die Zinkhütte Magdeburg der Firma Georg von Giesches Erben. Es dauerte dennoch bis in die 1960er und 1970er Jahre, bis sich die Elektrolyse als Zinkgewinnungsverfahren weltweit durchgesetzt hatte. Dieses hatte im Wesentlichen zwei Gründe:
- Die Verfügbarkeit großer Mengen an elektrischer Energie.
- Zink ist ein Metall mit hohem elektronegativen Potential (−0,763 V). An einer Kathode werden zunächst alle edleren Metalle, theoretisch auch der Wasserstoff der wässrigen Zellenlösung abgeschieden.
Die verfahrenstechnische Lösung dieser Probleme und der Ausbau der Stromnetze führten schließlich dazu, dass in den 1980er Jahren bereits über 80 % der Weltproduktion nach dem Zinkelektrolyseverfahren hergestellt wurden.
Grundprinzip der hydrometallurgischen Zinkgewinnung:
-
- Laugung
Dabei dissoziiert Zinksulfat in wässriger Lösung zu Zn2+ und SO42−.
-
- Elektrolyse
Laugung und Laugenreinigung
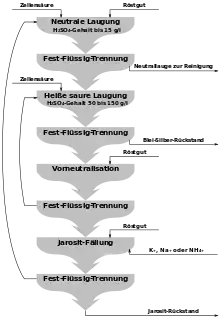
Während bei der pyrometallurgischen Metallerzeugung stets ein verunreinigtes Rohmetall erzeugt wird und in einem nachgeschalteten Raffinationsprozess die unerwünschten Begleitelemente abgeschieden werden, ist dieses bei der hydrometallurgischen Zinkgewinnung im Prinzip andersherum. Bei der Laugung mit Schwefelsäure wird gezielt Zink in Lösung gebracht und miterfasste Fremdmetalle wieder ausgefällt. Dazu müssen genau definierte Säurekonzentrationen in verschiedenen Prozessstufen eingestellt werden. Dieses war in der Anfangszeit noch nicht völlig beherrschbar, daher wurden bevorzugt reinere, insbesondere eisenarme Erzsorten eingesetzt. Die größte Menge der Erzkonzentrate auf dem Markt sind sulfidische Zinkerze (Zinkblende), die vor der Laugung entschwefelt/abgeröstet werden müssen, vergleiche Abschnitt Vorbereitung der Erze (Rösten). Dabei entstehen schwerlösliche Zinkferrite. Bei einer starken Laugung, d. h. hohen Schwefelsäurekonzentration geht viel störendes und schwierig zu fällendes Eisen in Lösung, bei einer schwachen Laugung ist der Zinkverlust groß (bis 20 %). Erst die Entdeckung der Jarositfällung machte ein hohes Zinkausbringen möglich. Dabei wird das Eisen nach der Laugung des Röstgutes durch Zugabe von Ammonium- oder Natriumsalzen in das Mineral Jarosit (NaFe33+[(OH)6|(SO4)2]) überführt und abgeschieden. Deponieprobleme mit dem schwermetallbelasteten Jarosit führten zu der Entwicklung neuerer Verfahren (Goethit- oder Hämatit-Verfahren), die ein recyclingfähiges Fällgut ermöglichen. Blei und Edelmetalle verbleiben beim Laugen im Rückstand d. h. werden nicht in Lösung gebracht und an entsprechende Hütten abgegeben.
Die Laugenreinigung d. h. die Entfernung mit in Lösung gegangener edlerer Metallionen erfolgt in der Regel durch Zementation mit Zink. Es wird metallischer Zinkstaub in mehreren Schritten zu dosiert und eingerührt. Die Metalle wie z. B. Kupfer, Cadmium oder Cobalt fallen nacheinander aus und können an jeweilige Hütten weiterverkauft werden. Die verschiedenen Laugungsschritte, Fällungen und Laugenreinigung werden in säurefest ausgekleideten Rührbehältern durchgeführt. Die erforderliche Fest-Flüssig-Trennung erfolgt nach Voreindickung auf Filterpressen.
Zinkelektrolyse
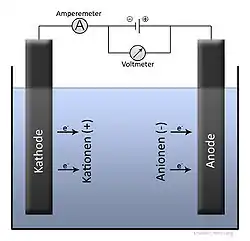
Bei der Zinkelektrolyse handelt es sich im Gegensatz zu der Kupferraffinationselektrolyse um eine sogenannte Gewinnungselektrolyse.
Nachdem die edleren Verunreinigungen aus der Lösung entfernt wurden, erfolgt der Einsatz in den Elektrolysebädern. Unedlere Kationen wie Na+, K+ oder Al3+ verbleiben bei der Elektrolyse in Lösung, erhöhen aber die Viskosität. Dieses verlangsamt die Diffusion im Bad. Der Eintrag wird daher bei der Vorstoffauswahl berücksichtigt. Theoretisch würde vor dem Zink der Wasserstoff abgeschieden, also der Elektrolyt zersetzt werden. Da aber Wasserstoff ein Gas ist und daher eine höhere Energie zur Keimbildung an der Kathode erforderlich ist, kommt es zu sogenannten Wasserstoffüberspannung. Die Bildung von Wasserstoff wird durch glatte Kathodenbleche erschwert, daher werden polierte Aluminiumbleche verwendet. Die Kathoden werden bereits nach 2 Tagen aus dem Bad genommen und auf Schälmaschinen vom abgeschiedenen Zink (=Strippen) befreit, damit die Zinkschicht nicht die Wasserstoffbildung vereinfacht. Weiterhin nimmt die Wasserstoffüberspannung mit steigender Temperatur ab, sodass niedrige Temperaturen günstiger wären. Das führt jedoch zu einer geringeren Leitfähigkeit und damit geringerer Stromausbeute. Als Kompromiss haben sich Badtemperaturen von 35 bis 40 °C herausgestellt. Durch die hohe Zellspannung erwärmt sich der Elektrolyt von selbst über diese Temperatur hinaus und muss gekühlt werden. Beim Kühlen fällt häufig Gips aus und verstopft die Leitungen und Armaturen, die daher oft gereinigt werden müssen.
Die Anoden bestehen aus gelochtem Bleiblech und der Abstand Anode-Kathode beträgt jeweils 90 mm. Die Kathodenbleche sind etwa 1 m × 1,3 m groß. Die Zellspannung liegt bei 3,3 - 3,5 V bei einer Stromdichte von 400 bis 600 A/m². Der spezifische Energieverbrauch liegt bei 50 GJ/ t Zink. Zum Vergleich:
- Stehende Muffel: 60 GJ/ t
- ISP-Verfahren: 40-45 GJ/ t
- Josephstown-Verfahren: 54 GJ/ t
Zinkhüttenstandorte in Deutschland
| Name | Bundesland | Ort | Bau/ Inbetrieb- nahme |
Stilllegung |
Angewendetes Verfahren | Anmerkungen/ Quellen | Bild |
|---|---|---|---|---|---|---|---|
| Bensberg-Gladbacher Zinkhütte | Nordrhein-Westfalen | Bergisch Gladbach | 1853 | 1931 | Liegende Muffel |  | |
| Zinkhütte Billwerder | Hamburg | Hamburg-Billwerder | 1905[1] | Liegende Muffel | |||
| Zinkhütte Birkengang oder Friedrich-Wilhelm-Hütte | Nordrhein-Westfalen | damals Eschweiler Ortsteil Birkengang | 1845 | 1926 | Liegende Muffel |  | |
| Zinkhütte Borbeck | Nordrhein-Westfalen | Essen Ortsteil Borbeck | 1847 | 1968 | Liegende Muffel | ||
| Ruhrzink Datteln | Nordrhein-Westfalen | Datteln | 1968 | 2008 | Zinkelektrolyse | ||
| Metallhütte Duisburg (MHD) | Nordrhein-Westfalen | Duisburg Ortsteil Wanheim | 1906 | 2005 | Imperial-Smelting-Verfahren | zuletzt Sudamin MHD GmbH | |
| Zinkhütte Harlingerode | Niedersachsen | Harlingerode | 1936 | 2000 | New-Jersey-Vertical-Retort-Verfahren |  | |
| Zinkhütte Magdeburg | Sachsen-Anhalt | Magdeburg | 1946 | Zinkelektrolyse | Erste Zinkelektrolyse in Deutschland, Betreiber Georg von Giesches Erben | ||
| Zinkhütte Mülheim an der Ruhr | Nordrhein-Westfalen | Mülheim an der Ruhr | 1845 | 1873 | Liegende Muffel | ||
| Zinkhütte Münsterbusch oder Heinrich-Hütte | Nordrhein-Westfalen | Stolberg Ortsteil Münsterbusch | 1834 | 1967 | Liegende Muffel | .JPG.webp) | |
| Zinkhütte Nievenheim | Nordrhein-Westfalen | Nievenheim | 1971 | Liegende Muffel | |||
| Zinkhütte Nordenham | Niedersachsen | Nordenham | 1908 | noch in Betrieb (2009) | bis 1972 Liegende Muffel, danach Zinkelektrolyse | gehört zum Unternehmen Glencore | |
| Norzinco GmbH (Harzer Zinkoxide) | Niedersachsen | Harlingerode | 2002 (1974) | noch in Betrieb (2009) | New-Jersey-Feinzinkdestillation | Vorgänger waren die VHZ (Heubach) und die HZO GmbH. Auf dem Gelände der Zinkhütte Harlingerode | |
| Zinkhütte Steinfurt | Nordrhein-Westfalen | damals Eschweiler Ortsteil Steinfurt | 1850 | Liegende Muffel |  | ||
| Zinkhütte Velau | Nordrhein-Westfalen | damals Eschweiler Ortsteil Velau | 1819 | vor 1922 | Liegende Muffel |
Siehe auch
Literatur
- Wolfgang Mehner: Geschichte der Zinkmetallurgie am Harz: eine Chronik der Zinkerzeugung von 1900-1990. 2. Auflage. Harz-Metall GmbH, Goslar 1995.
- Franz Pawlek: Metallhüttenkunde. Walter de Gruyter, Berlin 1982, ISBN 3-11-007458-3.
Weblinks
- Internetauftritt der Recylex Deutschland: Harz-Metall, Norzinco und Weser-Metall GmbH
- Homepage der Initiative Zink – Wissenswertes über Zinkgewinnung, -verarbeitung und -nutzung