Immunsystem
Als Immunsystem (von lateinisch immunis ‚unberührt, frei, rein‘) wird das biologische Abwehrsystem höherer Lebewesen bezeichnet, das Gewebeschädigungen durch Krankheitserreger verhindert. Dieses körpereigene Abwehrsystem entfernt in den Körper eingedrungene Mikroorganismen, fremde Substanzen und ist außerdem in der Lage, fehlerhaft gewordene körpereigene Zellen zu zerstören. Das Immunsystem ist ein komplexes Netzwerk aus verschiedenen Organen, Zelltypen und Molekülen und der zentrale Forschungsgegenstand der Immunologie.
Das Immunsystem hat eine große Bedeutung für die körperliche Unversehrtheit von Lebewesen, denn praktisch alle Organismen sind ständig den Einflüssen der Umwelt ausgesetzt; manche dieser Einflüsse stellen eine Bedrohung dar: Wenn schädliche Mikroorganismen in den Körper eindringen, kann dies zu Funktionsstörungen und Krankheiten führen. Typische Krankheitserreger sind Bakterien, Viren und Pilze sowie einzellige (z. B. Protozoen wie Plasmodien) beziehungsweise mehrzellige Parasiten (z. B. Bandwürmer).
Auch Veränderungen im Inneren des Körpers können die Existenz eines Lebewesens bedrohen: Wenn normale Körperzellen im Laufe der Zeit ihre gesunde Funktion verlieren, dann sterben sie meist ab und müssen abgebaut werden (Nekrose) oder bauen sich dabei selbst ab (Apoptose). In seltenen Fällen können sie auch krankhaft entarten und zur Entstehung von Krebs führen.
Alle Lebewesen verfügen daher über Schutzfunktionen. Schon einfache Organismen besitzen solche Abwehrmechanismen, die eine sogenannte angeborene Immunantwort vermitteln. Diese entstand bereits sehr früh in der Stammesgeschichte der Lebewesen und wurde seitdem weitgehend unverändert beibehalten. Die Wirbeltiere entwickelten zusätzlich eine adaptive Immunabwehr. Diese komplexe, anpassungsfähige Komponente des Immunsystems schützt noch effektiver als die angeborene Immunantwort vor Infektionskrankheiten.
Die pflanzliche Immunantwort hat Ähnlichkeiten mit der angeborenen Immunantwort bei Tieren. Pflanzen besitzen keine adaptive Immunantwort, also auch keine T-Zellen oder Antikörper.
Mechanische und biochemische Barrieren
Die mechanischen und biochemischen Barrieren und Abwehrmechanismen des Körpers sind die erste Verteidigungslinie gegen Krankheitserreger. Sie sorgen dafür, dass die Pathogene erst gar nicht in den Körper eindringen können oder ihn möglichst schnell wieder verlassen.
Sie sind nicht zur Immunantwort befähigt und daher auch kein Teil des Immunsystems.[1]
- Haut – äußere Schicht als Barriere, Talg, Schweiß und Normalflora als Wachstumsbremsen für pathogene Mikroorganismen
- Schleimhaut – Bindefunktion des Schleims
- Augen – Abtransportfunktion der Tränen, antimikrobielles Enzym Lysozym bekämpft Mikroorganismen
- Atemwege – Bindefunktion des Schleims, Abtransportfunktion der Flimmerhärchen
- Mundhöhle – antimikrobielles Enzym Lysozym im Speichel bekämpft Mikroorganismen
- Magen – Magensäure (die Salzsäure enthält) und Eiweiß abbauende Enzyme zerstören fast alle Bakterien und Mikroorganismen
- Darm – Infektabwehr durch anwesende Bakterien (Darmflora), Abtransportfunktion durch ständige Entleerung und das sogenannte darmassoziierte Immunsystem (Gut Associated Lymphoid Tissue, GALT) und antibakterielle Proteine
- Harntrakt – Abtransportfunktion durch ständige Harnausspülung sowie osmotische Effekte der hohen Harnstoffkonzentration.
Unspezifisches und spezifisches Immunsystem
Es gibt zwei verschiedene Mechanismen des Immunsystems, zum einen die angeborene und daher erregerunspezifische Abwehr, zum anderen die erworbene erregerspezifische Abwehr.
Angeborene oder unspezifische Immunabwehr
Schon sehr früh in der Stammesgeschichte der Lebewesen entwickelte sich die unspezifische oder angeborene Immunabwehr (engl. innate immunity). Dazu zählen anatomische und physiologische Barrieren wie Epithelien, aber auch zellvermittelte Gegenwehr durch Phagozytose, sowie allgemein entzündliche Reaktionen und das Komplementsystem. Die angeborene Immunantwort findet innerhalb von Minuten statt, ist aber durch die Erbinformation lebenslang festgelegt.
Adaptive oder spezifische Immunabwehr
Die spezifische oder adaptive Immunabwehr, früher auch „erworbenes Immunsystem“ genannt, entwickelte sich im Laufe der Stammesgeschichte der Wirbeltiere später als die angeborene Immunabwehr. Sie zeichnet sich durch die hohe Anpassungsfähigkeit gegenüber neuen oder veränderten Krankheitserregern aus, benötigt dafür aber deutlich längere Reaktionszeiten von bis zu 14 Tagen. Im Rahmen dieser Anpassung sind die Zellen der adaptiven Immunabwehr in der Lage, spezifische Strukturen (Antigene) der Angreifer zu erkennen und gezielt zelluläre Abwehrmechanismen und molekulare Antikörper zu bilden. Neben Antigenpräsentierenden Zellen (APC) wie Dendritischen Zellen stellen zwei Gruppen von Zellen die wesentlichen Elemente der adaptiven Immunität dar: Die T-Lymphozyten, welche zum einen die zellvermittelte Immunantwort gewährleisten und zum anderen die B-Lymphozyten unterstützen, sowie die B-Lymphozyten selbst, die für die humorale Immunität verantwortlich sind, also für jene Abwehrmaßnahmen, die sich über sezernierte Antikörper gegen Eindringlinge in den Körperflüssigkeiten (Humores) richten. Nach der Infektion bleiben spezifische Antikörper und Gedächtniszellen erhalten, um bei erneutem Kontakt mit dem Krankheitserreger binnen kurzer Zeit eine angemessene Abwehrreaktion zu ermöglichen.
Das adaptive Immunsystem ersetzt nicht das angeborene Immunsystem, sondern die verschiedenen Bestandteile des Immunsystems bedingen sich gegenseitig. Erst durch ein gut koordiniertes Zusammenspiel der angeborenen und adaptiven Immunabwehr wird die komplexe Immunreaktion des Körpers ermöglicht.[2]
Erst in den Jahren 2005–2007 wurde das CRISPR-Cas-System in vielen Bakterien und Archaeen entdeckt. Es ist ein vollständiges adaptives Immunsystem gegen Viren und mobile DNA.[3][4][5]
Bestandteile
Die Bestandteile des Immunsystems sind:
- Zellen, wie zum Beispiel Granulozyten, natürliche Killerzellen (NK-Zellen) oder T-Lymphozyten. Sie sind teilweise zu spezialisierten Organen (→ Lymphatisches System) zusammengefasst.
- Proteine, die als Botenstoffe oder zur Abwehr von Krankheitserregern dienen
- psychische Immunfaktoren.
Zelluläre Bestandteile
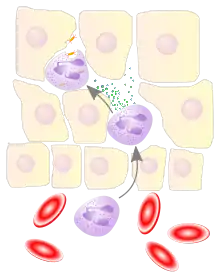
Die Zellen des Immunsystems zirkulieren in den Blutgefäßen und Lymphbahnen und kommen in den Geweben des Körpers vor. Dringt ein Krankheitserreger in den Körper ein, so können die Abwehrzellen ihn bekämpfen. Neutrophile Granulozyten, Monozyten/Makrophagen und dendritische Zellen können beispielsweise durch Aufnahme und Verdauung (Phagocytose) den Erreger selbst vernichten oder durch die Produktion von Immunmodulatoren und Zytokinen die Immunreaktion des Organismus steuern und andere Abwehrzellen zum Ort der Entzündung locken.
Granulozyten
Granulozyten (von lateinisch Granulum ‚Körnchen‘) machen den Großteil der weißen Blutkörperchen (Leukozyten) aus. Sie können die Blutbahn verlassen und ins Gewebe einwandern. Granulozyten haben in ihrem Zytoplasma zahlreiche Bläschen (Vesikel oder Granula genannt), die aggressive Stoffe enthalten, mit denen Krankheitserreger unschädlich gemacht werden können. Andere Stoffe (beispielsweise Histamin) spielen bei der Entzündungsreaktion und bei Allergien eine Rolle. Die unterschiedlichen Gruppen von Granulozyten werden nach ihrer Färbereaktion in der Giemsa-Färbung eingeteilt.
Die Neutrophilen Granulozyten (auch: Neutrophile) machen 40 bis 50 Prozent der zirkulierenden Leukozyten aus. Aktiviert durch Zytokine, die vom Ort der Infektion ausgesondert werden, wandern sie aus den Blutgefäßen in das betroffene Gewebe ein. Die Granula der Neutrophilen enthalten unter anderem saure Hydrolasen, Defensine (30 % des Inhalts), Myeloperoxidase und Proteasen, wie Elastase, Kollagenase, Neuraminidase und Cathepsin G. Dieser „Cocktail“ ermöglicht es den Neutrophilen, sich einen Weg durch das Gewebe zu bahnen und zu den Bakterien vorzudringen. Dort sind sie in der Lage, Krankheitserreger (beispielsweise Bakterien) unter anderem durch Phagozytose zu vernichten.
Eosinophile Granulozyten (auch: Eosinophile) machen etwa 3–5 Prozent der Zellen im Differentialblutbild aus. Ihren Namen beziehen sie vom Farbstoff Eosin, mit dem sie angefärbt werden können. Auch Eosinophile sind zur Chemotaxis befähigt, d. h., sie können sich in Richtung eines Entzündungsortes fortbewegen. Eosinophile enthalten in ihren Granula basische Proteine, zum Beispiel das Major Basic Protein, die sie nach Stimulation durch Antikörper der IgE-Klasse freisetzen. Eosinophile spielen eine wichtige Rolle bei der Parasitenabwehr; bei einem Befall mit Parasiten kommt es daher zu einer starken Vermehrung der Eosinophilen im Blut. Auch bei Allergien ist die Anzahl der Eosinophile im Blut erhöht, was darauf hinweist, dass die Eosinophilen auch bei dieser Erkrankung eine – wenig zuträgliche – Rolle spielen.
Basophile Granulozyten (auch: Basophile) besitzen zahlreiche grobe unregelmäßige Granula, die unter anderem Histamin und Heparin enthalten. Im Differentialblutbild machen sie nur einen geringen Anteil aus (< 2 Prozent). Wenn ihre Rezeptoren durch an IgE gebundene Allergene stimuliert werden, schütten Basophile toxische Mediatoren, wie Histamin und Plättchenaktivierenden Faktor (PAF) aus. Über die physiologische Bedeutung der Basophilen besteht aber weitgehend Unklarheit.
Makrophagen
Makrophagen (Riesenfresszellen) stellen ebenfalls einen Teil der Patrouille des Immunsystems dar. Makrophagen reifen aus Monozyten (einkernige weiße Blutkörperchen = mononukleäre Leukozyten) heran, welche die Blutbahn verlassen. Makrophagen halten sich im Gewebe auf, dort erkennen und fressen (phagozytieren) sie eingedrungene Erreger. Können die Erreger nicht durch die Makrophagen allein bekämpft werden, so können Makrophagen die adaptive Immunabwehr aktivieren. Dazu werden die aufgenommenen Teile der Erreger im Inneren der Makrophagen in einzelne Peptide (Epitope) zerlegt und durch MHC-II-Moleküle auf der Oberfläche präsentiert. Der Makrophage wird also zu einer Antigen-präsentierenden Zelle. Die Antigene können erst dadurch von T-Helferzellen erkannt werden, die daraufhin eine adaptive Immunantwort initiieren, die letztendlich zur Vernichtung des Erregers führt. Makrophagen spielen außerdem bei der Bekämpfung und Beseitigung von schädlichen Substanzen und Abfallprodukten (beispielsweise Teer aus Zigarettenrauch in der Lunge) eine entscheidende Rolle, weshalb sie gelegentlich auch als „Müllabfuhr des Körpers“ bezeichnet werden.
Natürliche Killerzellen
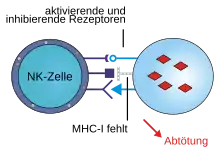
Die 1975 entdeckten Natürlichen Killerzellen (NK-Zellen) sind Teil der angeborenen Immunabwehr.[6] Obwohl NK-Zellen keine antigenspezifischen Rezeptoren auf ihrer Oberfläche tragen, werden sie zu den Lymphozyten gezählt, da sie eine gemeinsame Vorläuferzelle im Knochenmark haben.
NK-Zellen sind eine der ersten Verteidigungslinien im Kampf gegen Infektionen und Krebs, weil sie infizierte Zellen vernichten können, ohne vorher mit dem Krankheitserreger selbst in Kontakt gewesen zu sein. Sie verwenden dazu einen Mechanismus, der in den 1980er Jahren von dem schwedischen Immunologen Klas Kärre entdeckt wurde und als Fehlendes Selbst (englisch missing self) bezeichnet wird.[7] NK-Zellen erkennen unter anderem den MHC-I-Komplex, der auf nahezu allen gesunden Körperzellen vorkommt. Wird eine Zelle durch Viren infiziert oder wandelt sie sich in eine Tumorzelle um, so geht unter Umständen der MHC-I-Komplex auf der Oberfläche verloren. Das fein ausbalancierte Gleichgewicht von inhibierenden und aktivierenden Rezeptorsignalen wird dadurch zugunsten der NK-Zell-Aktivierung verschoben und die erkrankte Zelle fällt einer durch NK-Zellen ausgelösten Immunreaktion anheim.
Dendritische Zellen
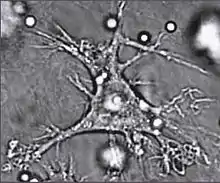
Dendritische Zellen sind Zellen des Immunsystems, die sich je nach Typ aus Monozyten oder Vorläufern der T-Zellen entwickeln. Sie nehmen als Fresszellen (Phagozyten) Krankheitserreger auf, wandern in den nächsten Lymphknoten, und stimulieren die adaptive Immunabwehr, indem sie die Antigene des zerlegten Erregers an ihrer Oberfläche den T-Lymphozyten präsentieren. Es genügt eine dendritische Zelle, um 100 bis 3.000 Antigen-spezifische T-Zellen zu aktivieren. Dies macht sie effizienter als z. B. Monozyten.[8] Dendritische Zellen sorgen auch für immunologische Toleranz gegenüber Selbstantigenen. Sie kommen vor allem in der Haut und in den Schleimhäuten vor.[9] Dendritische Zellen können auch mit B- und NK-Zellen interagieren.[10]
T-Lymphozyten
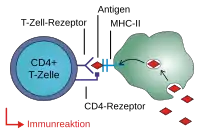
T-Lymphozyten, auch T-Zellen genannt, entstehen im Knochenmark aus den Lymphoblasten und wandern in den Thymus, wo sie ausreifen (daher das T, von Thymus-abhängig). T-Zellen tragen an ihrer Oberfläche einen T-Zell-Rezeptor (TCR), mit dem jede T-Zelle jeweils ein spezifisches Antigen erkennen kann (Schlüssel-Schloss-Prinzip). Im Gegensatz zu den B-Lymphozyten, die auch freie Antigene erkennen, erkennen T-Zellen nur Antigene, die im Komplex mit MHC-Molekülen auf den Oberflächen von körpereigenen Zellen präsentiert werden. Die unterschiedlichen Typen von T-Zellen werden eingeteilt nach den Proteinen auf ihrer Zellmembran, die gleichzeitig für die Funktionen der Zellen wichtig sind: T-Helferzellen tragen beispielsweise das CD4-Protein (die Abkürzung CD steht für engl. Cluster of differentiation), die zytotoxischen T-Zellen haben das CD8-Protein auf ihrer Oberfläche.
T-Helferzellen
Die T-Helferzellen koordinieren die Immunreaktion. Sie erkennen über ihren spezifischen T-Zell-Rezeptor Antigene, die ihnen von den antigenpräsentierenden Zellen (dendritische Zellen, Makrophagen, B-Lymphozyten) auf MHC-II-Komplexen dargeboten werden. Diese Aktivierung veranlasst die T-Helferzelle sich zu teilen und ihre Botenstoffe freizusetzen: die Lymphokine der Zellen vom Subtyp TH1 führen dabei eher zur Verstärkung der zellulären Immunantwort, während TH2-Zellen mehr die Produktion von Antikörpern stimulieren.
Regulatorische T-Zellen
Die Mitte der 1990er erstmals beschriebenen regulatorischen T-Zellen tragen neben dem CD4-Rezeptor noch andere Proteine an ihrer Oberfläche (CD25, FoxP3).[11] Ihre Aufgabe ist die Modulation der Immunreaktion. Des Weiteren sind regulatorische T-Zellen vermutlich für die Unterdrückung einer überschießenden Immunantwort auf ansonsten 'harmlose' Antigene und Toleranzentwicklung gegen körpereigene Strukturen zuständig.
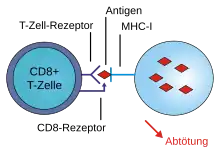
Zytotoxische T-Zellen
Die zytotoxischen T-Zellen können Antigene erkennen, die ihnen mithilfe der MHC-I-Komplexe präsentiert werden – körpereigene Zellen, die durch Krankheitserreger (zum Beispiel Viren) befallen sind, melden so ihren Zustand an das Immunsystem. Die zytotoxischen T-Zellen heften sich dann mit ihren T-Zell-Rezeptoren an diese Körperzellen; bei diesem Vorgang spielt ihr CD8-Rezeptor eine entscheidende Rolle.[12] Wenn sich noch weitere Rezeptoren, zum Beispiel der CD28-Rezeptor der zytotoxischen T-Zellen, an das fremde Eiweiß geheftet haben, beginnen sich die T-Zellen schnell zu vermehren, und schütten Substanzen aus, welche die infizierte oder krankhaft veränderte Zelle absterben lassen (sogenannte Apoptose, programmierter Zelltod).[13]
B-Lymphozyten
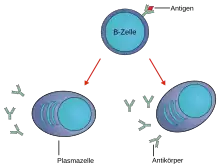
B-Lymphozyten, oder kurz B-Zellen, gehören ebenfalls zu den Leukozyten (weiße Blutkörperchen). Die Bezeichnung „B-Zellen“ stammte ursprünglich von ihrem Bildungsort in der Bursa Fabricii bei Vögeln. Bei Säugetieren entstehen die B-Zellen, wie alle anderen Abwehrzellen auch, im Knochenmark, daher erhielt der Buchstabe B hier nachträglich die Bedeutung bone marrow (engl. für ‚Knochenmark‘). Bindet eine B-Zelle an den Stoff (Antigen), der zu ihrem Rezeptor passt, kann sie durch Lymphokine aktiviert werden, die von aktivierten T-Helferzellen ausgeschüttet werden. Die derart aktivierten B-Zellen können sich daraufhin zu antikörperproduzierenden Plasmazellen oder zu Gedächtniszellen entwickeln.
B-Zellen sind im Gegensatz zu T-Zellen in der Lage, auch freie Antigene zu erkennen und sie einer Immunreaktion zuzuführen.
Humorale Bestandteile
Die humoralen Bestandteile des Immunsystems (von humor ‚Flüssigkeit‘) bezeichnen verschiedene Plasmaproteine, die passiv im Blut, bzw. der Lymph- und Gewebsflüssigkeit zirkulieren. Sie sind im Gegensatz zu den Abwehrzellen nicht in der Lage, aktiv an den Ort einer Infektion zu wandern.
Antikörper
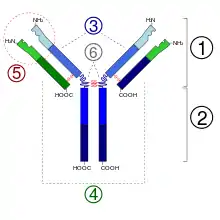
1. Fab-Abschnitt
2. Fc-Abschnitt
3. schwere Ketten
4. leichte Ketten
5. Antigenbindungsstelle (Paratop)
6. hinge-Region (dt. ‚Scharnier‘)
(*) -S-S-Disulfidbrücke
Zur Abwehr von in den Organismus eingedrungenen Bakterien, Bakterientoxinen, Viren oder anderen Fremdstoffen produzieren die B-Lymphozyten und Plasmazellen maßgeschneiderte Antikörper, die bestimmte Proteine oder auch Zuckerketten (Antigene) an der Oberfläche der Fremdstoffe erkennen und sich an diese heften können. Antikörper haben prinzipiell drei Funktionen:
- Die sogenannte Opsonierung. Das heißt, dass das Antigen durch den Fc-Teil (Teil der konstanten Kette des Antikörpers) für Phagozyten (Fresszellen) besser „sichtbar“ gemacht wird.
- Durch den Antigen-Antikörperkomplex wird das sogenannte Komplementsystem aktiviert, das zum einen wiederum als Opsonin (=Stoffe die Opsonieren) wirkt, zum anderen Chemotaxine (Lockstoffe für Zellen des Immunsystems) freisetzt und einen sogenannten MAK (Membran-Angriffs-Komplex) bildet, der Löcher in Zellmembranen verursacht.
- Antikörper wirken direkt inaktivierend auf den Eindringling durch Verkleben und Bildung von großen Komplexen (je nach Antikörperklasse und Anzahl der Antigendeterminanten).
Die einfachsten Antikörper, die der sogenannten IgG-Klasse, bestehen aus zwei identischen schweren Ketten und zwei identischen leichten Ketten. Die schweren Ketten sind unter anderem für die Verankerung des Antikörpers auf der Oberfläche von Granulozyten zuständig; die leichten Ketten bilden zusammen mit den schweren Ketten die für die Erkennung eines spezifischen Antigens verantwortliche Antigendeterminante im Fab-Fragment. Durch somatische Rekombination, somatische Hypermutation und Kombination verschiedener leichter und schwerer Ketten können Antikörper mehr als 100 Millionen verschiedene Fab-Fragmente bilden und damit eine Unzahl verschiedener Antigene erkennen.
Komplementsystem
Das Komplementsystem ist Teil der angeborenen Immunantwort, es besteht aus einer Gruppe von über 30 Plasmaproteinen mit ganz unterschiedlichen Eigenschaften. Ein Teil der zum Komplementsystem gehörenden Proteine sind zum Beispiel Proteasen, die sich an Mikroorganismen binden können und die Zellwände des Eindringlings schädigen, wodurch der Eindringling zerstört wird. Andere Proteine des Komplementsystems, die Anaphylatoxine, haben gefäßerweiternde Wirkung und fördern die Entzündungsreaktion. Viele Komplementfaktoren können außerdem Abwehrzellen zum Ort der Infektion locken und sind in der Lage, Fresszellen zu aktivieren, die die Eindringlinge dann verschlingen.
Interleukine
Die zu den Zytokinen gehörenden Interleukine sind körpereigene Botenstoffe, die von den Zellen des Immunsystems gebildet werden. Man kennt heutzutage bereits eine große Zahl von Interleukinen (IL-1 bis IL-35; Stand November 2009), die jeweils auf ganz unterschiedliche Abwehrzellen wirken – manche regen beispielsweise Leukozyten zu Wachstum, Reifung und Teilung an oder sorgen für deren Aktivierung.
Ablauf einer Immunreaktion
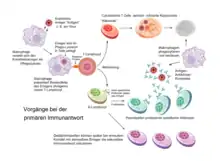
Falls Erreger die mechanischen Barrieren überwinden, mit denen sich der Körper vor einer Infektion schützt, so hängt der Ablauf der Immunreaktion davon ab, ob das Immunsystem bereits zuvor einmal einen Kontakt mit diesem bestimmten Erreger hatte.
Bei einer Erstinfektion beginnt die Immunreaktion meist mit den antigenpräsentierenden Zellen, hierzu gehören z. B. Makrophagen oder dendritische Zellen; diese Zellen sind als Teil der angeborenen Immunabwehr in der Lage, typische Merkmale von Krankheitserregern zu erkennen, ohne zuvor mit diesem Erreger Kontakt gehabt zu haben. Sie können die Krankheitserreger aufnehmen (phagozytieren) und in ihrem Inneren einschließen – förmlich „fressen“, daher werden sie auch als Fresszellen bezeichnet. Anschließend präsentieren sie Bruchstücke der Erreger an ihrer Oberfläche den Zellen der adaptiven Immunabwehr (B- und T-Lymphozyten), die daraufhin in einen aktivierten Zustand übergehen. Einige Abwehrzellen können daraufhin die Erreger durch Phagozytose oder die Ausschüttung aggressiver Substanzen direkt abtöten. Andere beginnen mit der Produktion von Antikörpern, die an die Erreger binden und diese einerseits bewegungsunfähig und damit unschädlich machen, andererseits sie für die Vernichtung durch weitere Abwehrzellen markieren. Nach der ersten Infektion mit einem Erreger bleiben die Antikörper und sogenannte Gedächtniszellen erhalten, um bei einer erneuten Infektion wesentlich schneller und effizienter auf den Eindringling reagieren zu können.
Ob nach einer Infektion tatsächlich auch eine Erkrankung auftritt, hängt von einem komplexen Wechselspiel des Immunsystems mit dem (ungebetenen) Gast ab. Eine Rolle spielen etwa die Menge der eingebrachten Erreger und deren krankmachenden Eigenschaften (Virulenzfaktoren), sowie der Zustand des Immunsystems der betroffenen Person. So kann durch vorherigen Kontakt mit diesem Erreger bereits eine Immunität bestehen, die Erregerdosis oder -virulenz für einen Krankheitsausbruch zu gering sein oder das Immunsystem in der Lage sein, trotz Infektion Krankheitssymptome zu verhindern [Immunschutz durch inapparente Infektion: stille Feiung (Immunisierung ohne Impfung oder manifeste Erkrankung)]. Bei intaktem Immunsystem und geringer Erregerdosis kann also eine Erkrankung wie beispielsweise eine Erkältung entweder überhaupt nicht ausbrechen oder einen weniger schweren Verlauf nehmen. Solange sich keine eindeutigen Symptome zeigen, kann der Verlauf einer Infektion kaum oder gar nicht vorhergesagt werden.
Wenn ein Krankheitserreger oder eine Tumorzelle keine Immunantwort erzeugt, dem Immunsystem also entkommt, wird dies als Immunescape bezeichnet.
Reifung und Alterung
Das Immunsystem eines Neugeborenen ist noch unreif.[15] Es erhält aber bereits vor der Geburt mütterliche IgG-Antikörper über die Plazenta. Bei vielen Säugetieren können Antikörper die Plazenta gar nicht passieren, die Aufnahme erfolgt dann über das Antikörper-reiche Kolostrum. Der sogenannte Nestschutz hilft den Babys in den ersten Monaten. Darüber hinaus kann Stillen durch unspezifische sIgAs, die sich den Schleimhäuten anlagern, noch etwas länger vor Infektionen der oberen Atemwege und Magen/Darmkeimen schützen.[15] Da die transplacentalen Antikörper im Blut des Babys mit einer Halbwertszeit von ungefähr 3 Wochen abgebaut werden, stellt sich innerhalb 3 bis 12 Monate nach Geburt ein IgG-Mangel im Serum ein; infolgedessen erhöht sich das Infektionsrisiko.[15] Dagegen steigt der eigene IgM-Spiegel an, was darauf hinweist, dass das adaptive Immunsystem nach der Geburt unmittelbar aktiv wird. IgG und IgA des Babys können etwa erst ab Monat 6 im Serum deutlich nachgewiesen werden und erhöhen sich kontinuierlich, bis nach mehreren Jahren die Werte von Erwachsenen erreicht werden. Diese initiale Verzögerung liegt an der Unreife der T-Zellen, sodass der Klassenwechsel anfangs ineffizient ist.[15]
Das kindliche Immunsystem ist bei Geburt überwiegend auf Anti-Inflammation eingestellt: Es sind keine NK-Zellen nachweisbar, es liegen unreife B-Zellen vor und es gibt eine verstärkte T-Suppressoraktivitat (wegen dominant vorliegenden TH2- und regulatorischen T-Zellen).[15] Dies soll eine TH1-dominierte Antwort unterdrücken, um den Körper vor Abstoßungsreaktionen zu schützen.[16] Für eine erfolgreiche Abwehr von Infektionserregern bedarf es daher einer Umstellung. Durch die Besiedlung von Mikroorganismen werden Signale für einen Wechsel ausgelöst und das Immunsystem trainiert. Auch Lebendimpfungen tragen dazu durch sogenannte heterologe Effekte bei; diese können die Kindersterblichkeit stärker als erwartet senken und die Häufigkeit von Infektionen auch gegenüber nicht-geimpften Krankheiten reduzieren.[15]
Neuere Untersuchungen zeigen aber, dass die T-Zellen Neugeborener durchaus mit einer entzündlichen Reaktion reagieren können (Pro-Inflammation) und nicht notwendigerweise unterdrückt werden.[17][18] So setzen T-Zellen Interleukin-8 (IL-8) frei, das u. a. neutrophile Granulozyten rekrutiert. Diese gehen dann unspezifisch gegen schädlichen Eindringlinge vor. IL-8 produzierende T-Zellen sind in Erwachsenen dagegen selten vorhanden, sodass sich T-Zellen Neugeborener von denen Erwachsener qualitativ unterscheiden.
In den ersten Lebensmonaten beginnt das Immunsystem, sich auf die Abwehr von Krankheitszellen vorzubereiten. Dies geschieht durch einen Vorgang der negativen Selektion; das heißt, der Körper bildet zunächst durch zufällige genetische Rekombination viele Millionen unterschiedlicher Abwehrzellen, von denen eine jede ein anderes Antigen erkennen kann. Im Anschluss werden solche Zellen eliminiert, die eine Immunreaktion auf körpereigene Strukturen veranlassen würden (Diesen Vorgang fasst man unter dem Begriff Selbsttoleranz zusammen). Bei den T-Zellen geschieht dies im Thymus, der Reifungsstätte der T-Zellen. Hier differenzieren sich die T-Zellen in die verschiedenen Typen (wie CD4+ und CD8+ Zellen) und werden anschließend mit körpereigenen Substanzen konfrontiert. Wenn eine T-Zelle einen dazu passenden Rezeptor trägt und an die körpereigene Struktur bindet, stirbt die T-Zelle ab. Das Immunsystem lernt so „fremd“ von „eigen“ zu unterscheiden.
Das Immunsystem erreicht bei Jugendlichen volle Funktionalität.[19] Statistisch gesehen sind Jugendliche oder Erwachsene seltener krank als Neugeborene/Kleinkinder oder ältere Personen, da noch ständig neue T-Zellen im Thymus gebildet werden. Die T-Zellen-Bildung nimmt aber allmählich im Erwachsenenalter ab, parallel zur Menge naiver T-Zellen.[19] Die Zusammensetzung des T-Zellen-Pools ändert sich daher in eine ungünstige Richtung.
Mit fortschreitendem Lebensalter, etwa ab 60, steigert sich die Anfälligkeit des Menschen gegenüber Krankheiten und anderen Störungen wieder.[20] Dies liegt vor allem daran, dass sich im Alter die Bildung von B- und T-Lymphozyten verringert. Dies kann beispielsweise bei Influenza-Infektionen problematisch werden, da weniger influenzaspezifische T-Zellen und eine geringere, wirksame Menge Influenza-Hämagglutinin-spezifischer Antikörper (sog.r niedrigerer Antikörpertiter) gebildet werden, sei es nach einer Impfung oder nach einer Infektion.[20] Die Immunoseneszenz betrifft innates und adaptives Immunsystem, ist aber nicht notwendigerweise vom Lebensalter selbst abhängig.[20] Des Weiteren sind die Abwehrzellen insgesamt weniger aktiv, was zu einer Schwächung der Immunabwehr führt, einhergehend mit erhöhtem Infekt- und Krebsrisiko. Zudem erhöht sich das basale Inflammationsniveau.[20]
Geschlechtsspezifische Unterschiede
Männer und Frauen haben grundsätzlich das gleiche Immunsystem. Die Art und Stärke der Immunreaktionen bei den Geschlechtern sind jedoch verschieden. Dies führt zur geschlechtsspezifischen Prävalenz, Manifestation und Behandlungsergebnis von Malignomen sowie von autoimmunen und infektiösen Erkrankungen.[21]
Infektionen
Man findet, dass das Immunsystem teilweise östrogenabhängig ist,[22] sodass Frauen vor einigen Viruserkrankungen möglicherweise besser geschützt sind wie etwa Influenza A-Viruserkrankungen[23] (hierbei spielen jedoch auch noch andere Faktoren eine Rolle[24]). Zellen des angeborenen Immunsystems der Frauen produzieren erheblich mehr Alpha-Interferon bei einer HIV-Exposition als die Zellen der Männer. Auch hier wurde die Frage gestellt, ob dies ein Östrogen-Effekt ist.[25] Hepatitis-B-Folgeerkrankungen (wie das Hepatozelluläre Carcinom) zeigen jedoch eine deutliche Prävalenz des männlichen Geschlechts, wofür ein direkter Einfluss von Sexualhormonen auf die Virusreplikation verantwortlich gemacht wird.[26]
Nicht nur die Ausprägung von Viruserkrankungen, sondern auch das Vorkommen und der Behandlungserfolg von parasitären Erkrankungen (Amöbiasis, Leishmaniose, Helminthen-Infektionen) zeigen eine Abhängigkeit zuungunsten des männlichen Geschlechts, die auf eine direkte Androgenwirkung auf das Immunsystem zurückgeführt wird.[27]
Eine der häufigsten Bakterieninfektionen des Menschen ist die Tuberkulose, von der überproportional viele Männer betroffen sind, deren Behandlungserfolg zudem auch schlechter ist. Die Ursachen hierfür werden untersucht.[28] In den letzten Jahren hat auch die geschlechtsabhängige Modulation der durch eine Impfung erzeugten Immunantwort das Interesse der Immunologen auf sich gezogen.[29]
Autoimmunerkrankungen
Neben biochemischen gibt es auch genetische Unterschiede der Immunsysteme. Einige an der Immunabwehr beteiligten Gene liegen auf dem (bei Frauen doppelt vorhandenen) X-Chromosom. Bei fehlender X-Inaktivierung werden diese, wie das des TLR 7 (Toll-like-Rezeptor 7), verstärkt exprimiert,[30] sodass das Immunsystem bei solchen Frauen überaktiv ist, was zu Autoimmunerkrankungen wie dem Systemischen Lupus erythematodes führen kann.[21] Auch an anderen Autoimmunerkrankungen, wie an der Primär biliären Cholangitis und der Autoimmunhepatitis erkranken Frauen deutlich häufiger.[31] Dasselbe gilt auch für entzündliche Erkrankungen des Zentralnervensystems[32] wie die Multiple Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und die durch neuronale Autoantikörper vermittelte Autoimmunenzephalitis.
Malignome
„Geschlechtsabhängige Prävalenz und Manifestation von Erkrankungen sind nicht auf Infektions- und Autoimmunkrankheiten beschränkt, sondern betreffen auch Krebserkrankungen, die als Todesursachen weltweit an der Spitze stehen.“[21] „Viele solide Tumoren außerhalb der Geschlechtsorgane sind bei Männern häufiger, und auch das Vorkommen hämatologischer Malignome zeigt geschlechtsabhängige Unterschiede,“[21] deren Mechanismen besonders auch im Hinblick auf die Leukämie und ihre Therapie mit Immuncheckpoint-Inhibitoren diskutiert werden.[33]
Weiteres
Darüber hinaus hat auch das Verständnis der entscheidenden Rolle einer Geschlechtsabhängigkeit des menschlichen Darm-Mikrobioms bei der Regulation von Immunprozessen in den letzten Jahren zugenommen.[21]
Störungen und Erkrankungen
Wie bei allen biologischen Systemen können sich auch beim Immunsystem Fehler einschleichen. So kann das Immunsystem seine Fähigkeit verlieren, auf Erreger oder körpereigene Zellen angemessen zu reagieren: je nach Ursache der Störung kommt es entweder zu einer zu schwachen oder gar fehlenden Immunantwort oder zu einer zu starken, überschießenden Immunreaktion. Auch die Zellen des Immunsystems können maligne entarten und eine Krebserkrankung auslösen. Ebenso wird ein Einfluss von depressiven Störungen, Stress und anderen psychischen Erkrankungen auf das Immunsystem vermutet.
Immundefekte
Fehlen einzelne Komponenten der Immunantwort oder funktionieren diese nicht mehr richtig, so kann das Immunsystem Krankheitserreger nicht mehr effektiv bekämpfen und selbst Erkrankungen, die normalerweise harmlos sind, können lebensbedrohliche Verläufe annehmen. Immundefekte können angeboren oder erworben sein:
- Die schwere kombinierte Immundefizienz (SCID) ist eine Gruppe von angeborenen Immundefekten, die sich durch Beeinträchtigung sowohl der zellulären Immunabwehr als auch der humoralen Immunabwehr auszeichnen, daher die Bezeichnung „kombiniert“.
- Die erworbene Immunschwäche AIDS wird durch das HI-Virus ausgelöst, das sich durch den Befall der T-Helferzellen erfolgreich der Immunabwehr entzieht. Durch die Vermehrung des HI-Virus werden jedoch immer mehr Abwehrzellen zerstört, sodass meist nach einigen Jahren Inkubationszeit eine zunehmende Abwehrschwäche eintritt und die Anzahl von Infekten und Tumorerkrankungen zunimmt.
- Eine Neutropenie oder sogar Agranulozytose kann durch Nebenwirkungen bestimmter Medikamente (z. B. Zytostatika) oder durch Autoimmunerkrankungen ausgelöst werden und führt vor allem zu Schleimhautentzündungen und sogenannten opportunistischen Infekten durch ansonsten harmlose Krankheitserreger.
- Weitere angeborene Immundefekte sind: Morbus Behçet, DiGeorge-Syndrom, selektiver Immunglobulin-A-Mangel und das Wiskott-Aldrich-Syndrom, bei denen jeweils ein bestimmter Anteil der Immunabwehr gestört ist.
Inadäquate Immunreaktionen
- Autoimmunerkrankungen: Nicht immer funktionieren die Schutzmechanismen der Selbsttoleranz fehlerfrei, sodass es zu gefährlichen Autoimmunkrankheiten kommen kann, bei denen das Immunsystem körpereigene Strukturen angreift. Bei diesen Krankheiten ist das üblicherweise sehr gut ausbalancierte Gleichgewicht zwischen einerseits den potentiell selbstzerstörerisch wirkenden (autoreaktiven) T-Zellen und andererseits den regulatorischen T-Zellen gestört, die die Ersteren eigentlich in „Schach halten“ sollen. Einige Beispiele für Autoimmunerkrankungen sind:
- Diabetes Typ I, verursacht durch Antikörper gegen Beta-Inselzellen der Bauchspeicheldrüse.
- Rheumatoide Arthritis, bei der es durch eine Immunreaktion zu einer Entzündung der Gelenkinnenhaut kommt.
- Multiple Sklerose, verursacht durch Antikörper gegen die Myelinscheide von Nervenfasern.
- Allergie/Heuschnupfen: Das Immunsystem kann die Fähigkeit verlieren, auf fremde Eiweiße angemessen zu reagieren. Die übermäßige Aktivierung von Basophilen (und Eosinophilen), insbesondere aber der ortsständigen Mastzellen, kann zur allergischen Reaktionen, wie zum Beispiel Heuschnupfen, führen. Eine systematische Aktivierung dieser Zellen, also die Aktivierung im ganzen Körper, kann schwere Symptome bis hin zum anaphylaktischen Schock auslösen.
- Zytokinsturm: Eine Überreaktion des Immunsystems, bei der die sonst übliche Regulierung der Bildung von Zytokinen nicht funktioniert.
Krebserkrankungen

Auch die Zellen des Immunsystems können bösartig entarten und so zu Krebserkrankungen führen, die meist den gesamten Körper befallen und sich vor allem in den Organen des Immunsystems abspielen und zur Abnahme der Immunabwehr und Verdrängung der normalen Blutbildung im Knochenmark führen. Durch die große Zahl unterschiedlicher Zellen und deren Vorläufer gibt es eine Vielzahl von verschiedenen Krebserkrankungen mit ganz unterschiedlichen Symptomen und Krankheitsverläufen, die aber grob in zwei Gruppen eingeteilt werden können: Geht der Krebs von den Vorläuferzellen im Knochenmark aus, so spricht man von Leukämien, die akut oder chronisch verlaufen können. Bösartige Tumoren der Lymphknoten nennt man Lymphknotenkrebs oder malignes Lymphom.
Andererseits ist ein therapeutischer Ansatz bei Krebserkrankungen, die Krebsimmuntherapie, die Aktivierung des Immunsystems gegen Tumorzellen.
Sonstige Schwachpunkte
- Haben Viren sich in eine Schicht eingehüllt, die der Körper nicht als fremd erkennt (beispielsweise eine Schicht aus Lipiden), so sind sie nicht erkennbar.
- Einige Bakterien hüllen sich in eine Schutzkapsel, um die Aufnahme in Fresszellen zu erschweren, z. B. Pneumokokken oder Meningokokken. Bekapselte Bakterien haben eine höhere bakterielle Virulenz als unbekapselte Arten.
- Im Gegensatz zu Krankheitserregern verursachen Tumorzellen keine Entzündungsreaktion, es kommt daher nicht zu einer Aktivierung der Immunantwort. Einige Tumoren haben die Eigenschaft, sich regelrecht zu tarnen. Wenn keine tumorassoziierten Antigene (TAA) von den Krebszellen gebildet werden, erkennt das Immunsystem die Krebszelle daher nicht und es kommt zu Krebswachstum und/oder Metastasierung.[34]
- Das Immunsystem schützt nach heutigem Kenntnisstand nicht vor Prionen (infektiöse Proteine), sondern scheint – im Gegenteil – eine Rolle bei der Ausbreitung der Prionenerkrankung zu spielen. So waren beispielsweise in einem Experiment Mäuse mit defektem Immunsystem immun gegen eingebrachte Prionen, während Tiere mit funktionierendem Immunsystem eine Erkrankung entwickelten.[35]
Einflüsse
Bei einem intakten Immunsystem spricht man von Immunkompetenz. Die Abwehrfunktion kann auf verschiedene Weise positiv oder negativ beeinflusst werden.
Negative Einflussfaktoren
Es gibt viele Verhaltensweisen und Umweltfaktoren, denen ein negativer Einfluss auf das Immunsystem zugeschrieben wird, z. B.:
- Schlafmangel[36][37] kann den Stoffwechsel und das Immunsystem beeinflussen[37][38]
- Langzeitbelastung des Körpers mit Genussgiften (Nikotin[37], Alkohol[39] und Drogen).
- Ungesunde Ernährung[40], bei der u. a. Mineralstoffe und Vitamine fehlen.
- Chronischer Stress[41][42] bewirkt die Ausschüttung von Glucocorticoiden, was die Produktion von Zytokinen[43] und damit die Aktivität des adaptiven Immunsystems hemmt.
- Angst[44][45]
- Aufnahme von Umweltgiften aus der Umgebung,[46]
- Einwirkung ionisierender Strahlung (akute Strahlenkrankheit und vermehrt auftretende Malignome nach Hiroshima und Tschernobyl)
- Unterkühlung.
- Zu häufige erschöpfende körperliche Belastungen (Zwangsarbeit, Sport)
- Virusinfektionen, die mit einer Immunsuppression einhergehen (Masern, HIV), alle sonstigen Virusinfektionen
- Hohes Lebensalter (bei hochbetagten Menschen lässt die Effizienz des Immunsystems nach, siehe Immunoseneszenz)
- Medikamentöse Immunsuppression nach Organtransplantation oder bei Autoimmunkrankheiten.
Immunsuppression
In manchen Situationen ist eine Immunsuppression, also eine medikamentöse Hemmung oder sogar komplette Unterdrückung der Immunantwort, notwendig. Beispielsweise mindert eine immunsuppressive Therapie das Risiko für Abstoßungsreaktionen nach Organtransplantationen. Patienten, die an Autoimmunkrankheiten wie Rheuma, Psoriasis oder Allergien leiden, sind häufig über viele Jahre hinweg auf Behandlungen angewiesen, die ihr überschießendes Immunsystem regulieren.
Immunsupprimierte Menschen sind dabei anfälliger für opportunistische Erreger wie Influenza-Viren, Pneumokokken, Meningokokken oder auch Pilzinfektionen.[47] Deshalb werden sie von der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (RKI) als Risikogruppe für diverse Infektionskrankheiten eingestuft.[47][48]
Das am längsten bekannte immunsuppressive Medikament ist Cortison, die Vorstufe des körpereigenen Hormons Cortisol. Neuere Wirkstoffe wie Tacrolimus oder Cyclosporin A sind jedoch teilweise deutlich wirksamer und/oder haben geringere Nebenwirkungen.
Impfung
Die Impfung dient als vorbeugende Maßnahme, die Immunabwehr gegen bestimmte bakterielle oder viralen Infektionskrankheiten vorzubereiten. Bei der aktiven Immunisierung, der häufigsten Form der Impfung, wird das Immunsystem zu einer Immunantwort mit folgender Ausbildung einer Immunkompetenz angeregt, ohne die Erkrankung selbst auszulösen. Hierzu werden abgeschwächte Erreger, tote Erreger oder bestimmte typische Eiweiße (Proteine) und Zuckermoleküle, also Bruchstücke des Erregers, als Impfstoffe in den Körper eingebracht. Die Reaktion des Organismus auf diese Antigene führt zur Bildung spezifischer Antikörper und Gedächtniszellen, die weiterhin im Blut und den Lymphbahnen zirkulieren; dadurch bleibt der Schutz gegen diese Antigene lange erhalten. Falls der Körper erneut mit dem Erreger in Kontakt kommt, hat er durch die Gedächtniszellen eine sehr viel effizientere und schnellere Immunantwort zur Verfügung, die die Erreger bekämpft, bevor es zu einer Erkrankung kommt.
Man unterscheidet nach Totimpfstoffen und Lebendimpfstoffen: Während Totimpfstoffe wie etwa gegen Meningokokken der Serogruppen A, C, W, Y und B oder gegen Pneumokokken auch für Menschen mit Immundefekt als sicher gelten, sollten Lebendimpfstoffe, z. B. gegen Varizellen oder Gelbfieber, diesen Patienten nur nach einer ärztlichen Einzelfallentscheidung verabreicht werden.[47]
„Stärkung“ des Immunsystems
Es gibt keine wissenschaftlich aussagekräftigen Untersuchungen, inwiefern äußere Maßnahmen einen positiven Einfluss auf das Immunsystem haben.[49][50] Falls das Immunsystem nicht von Geburt an defekt ist oder durch Erkrankungen (z. B. HIV) bzw. eine Fehlernährung geschädigt ist, liegen keine Evidenzen vor, wie man seine Leistung verbessern könnte.[51] Es gibt eine unübersehbare Anzahl von parawissenschaftlichen Empfehlungen und Life-Style-Ratschlägen, wie ein Gesunder sein Immunsystem vorbeugend „stärken“ könnte – nichts ist wissenschaftlich bewiesen. Unstrittig ist allerdings, dass Personen mit therapiebedürftigen Problemen (z. B. durch Laboruntersuchungen nachgewiesene Vitaminmangelerkrankungen wie Skorbut) durch Vitamingaben behandelt werden oder dass im Krankheitsfall alle das Immunsystem potentiell schwächenden Faktoren ausgeschaltet werden können.
Die Redewendungen „Stärkung des Immunsystems“ und „Stärkung der Abwehrkräfte“ werden dagegen häufig in rechtswidriger Weise als Claim in der Werbung für Nahrungsergänzungsmittel, Functional-Food und alternativmedizinische Heilmittel verwendet. Solche Verweise auf allgemeine, nichtspezifische Vorteile eines Produktes sind nach EU-Recht laut Artikel 10 Absatz 3 der Health-Claims Verordnung verboten, sofern ihnen nicht eine durch die Europäische Behörde für Lebensmittelsicherheit genehmigte spezielle gesundheitsbezogene Angabe beigefügt ist. Für eine Aufnahme in die entsprechende Positivliste genehmigter Angaben muss die Art und Weise, in der das Produkt auf das Immunsystem wirkt, angegeben und die Wirksamkeit wissenschaftlich belegt werden.
Sonnenlicht und Vitamin D
Sonnenlicht kann einen Einfluss auf das Immunsystem haben. Bereits vor mehr als 100 Jahren war das tägliche Sonnenbad ein fester Bestandteil der Tuberkulosetherapie (allerdings in Ermangelung von Antibiotika, die erst um 1930 entdeckt und nach 1940 am Menschen erprobt wurden). Hierbei spielt Vitamin D eine wichtige Rolle im Immunsystem.[52] Die Forschung konnte den zugrundeliegenden Mechanismus darstellen: Bestimmte Abwehrzellen besitzen auf ihrer Oberfläche einen sogenannten Toll-like Receptor; dieser wird bei einer Bakterieninfektion aktiviert und veranlasst die Abwehrzelle, eine Vorstufe von Vitamin D (25-Hydroxy-Vitamin-D) zu produzieren.[53] Gleichzeitig bildet dieselbe Zelle verstärkt einen weiteren Rezeptortyp aus, der auf die Erkennung von Vitamin D spezialisiert ist. Das Sonnenlicht wandelt die Vitamin-D-Vorstufe in das aktive Vitamin D um, welches sich nun an den Rezeptor heftet. Dadurch wird die Abwehrzelle dazu angeregt, das antibakteriell wirkende Cathelizidin zu bilden. Der Zusammenhang erklärt auch, warum Menschen mit dunkler Haut für Infektionen wie beispielsweise die Hauttuberkulose besonders empfänglich sind: In ihrem Blut finden sich in der Regel deutlich geringere Mengen der Vitamin-D-Vorstufe, wobei diskutiert wird, ob die zusätzliche Einnahme von Vitamin-D-Präparaten den Mangel ausgleichen kann.[53]
Der mögliche Zusammenhang von Vitamin D und Virus-Infektionen ist Gegenstand der Forschung. Eine tägliche, niedrigdosierte Vitamin D-Gabe (400–1000 IU/Tag) kann bei Kleinkindern oder Jugendlichen (1–16 Jahren) einen schwachen Schutzeffekt vor akuten Atemwegsinfektionen (acute respiratory infection) entfalten. Höhere Dosierungen zeigten keinen Vorteil, andere Altersgruppen profitieren nicht.[54]
Neben anderen Faktoren ist die (tageszeit- und jahreszeitabhängige) Höhe des Sonnenstands und entscheidend für einen ausreichenden UV-B-Anteil im Sonnenlicht zur Bildung von Vitamin-D3-Bildung, im Winter kann nördlich des 51. Breitengrads (Köln–Erfurt–Dresden) zeitweise selbst zur Mittagszeit bei einem Ganzkörpersonnenbad kein Vitamin D3 in der Haut gebildet werden,[55] was zu Vitamin-D-Mangel führen kann.[56]
Eine Schwächung des Immunsystems kann eine Folge der teilweise immunsuppressiven Wirkung der UV-B-Strahlen sein, die die T-Zell-abhängige Immunantwort stört.[57] Eine übermäßige UVB-Belastung der Haut fördert die Entwicklung von bösartigen Hauttumoren wie Basalzellkarzinomen und Plattenepithelkarzinomen[58] und mindert die Abwehr von Krankheitserregern wie Bakterien, Pilzen oder Viren deutlich.
Evolution
Die komplexe Wechselbeziehung zwischen dem Wirtsorganismus und den Erregern kann unter evolutionären Gesichtspunkten als ein „Angreifer-Verteidiger-System“ angesehen werden. Durch die Abwehrmaßnahmen des Immunsystems kommt es zu einem starken Selektionsdruck, unter dessen Einfluss sich die Erreger immer besser an den (menschlichen) Organismus anpassen müssen, um weiter fortzubestehen. Gleichzeitig üben Krankheitserreger oder Parasiten einen Selektionsdruck auf das Immunsystem des Wirts aus, so kann es zu einer Koevolution von Parasit und Wirt kommen, die zu einer Symbiose führen kann. Dann können die ehemaligen Erreger den Wirt für ihre Vermehrung nutzen, ohne ihn zu schädigen. Ein Beispiel für eine solche erfolgreiche Koevolution sind die Mitochondrien, welche ehemals als körperfremder Schädling in die Zellen von Eukaryoten eindrangen und die sich im Laufe der Jahrmillionen zu einer wichtigen Zellorganelle entwickelten.[59]
Bei Infektionen mit Krankheitserregern, welche an den Menschen als ihren Reservoirwirt angepasst sind, kann eine Erkrankung – bei intaktem Immunsystem und geringer Erregerdosis – entweder überhaupt nicht ausbrechen oder einen weniger schweren Verlauf nehmen. Bei Infektionen mit an einen Wirt nicht oder nur wenig angepassten Erregern hängt es von vielen Faktoren (Zustand des Immunsystems, Aggressivität der Erreger) ab, wie schwer eine Erkrankung verläuft und wie lange sie dauert oder ob der Erkrankte an den Folgen der Infektion sogar verstirbt. Die Höhe der durchschnittlichen Letalität einer Erkrankung lässt nach dieser Theorie beispielsweise Rückschlüsse zu, wie gut oder schlecht Krankheitserreger an den Wirt angepasst sind.
Nach gängiger evolutionärer Betrachtungsweise sollten Parasiten und Krankheitserreger im Lauf ihrer Evolution eine verminderte Virulenz für ihre Wirte entwickeln, da virulente Parasiten und Krankheitserreger ihre Wirte und infolgedessen sich selbst eher zum Aussterben bringen.[60] In vielen wissenschaftlichen Studien wurden Hinweise für die Richtigkeit dieser Betrachtungsweise gefunden,[61] Nach einer alternativen Perspektive allerdings wird die Selektion das Maß der Virulenz begünstigen, sodass die Steigerungsrate des Parasiten oder Erregers maximiert würde.[60]
Die evolutionäre Theorie der Immunologie kann noch nicht abschließend bewertet werden, ähnlich der Theorie der Inselverzwergung (wonach kleine Nagetiere zum Inselgigantismus neigen). Etliche Wissenschaftler tendieren dazu, dass Modelle, bei denen mittlere Virulenz bevorzugt wird, auf lange Sicht eine einfache Erklärung für die Entwicklung einer reduzierten Virulenz bieten.[60]
Einfluss auf die Partnerwahl bei Tieren
Untersuchungen mit Tieren am Max-Planck-Institut für Immunbiologie erbrachten unter anderem Hinweise auf einen Zusammenhang zwischen dem individuellen Immunsystem eines Lebewesens und der Partnerwahl. Über den Geruchssinn kann die genetische Individualität und Verschiedenheit erfasst und bewertet werden. Die Untersuchungen ergaben: MHC-Peptide erlauben dem Immunsystem, durch die Analyse der MHC-Peptidkomplexe an der Zelloberfläche durch die T-Zellrezeptoren Information über den Status von einzelnen Zellen zu erlangen. Und die Analyse der Struktur dieser Peptide ermöglicht über olfaktorische Neuronen Informationen über den genetischen Status eines Gegenübers zu gewinnen. Dies ist möglich, weil die Struktur der Ankerreste von Peptiden Rückschlüsse auf die Struktur von MHC-Molekülen und damit Rückschlüsse auf die Kodierungskapazität von Organismen erlauben.[62]
Literatur
- Kenneth Murphy, Casey Weaver (Hrsg.): Janeway Immunologie. 9. Auflage. Spektrum Akademischer Verlag, Heidelberg/Berlin 2018, ISBN 978-3-662-56003-7. Die 5. englische Ausgabe ist online auf den Seiten des NCBI-Bookshelf verfügbar, (online).
- Gerd-Rüdiger Burmester: Taschenatlas der Immunologie. Grundlagen, Labor, Klinik. 2. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-115382-2.
- Abul K. Abbas: Cellular and Molecular Immunology. 5. Auflage. W.B. Saunders Company, 2005, ISBN 1-4160-2389-5 (englisch).
- Diethard Gemsa, Joachim Robert Kalden, Klaus Resch: Immunologie. Begründet von Karl Otto Vorländer. Thieme, Stuttgart 1991
Weblinks
- ImmunDefektZentrum der Charité Berlin
- Deutsche Gesellschaft für Immunologie (DGfI)
- Artikel über Ursachen von Autoimmunerkrankungen/Hygienehypothese (Memento vom 2. Januar 2014 im Internet Archive)
- deutschlandfunk.de, 21. Mai 2017, Christine Westerhaus: Wenn das Immunsystem aufs falsche Gleis gerät
Einzelnachweise
- Vgl. Diethard Gemsa, Joachim Robert Kalden, Klaus Resch: Immunologie. Thieme 1991
- J. A. Borghans, A. J. Noest, R. J. De Boer: How Specific Should Immunological Memory Be? In: The Journal of Immunology. Nr. 163, 1999, S. 569–575 (jimmunol.org).
- S. Al-Attar, E. R. Westra u. a.: Clustered regularly interspaced short palindromic repeats (CRISPRs): the hallmark of an ingenious antiviral defense mechanism in prokaryotes. In: Biological Chemistry. Band 392, Nummer 4, April 2011, S. 277–289. doi:10.1515/BC.2011.042. PMID 21294681. (Review).
- M. P. Terns, R. M. Terns: CRISPR-based adaptive immune systems. In: Current Opinion in Microbiology. Band 14, Nummer 3, Juni 2011, S. 321–327. doi:10.1016/j.mib.2011.03.005. PMID 21531607. PMC 3119747 (freier Volltext). (Review).
- L. A. Marraffini, E. J. Sontheimer: CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. In: Nature Reviews Genetics. Band 11, Nummer 3, März 2010, S. 181–190, doi:10.1038/nrg2749, PMID 20125085, PMC 2928866 (freier Volltext) (Review).
- E. Svedmyr, M. Jondal: Cytotoxic effector cells specific for B Cell lines transformed by Epstein-Barr virus are present in patients with infectious mononucleosis. In: Proceedings of the National Academy of Sciences. Band 72, Nr. 4, 1975, S. 1622–1626, doi:10.1073/pnas.72.4.1622, PMC 432591 (freier Volltext).
- Hans-Gustaf Ljunggren, Klas Kärre: In search of the ‘missing self’: MHC molecules and NK cell recognition. In: Immunology Today. Band 11, Januar 1990, S. 237–244, doi:10.1016/0167-5699(90)90097-S.
- J. Banchereau, Ralph M. Steinman: Dendritic cells and the control of immunity. In: Nature. Band 392, Nr. 6673, 1998, S. 245–252, doi:10.1038/32588, PMID 9521319 (rockefeller.edu [PDF]).
- Henning Engeln: Das große Fressen. In: GEO kompakt. Nr. 2, März 2005, S. 132–140
- M. Lucas, W. Schachterle, K. Oberle, P. Aichele, A. Diefenbach: Dendritic cells prime natural killer cells by trans-presenting interleukin 15. In: Immunity. Band 26, Nummer 4, April 2007, S. 503–517, doi:10.1016/j.immuni.2007.03.006, PMID 17398124, PMC 2084390 (freier Volltext).
- S. Sakaguchi, N. Sakaguchi u. a.: Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. In: J Immunol. Nr. 155(3), 1995, S. 1151–1164, PMID 7636184.
- Rita Campanelli, Belinda Palermo et al.: Human CD8 co–receptor is strictly involved in MHC–peptide tetramer–TCR binding and T cell activation. In: International Immunology. Band 14, Nr. 1, Januar 2002, S. 39–44, doi:10.1093/intimm/14.1.39 (oxfordjournals.org [PDF]).
- C. H. June, J. A. Ledbetter u. a.: Role of the CD28 receptor in T-cell activation. In: Immunol Today. Nr. 11(6), 1990, S. 211–216, PMID 2162180.
- Spektrum: Immunantwort
- Barbara Bröker, Christine Schütt, Bernhard Fleischer: Grundwissen Immunologie. Springer-Verlag, 21. Juni 2019, S. 186–187, doi:10.1007/978-3-662-58330-2_14.
- Albrecht Bufe und Marcus Peters: Unterschiede zwischen kindlichem und erwachsenem Immunsystem. (PDF) In: Der niedergelassene Arzt - HAUT. Februar 2013, S. 68–74, abgerufen am 14. Juli 2020 (deutsch).
- Deena Gibbons et al.: Interleukin-8 (CXCL8) production is a signatory T cell effector function of human newborn infants. In: Nature Medicine. Band 20, Nr. 10, Oktober 2014, S. 1206–1210, doi:10.1038/nm.3670.
- Immune system of newborn babies stronger than previously thought. King’s College London, 21. September 2014, abgerufen am 14. Juli 2020 (englisch).
- Barbara Bröker, Christine Schütt, Bernhard Fleischer: Grundwissen Immunologie. Springer-Verlag, 2019, ISBN 978-3-662-58330-2, S. 187 f.
- Barbara Bröker, Christine Schütt, Bernhard Fleischer: Grundwissen Immunologie. Springer-Verlag, 21. Juni 2019, S. 188–189.
- Hanna Lotter, Marcus Altfeld: Sex differences in immunity. Seminars in Immunopathology 41 (2019), S. 133–135. https://link.springer.com/article/10.1007/s00281-018-00728-x
- C. J. Thaler, W. Samtleben: Einfluss von Sexualsteroiden auf physiologische und pathologische Reaktionen des Immunsystems. Der Gynäkologe 33 (2000), S. 393–401.
- Jackye Peretz, Andrew Pekosz, Andrew P. Lane, and Sabra L. Klein: Estrogenic compounds reduce influenza A virus replication in primary human nasal epithelial cells derived from female, but not male, donors. American Journal of Physiology-Lung Cellular and Molecular Physiology 310, 5 (1. März 2016) https://doi.org/10.1152/ajplung.00398.2015
- Landon G. vom Steeg, Sabra L. Klein: Sex and sex steroids impact influenza pathogenesis across the life course. Seminars in Immunopathology 41 (2019) S. 189–194.
- A. Rechtien, M. Altfeld: Sexual dimorphism in HIV-1 infection. Seminars in Immunopathology 41 (2019), S. 195–202. https://doi.org/10.1007/s00281-018-0704-y
- N. Büttner, R. Thimme: Sexual dimorphism in hepatitis B and C and hepatocellular carcinoma. Seminars in immunopathology 41 (2019) S. 203–211. https://doi.org/10.1007/s00281-018-0727-4
- J. Sellau, M. Groneberg, H. Lotter: Androgen-dependent immune modulation in parasitic infection. Seminars in Immunopathology 41 (2019), S. 213–224. https://doi.org/10.1007/s00281-018-0722-9
- D. Hertz, B. Schneider: Sex differences in tuberculosis. Seminars in Immunopathology 41 (2019), S. 225–237. https://doi.org/10.1007/s00281-018-0725-6
- S. Fischinger et al.: Sex differences in vaccine-induced humoral immunity. Seminars in Immunopathology 41 (2019), S. 239–249. https://doi.org/10.1007/s00281-018-0726-5
- M. Souyris et al.: Female predisposition to TLR7-driven autoimmunity: gene dosage and the escape from X chromosome inactivation. Seminars in Immunopathology 41 (2019), S. 153–164. https://doi.org/10.1007/s00281-018-0712-y
- D. Schwinge, C. Schramm: Sex-related factors in autoimmune liver diseases. Seminars in Immunopathology 41 (2019), S. 165–175 https://doi.org/10.1007/s00281-018-0715-8
- Stefan M. Gold et al.: Sex differences in autoimmune disorders of the central nervous system. Seminars in Immunopathology 41 (2019), S. 177–188. https://doi.org/10.1007/s00281-018-0723-8
- Isabel Ben-Batalla et al.: Sexual dimorphism in solid and hematological malignancies. Seminars in Immunopathology 41 (2019), S. 251–263. https://doi.org/10.1007/s00281-018-0724-7
- I. Bubanovic, S. Najman: Failure of anti-tumor immunity in mammals--evolution of the hypothesis. In: Acta Biotheor. 52(1), 2004, S. 57–64. PMID 14963404
- M. A. Klein et al.: A crucial role for B cells in neuroinvasive scrapie. In: Nature. Band 390, Nr. 6661, 1997, S. 687–690, doi:10.1038/37789, PMID 9414161 (columbia.edu [PDF]).
- Schlafstörungen. Springer-Verlag, 2017, ISBN 366254668X S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Irwin et al.: Partial sleep deprivation reduces natural killer cell activity in humans. In: Psychosomatic Medicine. Band 56, Nr. 6, November 1994, S. 493–498, doi:10.1097/00006842-199411000-00004, PMID 7871104.
- A. Zager, M. L. Andersen, F. S. Ruiz, I. B. Antunes, S. Tufik: Effects of acute and chronic sleep loss on immune modulation of rats. In: Am J Physiol Regul Integr Comp Physiol. Band 293, 2007, S. R504-R509, doi:10.1152/ajpregu.00105.2007, PMID 3636119 (physiology.org).
- Immunendokrinologie. edition winterwork, 2017, ISBN 396014430X S. 276 (eingeschränkte Vorschau in der Google-Buchsuche)
- Ernährung des Menschen. UTB, 2015, ISBN 3825285529 S. 111 (eingeschränkte Vorschau in der Google-Buchsuche).
- Stressmedizin und Stresspsychologie. Klett-Cotta, 2020, ISBN 3608290346 S. 47 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Schedlowski, R. E. Schmidt: Streß und Immunsystem. In: Naturwissenschaften. Band 83, Nr. 5, 1996, S. 214–220, doi:10.1007/BF01143326, PMID 8668232.
- Manfred Schedlowski, Uwe Tewes: Psychoneuroimmunologie. Spektrum Akademischer Verlag, 1996, ISBN 3-86025-228-3.
- Mut zur Angst. Kösel-Verlag, 2016, ISBN 3641176557 (eingeschränkte Vorschau in der Google-Buchsuche).
- Drei Gedächtnisse für den Körper. Springer-Verlag, 2019, ISBN 3662591316 S. 121 (eingeschränkte Vorschau in der Google-Buchsuche).
- L. Bayer-Oglesby, L. Grize, M. Gassner, K. Takken-Sahli, F. H. Sennhauser, U. Neu, C. Schindler, C. Braun-Fahrländer: Decline of ambient air pollution levels and improved respiratory health in Swiss children. In: Environmental Health Perspectives. Band 113, Nummer 11, November 2005, S. 1632–1637, PMID 16263523. PMC 1310930 (freier Volltext).
- Norbert Wagner, Frauke Assmus, Gabriele Arendt, Erika Baum, Ulrich Baumann: Impfen bei Immundefizienz: Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen. (IV) Impfen bei Autoimmunkrankheiten, bei anderen chronisch-entzündlichen Erkrankungen und unter immunmodulatorischer Therapie. In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. Band 62, Nr. 4, April 2019, ISSN 1436-9990, S. 494–515, doi:10.1007/s00103-019-02905-1 (springer.com [abgerufen am 7. Oktober 2021]).
- Ständige Impfkommission (STIKO): Empfehlungen der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut 2021. 26. August 2021, doi:10.25646/8824 (rki.de [abgerufen am 7. Oktober 2021]).
- Mythos Abhärten: So stärken Sie das Immunsystem. In: Der Spiegel. 11. Oktober 2013, abgerufen am 6. April 2020.
- Bernd Kerschner: Kalt duschen als gesunde Abhärtung? In: Medizin transparent. 3. September 2019, abgerufen am 8. Juli 2020.
- Immune system myths – can we really boost it? In: Skeptical Raptor. 8. März 2018, abgerufen am 6. April 2020.
- Vitamin D, An Issue of Endocrinology and Metabolism Clinics of North America, E-Book. Elsevier Health Sciences, 2010, ISBN 1455700266 (eingeschränkte Vorschau in der Google-Buchsuche).
- Philip T. Liu et al.: Toll-Like Receptor Triggering of a Vitamin D-Mediated Human Antimicrobial Response. In: Science. Band 311, Nr. 5768, 24. März 2006, S. 1770–1773, doi:10.1126/science.1123933, PMID 16497887.
- Scientific Advisory Committee on Nutrition: Update of rapid review: Vitamin D and acute respiratory tract infections. (PDF) UK government, 17. Dezember 2020, abgerufen am 5. Januar 2021 (englisch).
- M. F. Holick: Environmental factors that influence the cutaneous production of vitamin D. In: Am J Clin Nutr. Band 61 (3 Suppl), 1995, S. 638S–645S.
- Calcium plus Vitamin D. Georg Thieme Verlag, 2003, ISBN 3-1313-3151-8, S. 32 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Schwarz: Mechanisms of UV-induced immunosuppression. In: Keio J Med., Band 54, Nr. 4, Dezember 2005, S. 165–171, doi:10.2302/kjm.54.165.
- UV Strahlung und Hautkrebs. Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung IPA 2011, abgerufen am 12. März 2014.
- S. D. Dyall, M. T. Brown, P. J. Johnson: Ancient invasions: from endosymbionts to organelles. In: Science. Band 304, Nr. 5668, 2004, S. 253–257, doi:10.1126/science.1094884, PMID 15073369 (utexas.edu [PDF]).
- Richard E. Lenski, Robert M. May: The Evolution of Virulence in Parasites and Pathogens: Reconciliation Between Two Competing Hypotheses. In: Journal of Theoretical Biology, Band 169, Nr. 3, 7. August 1994, S. 253–265, doi:10.1006/jtbi.1994.1146.
- J. W. Kirchner, B. A. Roy: Evolutionary implications of host–pathogen specificity: fitness consequences of pathogen virulence traits. In: Evol Ecol Res, Heft 4, 2002, S. 27–48, (PDF).
- Thomas Boehm: Qualitätskontrolle im Immunsystem. (Steuerung der Partnerwahl). (Memento vom 8. Januar 2011 im Internet Archive) Max-Planck-Institut für Immunbiologie, Freiburg 2005, Beteiligte Abteilungen: Entwicklung des Immunsystems.