Zinkoxid
Zinkoxid auch Zinkoxyd (ZnO) ist eine chemische Verbindung aus Zink und Sauerstoff, die einerseits farblose, hexagonale Kristalle bildet oder andererseits, aufgrund der Lichtbrechung bei sehr kleinen Kristallen, als lockeres, weißes Pulver vorliegt.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
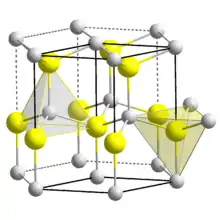 | ||||||||||||||||||||||
| _ Zn2+ _ O2− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Zinkoxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | ZnO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, hexagonale Kristalle oder weißes, lockeres Pulver[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
D02AB | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 81,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die traditionelle Bezeichnung Zinkweiß (Chinesischweiß, Ewigweiß, Schneeweiß) stammt von der Verwendung als weißes Farbmittel in Malerfarbe.
Medizinische Präparate zur Haut- und Wundbehandlung enthalten oft Zinkoxid wegen dessen antiseptischer Wirkung. Es wird häufig in der Zahnheilkunde (z. B. bei Wurzelkanalbehandlungen) eingesetzt und gilt als Biomaterial.
Vorkommen
Natürliche Vorkommen von Zinkoxid sind in Form des Minerals Zinkit (Rotzinkerz) zu finden.
Gewinnung und Darstellung
Je nach Herstellungsverfahren gewinnt man Zinkweiß oder Zinkoxid. Zinkweiß wird nach dem sogenannten französischen Verfahren aus Zinkdampf und Luftsauerstoff hergestellt.
Zinkoxid dagegen gewinnt man entweder aus der Durchführung der Herstellung nach dem sogenannten amerikanischen Verfahren aus Zinkerzen oder -Schrott durch Röstung, durch Reduktion mit Kohle und direkte anschließende Reoxidation oder nasschemisch durch Fällung als Hydroxid oder Carbonat aus Zinksalzlösungen und anschließende Calcination.
Zinkoxid entsteht durch die Verbrennung von Zink. Dabei kann sich das Oxid in feinfilziger, wollartiger Form (Lana philosophica) bilden.
- Zink verbrennt bei Anwesenheit von Sauerstoff zu Zinkoxid.
Es kann aber auch durch Glühen (Pyrolyse) von Zinkhydroxid, Zinkcarbonat oder Zinknitrat gewonnen werden:
- Bei höheren Temperaturen gibt Zinkhydroxid Wasser ab. Es entsteht Zinkoxid.
- Aus Zinkcarbonat entstehen beim Glühen Zinkoxid und Kohlenstoffdioxid.
Beim Rösten von Zinksulfid entsteht ebenfalls Zinkoxid:
Je nach Anwendungsbereich kann durch Variieren der Reaktionsbedingungen Zinkoxid in unterschiedlichen Qualitäten hergestellt werden. Industriell produzierte Zinkoxidpigmente sind häufig bleihaltig und somit zusätzlich mit dem Gefahrensymbol Xn (gesundheitsschädlich) zu kennzeichnen.
Dünne Schichten von Zinkoxid stellt man durch physikalische Abscheideverfahren (PVD) wie Sputtern und chemische Gasphasenabscheidung (CVD) her. CVD ermöglicht die Entstehung rauer Oberflächen, die sich dadurch auszeichnen, einfallendes Licht zu streuen und z. B. Solarzellen einen höheren Wirkungsgrad zu verleihen.
Produktion
Die weltweite Produktion von Zinkoxid wird auf 1,5 Mio. t geschätzt. In Europa werden 240.000 t pro Jahr verbraucht.[7]
Eigenschaften

Zinkoxid verdunstet ab ca. 1300 °C, der Sublimationspunkt unter Normaldruck liegt bei etwa 1800 °C. Ein Schmelzen von Zinkoxid ist erst unter erhöhtem Druck bei 1975 °C zu beobachten. Beim Erhitzen färbt es sich zitronengelb, nach Abkühlen ist es wieder weiß (siehe Thermochromie). Im Dunkeln kann man anschließend ein schwaches Nachleuchten beobachten. Die Farbänderung ist auf einen geringen, durch Sauerstoffabgabe beim Erhitzen entstehenden Zinküberschuss (etwa 0,03 %) zurückzuführen. Dieser Zinküberschuss bzw. die Konzentration der Sauerstoff-Defekte ist stark abhängig von der Synthesemethode, Temperatur oder Verunreinigungen des Zinkoxids.
Zinkoxid ist ein direkter Halbleiter mit einer Bandlücke von 3,2…3,4 eV. Es absorbiert demzufolge UV-Strahlung und ist für sichtbares Licht transparent. Bedingt durch die nichtzentrosymmetrische Elementarzelle ist Zinkoxid piezoelektrisch.
Die elektrische Leitfähigkeit von Zinkoxid kann durch Dotierung mit geeigneten Elementen erhöht werden. Häufig wird dazu Aluminium (Aluminiumdotiertes Zinkoxid, AZO) oder Bor benutzt. Andere Elemente für eine N-Dotierung wie Indium oder Gallium werden momentan nicht eingesetzt. P-dotiertes Zinkoxid ist schwieriger herzustellen und ein Bereich der aktuellen Forschung.
Zinkoxid ist in Wasser unlöslich, während verdünnte Säuren es unter Salzbildung lösen. Mit Alkali, wie z. B. Natronlauge, frisch gefälltes, hydratisiertes Zinkoxid löst sich bei einem Überschuss an Base wieder auf. Dabei entsteht ein lösliches Zinkat.
Wird die Verbindung mit Cobalt(II)-oxid (CoO) erhitzt, so entsteht eine grüne feste Lösung von Cobaltoxid in Zinkoxid (Rinmans Grün).
Verwendung
Pigment
Zinkoxid wird unter der Bezeichnung Zinkweiß als Pigment genutzt.[8] Daneben findet man auch Bezeichnungen wie Chinesischweiß, Ewigweiß oder Schneeweiß. Im Gegensatz zu Bleiweiß-Anstrichen ist es schwefelwasserstoff- und lichtbeständig, aber weniger deckend. Daher wurden als Malerfarbe oft Mischungen aus Blei- und Zinkweiß verwendet. Zinkweiß ist mit allen Pigmenten gut verträglich. Alkalische Bindemittel sollten aber vermieden werden, da die Gefahr einer Zinkatbildung besteht. In Öl können sich begrenzt Zinkseifen bilden.[9] Zinkweiß wurde vielfach in wässrigen Techniken eingesetzt, wie z. B. in Leim-, Aquarell- und Gouachefarben. Es war im Altertum bereits unter Cadmea (genannt auch Cadmia[10] und auch für andere Zinkverbindungen benutzt)[11] und Pompholyx[12] (als gereinigter Ofenbruch Tutia praeparata, in ungereinigtem Zustand auch Tutia genannt[13]) bekannt. Die Alchimisten nannten es Nix alba (weißer Schnee) oder Nihilum album („weißes Nichts“, auch Nihil album[14][15]). Im Jahr 1782 ersetzte Bernard Courtois mit Louis Bernard Guyton de Morveau in Dijon Blei- durch Zinkweiß, 1850 wurde es kommerziell zu Ölfarben verarbeitet. Seit 1834 gibt es Zinkweiß auch als Wasserfarbe.[16] Zinkweiß wurde erst langsam von den Künstlern als Ersatz für Bleiweiß angenommen. Es gab regelrechte Streitereien über seine Verwendung. Da Zinkweiß einfach kühler wirkt, wurde es schließlich hauptsächlich für die Mischung mit kühlen Farbtönen verwendet, während Bleiweiß mit den wärmeren Farben vermischt wurde. Die Verwendung von Zinkweiß als Deckfarbe geht heute mehr und mehr zugunsten derer von Titanweiß zurück.[9]
Fotografie
Einseitig mit Zinkoxid beschichtetes Papier fand früher (bis um 1970) beim direkten Verfahren der Elektrofotografie (elektrostatisches Kopierverfahren) Verwendung.[17]
Das sogenannte ZINK-Papier der („Zero-Ink“) Zink-Drucktechnik enthält hingegen kein Zink.
Halbleiter
Zinkoxid findet Verwendung als Deckschicht bei der Herstellung blauer Leuchtdioden (LED), von Flüssigkristallanzeigen (LCD), Varistoren (VDR) und Dünnschicht-Solarzellen. Hierzu wird es meist mit Aluminium dotiert ZnO:Al, (ZOA =Zinkoxid-Aluminium).[9] Die Dotierung erhöht die Leitfähigkeit um mehrere Größenordnungen.
Nano-Whisker aus Zinkoxid zeigen Photoleitung im Ultraviolettbereich.[18]
Zinkoxid-Keramik wird üblicherweise zur Herstellung von Metalloxid-Varistoren verwendet. Es zeigt hier aufgrund von halbleitenden Effekten an den Korngrenzen einen stark nichtlinear von der angelegten Spannung abhängigen Widerstand und dient als Überspannungsschutz.
Wärmeleitpaste
Zinkoxidpulver ist ein gängiger Zusatz von Wärmeleitpasten und erhöht erheblich deren Wirksamkeit.
Medizin
Als Bestandteil pharmazeutischer Zinksalben bzw. -pasten (z. B. Penaten-Creme), Sonnenschutzmitteln und Zinkleimverbänden führt Zinkoxid zu einer Austrocknung der Hautoberfläche. Dies nutzt man zum Beispiel bei Intertrigo, Windeldermatitis und anderen nässenden Wunden.
Bei Fußpilz und anderen Dermatomykosen unterstützt Zinkoxid die Heilung.[9] Zinkoxid wirkt antibakteriell und adstringierend[19]
Seit 1888 wird Zinkoxid auch in Deodorants verwendet, da es leicht antibakteriell wirkt.[20]
Weitere Anwendungen
Als Zusatz bei der Vulkanisation von Kautschuk findet Zinkoxid Verwendung.[9]
Zinkoxid kommt als Leuchtstoff in Leuchtstofflampen zum Einsatz. Selbstaktiviertes Zinkoxid (ZnO:Zn) findet als Kathodolumineszenz-Leuchtstoff im Magischen Auge Verwendung; es zeigt blaugrüne Lumineszenz.[21]
Abgereichertes Zinkoxid (DZO) wird dem Kühlwasser von Kernreaktoren (Siedewasserreaktoren) beigegeben, um das Korrosionsverhalten der mit dem Kühlwasser in Berührung kommenden Komponenten zu verbessern.[9]
Zinkoxid-Nanopartikel können als UV-Absorber in Lebensmittelverpackungen dienen.[22]
Forscher des Schweizer Paul-Scherrer-Instituts versuchen, die Sonnenkraft in chemische Energie umzusetzen. Sie fokussieren dazu Sonnenstrahlen auf einen Schmelztiegel. Das Licht trifft bei über 1200 °C auf Zinkoxid, das daraufhin verdampft und zu metallischem Zink umgewandelt wird, wenn dafür gesorgt wird, dass das entstehende Zink nicht sofort wieder oxidiert. Da dieses gelagert und transportiert werden kann, lässt sich so die Energie der Sonne speichern und später z. B. in Zink-Luft-Batterien direkt als elektrische Energie oder zur Produktion von Wasserstoff nutzen. Das ist vereinfacht dargestellt, denn aus den Zink-Luft-Batterien wird das entladene Zn-ZnO zusammen mit Kaliumhydroxid entnommen.[9]
Risikobewertung
Zinkoxid wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Zinkoxid waren die Besorgnisse bezüglich Verbraucherverwendung, Umweltexposition, anderer Exposition/risikobasierter Bedenken, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung läuft seit 2017 und wird von Deutschland durchgeführt.[23]
Einzelnachweise
- Zinc. In: Encyclopædia Britannica. 11. Auflage. Band 28: Vetch – Zymotic Diseases. London 1911, S. 984 (englisch, Volltext [Wikisource]).
- Eintrag zu ZINC OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Zinkoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- Eintrag zu Zinkoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Februar 2017. (JavaScript erforderlich)
- Eintrag zu Zinc oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1314-13-2 bzw. Zinkoxid), abgerufen am 2. November 2015.
- Umicore Zinc Chemicals: ZINC OXIDE APPLICATIONS (Memento des Originals vom 7. November 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Olaf Lückert: Pigment + Füllstoff Tabellen. Vincentz Network GmbH & Co KG, 2002, ISBN 3-87870-744-4, S. 74 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hermann Sicius: Zinkgruppe: Elemente der zweiten Nebengruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2017, ISBN 978-3-658-17868-0, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 137 (Cadmia: C.lota, C. usta = gebrannter Galmei, Zinkkalk, Zinkoxyd).
- Roderich König, Gerhard Winkler (Hrsg.): C. Plinius Secundus d. Ä., Naturkunde. Lateinisch–deutsch. Buch XXXIII: Metallurgie. 2. Auflage, Artemis & Winkler, Düsseldorf 2007, ISBN 978-3-7608-1613-5, S. 159 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl Bayer, Kai Brodersen (Hrsg.): C. Plinius Secundus d. Ä., Naturkunde. Gesamtregister. Artemis & Winkler, Düsseldorf/Zürich 2004, ISBN 3-7608-1705-X, S. 243 (eingeschränkte Vorschau in der Google-Buchsuche).
- Otto Zekert (Hrsg.): Dispensatorium pro pharmacopoeis Viennensibus in Austria 1570. Hrsg. vom österreichischen Apothekerverein und der Gesellschaft für Geschichte der Pharmazie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, S. 152 (Pompholyx: Nihil album, Hüttenrauch, Zinkoxyd) und 158 (Tutia).
- www.thefreedictionary.com.
- Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 105 (Nichts oder Galmeyflug, nihil: „Ist die ausgelöschte Asche von Metallen, wenn sie weiß ist, nihil album und pompholix, die graue aber grau nihil grisium und spodium genannt wird“).
- William Jervis Jones: Historisches Lexikon deutscher Farbbezeichnungen. Walter de Gruyter, 2013, ISBN 978-3-05-006322-5, S. 3135 (eingeschränkte Vorschau in der Google-Buchsuche).
- G: Römpp Lexikon Chemie. 10. Auflage. Band 2: Cm–G. Georg Thieme Verlag, 2014, ISBN 978-3-13-199971-9, S. 1131 (eingeschränkte Vorschau in der Google-Buchsuche).
- https://iopscience.iop.org/article/10.1088/0957-4484/16/8/031 Sanjeev Kumar et al.: Synthesis of photoconducting ZnO nano-needles using an unbalanced magnetron sputtered ZnO/Zn/ZnO multilayer structure, in Nanotechnology 16 1167, Jg. 2005
- https://www.stern.de/gesundheit/haut/zinksalbe-gegen-pickel--wunderwaffe-der-natur-9147756.html Anna Stefanski: Hautunreinheiten: Warum Zinksalbe gegen Pickel wirklich helfen kann, in Stern, 6. Jan. 2021, abgerufen am 14. Jan. 2021
- Birger Konz, Gerd Plewig: Fortschritte der Dermatologie - Ein Rückblick auf 50 Jahre anlässlich des 80. Geburtstages. Springer-Verlag, 2013, ISBN 978-3-642-57539-6, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
- Werner Espe: Werkstoffkunde Der Hochvakuumtechnik: Bd. 3 Hilfswerkstoffe. Deutscher Verlag der Wissenschaften, 1961, OCLC 316813787, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).
- Safety assessment of the substance zinc oxide, nanoparticles, for use in food contact materials. In: EFSA Journal. 14, 2016, doi:10.2903/j.efsa.2016.4408.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Zinc oxide, abgerufen am 26. März 2019.