Zinksulfat
Zinksulfat (ZnSO4) ist das Zinksalz der Schwefelsäure (Trivialnamen: schwefelsaures Zinkoxid, Zinkvitriol, Weißer Vitriol, Vitriolum album, (Weißer) Kupferrauch, (Weißer) Galitzenstein, Augenstein). Es bildet farblose Kristalle, in wasserfreier Form ist es ein weißes Pulver.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
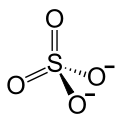 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinksulfat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farblose, rhomboedrische Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
A12CB01 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse |
| ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
680 °C (Zersetzung)[3] | ||||||||||||||||||
| Löslichkeit |
leicht in Wasser (Monohydrat: 350 g·l−1 bei 20 °C; Heptahydrat: 965 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Zinksulfat tritt relativ selten in Form von einigen Kristallhydrat-Mineralien (Zn[SO4]·xH2O), namentlich den Heptahydraten Goslarit und Zinkmelanterit, dem Hexahydrat Bianchit, dem Tetrahydrat Boyleit und dem Monohydrat Gunningit sowie sehr selten als wasserfreies Mineral Zinkosit auf.[5]
Gewinnung und Darstellung
Zinksulfat wird durch Auflösen von Zink oder Zinkoxid in verdünnter Schwefelsäure hergestellt:
Man kann es auch durch Einwirkung von Zink auf die meisten Schwermetallsulfate gewinnen, wobei das Schwermetall in elementarer Form ausfällt. Beispiele hierfür sind:
- .
- .
Es entsteht durch oxidative Verwitterung von Zinkblende (Zinksulfid, ZnS)
- .
Das so entstandene Mineral ZnSO4·7H2O wird als Goslarit bezeichnet.
Die Grillo-Werk AG betreibt in ihrem Werk Duisburg-Hamborn die größte Zinksulfat Produktion Europas.[6]
Eigenschaften

Zinksulfat zersetzt sich bei Temperaturen oberhalb von 680 °C. Oberhalb von 930 °C verbleibt reines Zinkoxid.
Es kristallisiert aus seinen wässrigen Lösungen als Zinkvitriol („Weißer Galitzenstein“[7]) in farblosen, rhombischen Kristallen mit 7 Molekülen Wasser (ZnSO4 · 7 H2O) (Heptahydrat). Es verliert beim Erhitzen seine Wasseranteile und zerfällt zu einem weißen Pulver („Kupferrauch“[8]). Zinksulfat zeigt in wässriger Lösung infolge teilweiser Hydrolyse eine schwach saure Reaktion. Beim Lösen des wasserfreien Salzes in Wasser tritt Erwärmung ein, beim Lösen von ZnSO4 · 7 H2O dagegen Abkühlung.
Es verwittert oberflächlich an der Luft durch Verlust von Kristallwasser und schmilzt beim Erwärmen in seinem Kristallwasser. Es verliert schon bei 39 °C ein Molekül Kristallwasser; bei 70 °C liegt nur noch ein Wassermolekül vor, das bei 240 °C abgespalten wird.[2]
Verwendung
Zinksulfat wird in der Färberei, zur Holzimprägnierung und zur Herstellung von Elektrolysezink verwendet. Auf Grund der bakterientötenden Wirkung von Zn2+-Ionen werden stark verdünnte Lösungen von ZnSO4 (0,1–0,5 %) als Augenwasser bei Bindehautentzündungen eingesetzt.
Man benutzt Zinksulfat ferner:
- in der Kattundruckerei
- zum Konservieren von Holz und Häuten
- als Flammschutzmittel
- als Zusatz zu Firnis, um das Öl schnell trocknend zu machen
- bei der Feuerversilberung
- als Wirkstoff gegen Herpes labialis[9]
- als bakteriziden Wirkstoff in Zahnpasta
- als Flotationshilfsmittel in der Minenindustrie
Es dient weiterhin als Brechmittel, Beize in der Textilindustrie, Spurennährstoff in Düngemitteln und ist in Fällungsbädern bei der Kunstseidegewinnung enthalten. Zinksulfat wird auch zur Herstellung von Zinksulfid-Pigmenten und anderen Zinkverbindungen, zur Flotation von Erzen, Beschweren von Baumwolle und in galvanischen Verzinkungsbädern verwendet.[3]
Nachweis
Natronlauge (NaOH) gibt mit Zinksulfat einen gallertartigen Niederschlag von Zinkhydroxid, der nach Befeuchten mit einer verdünnten Cobaltsalzlösung und Glühen das sogenannte Rinmans Grün ergibt.
Bariumchloridlösung bildet einen weißen Niederschlag von Bariumsulfat:
- Zinksulfat und Bariumchlorid reagieren zu Zinkchlorid und Bariumsulfat, das ausfällt.
Einzelnachweise
- Eintrag zu ZINC SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Dezember 2021.
- Eintrag zu Zinksulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Juni 2014.
- Eintrag zu Zinksulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Zinc sulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- IMA/CNMNC List of Mineral Names; November 2017 (Memento vom 17. April 2018 im Internet Archive) (PDF 1,67 MB)
- Grillo-Werke AG | ZINKSULFAT. (grillo.de [abgerufen am 8. November 2018]).
- Vgl. etwa Jürgen Martin: Die ‚Ulmer Wundarznei‘. Einleitung – Text – Glossar zu einem Denkmal deutscher Fachprosa des 15. Jahrhunderts. Königshausen & Neumann, Würzburg 1991 (= Würzburger medizinhistorische Forschungen. Band 52), ISBN 3-88479-801-4 (zugleich Medizinische Dissertation Würzburg 1990), S. 129.
- Vgl. Gundolf Keil: Randnotizen zum „Stockholmer Arzneibuch“. In: Studia neophilologica. Band 44, Nr. 2, 1972, S. 238–262, hier: S. 255 (zu kopperôk).
- Pharmazeutische Zeitung Online: Herpes labialis - Neues aus Therapie und Forschung, 47/2008.


