Galvanische Zelle
Eine galvanische Zelle [galˈvaːnɪʃə t͡sɛlə], galvanisches Element oder galvanische Kette ist eine Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie. Jede Kombination von zwei verschiedenen Elektroden und einem Elektrolyten bezeichnet man als galvanisches Element, und sie dienen als Gleichspannungsquellen. Der charakteristische Wert ist die eingeprägte Spannung. Unter der Kapazität eines galvanischen Elements versteht man das Produkt aus Entladungsstromstärke mal Zeit.

Der Name geht auf den italienischen Arzt Luigi Galvani zurück. Er entdeckte, dass ein mit Instrumenten aus verschiedenartigen Metallen berührter Froschschenkel-Nerv Muskelzuckungen auslöst, da das so gebildete Redox-System als galvanisches Element Spannung aufbaut, so dass Strom fließt.
Geschichte
Der Nachweis zu frühesten galvanischen Zellen in der Antike ist umstritten; es konnte mit einem Nachbau der etwa 1800 Jahre alten Bagdad-Batterie eine elektrische Spannung erzeugt werden. Ob das originale antike Tongefäß ursprünglich zu diesem Zweck verwendet wurde, ist nicht bekannt und eine Hypothese.[1]
Die Entwicklung von galvanischen Zellen, wie sie heute üblich sind, begann in der jüngeren Neuzeit. Auslöser der Forschungsarbeiten waren Beobachtungen, die Luigi Galvani um 1780 durchgeführt hatte: Wenn er Froschschenkel mit zwei miteinander verbundenen Drähten aus verschiedenen Metallen berührte, zuckten die Muskeln. Im Jahr 1790 zeigte Alessandro Volta, dass Tierbestandteile für den Aufbau von Batteriezellen nicht notwendig sind. Er verwendet in den Folgejahren mit Kochsalzlösung getränktes Papier, welches zwischen Metallplatten aus Kupfer und Zink aufgestapelt wird und als Voltasche Säule bekannt ist.
Das Leclanché-Element wurde 1866 von Georges Leclanché patentiert und zählt zu den heute nicht mehr verwendeten „Nassbatterien“. Es stellt eine elektrische Batterie (Primärelement) dar, ist also nicht wieder aufladbar, und war in der ursprünglichen Form mit flüssigem Elektrolyt ausgestattet. Technische Verbesserungen an dem Leclanché-Element führten zu einem gelierten Elektrolyt und es stellt einen Vorläufer der Trockenbatterien wie der heute üblichen Zink-Kohle-Zelle und der Alkali-Mangan-Batterie dar.
Der Nickel-Eisen-Akkumulator, einer der ersten wiederaufladbaren Akkumulatoren (Sekundärzelle), wurde fast gleichzeitig und unabhängig voneinander von dem US-Amerikaner Thomas Alva Edison und dem Schweden Waldemar Jungner um das Jahr 1900 entwickelt. Er gilt als Vorläufer des später entwickelten und verbesserten Nickel-Cadmium-Akkumulators.
Allgemeines
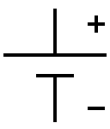
Galvanische Zellen werden systematisch in drei Gruppen unterteilt:
- Primärzellen, umgangssprachlich auch als Batterie bezeichnet. Kennzeichnend ist, dass nach Zusammenfügen die Zelle aufgeladen ist und einmalig entladen werden kann. Die Entladung ist unumkehrbar – die Primärzelle kann elektrisch nicht mehr aufgeladen werden.
- Sekundärzellen, umgangssprachlich auch als Akkumulator oder kurz Akku bezeichnet. Nach einer Entladung können Sekundärzellen durch eine gegenüber der Entladung gegenläufige Stromrichtung wieder neu aufgeladen werden. Die chemischen Prozesse in der Zelle laufen, begrenzt durch die Zyklenanzahl, umkehrbar ab. Die Energiedichte von Sekundärzellen ist im Vergleich zu Primärzellen bei gleicher Temperatur geringer.
- Brennstoffzellen, auch als Tertiärzellen bezeichnet. Bei diesen galvanischen Zellen wird der chemische Energieträger nicht in der Zelle gespeichert, sondern von außen kontinuierlich zur Verfügung gestellt. Diese Art der Zuführung ermöglicht einen kontinuierlichen und im Prinzip zeitlich unbeschränkten Betrieb.[2]
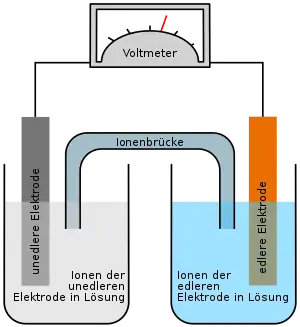
Die Funktion der galvanischen Zellen beruht auf einer Redoxreaktion. Reduktion und Oxidation laufen räumlich getrennt in je einer Halbzelle (Halbelement) ab. Durch Verbinden der beiden Halbzellen mit einem Elektronenleiter und einem Ionenleiter wird der Stromkreis geschlossen. Die Spannung des elektrischen Stroms lässt sich durch die Nernst-Gleichung berechnen. Sie hängt von der Art des Metalls (elektrochemische Spannungsreihe), der Konzentration in der Lösung der jeweiligen Halbzelle sowie der Temperatur ab. Im Gegensatz zur Elektrolyse, beispielsweise in der Galvanotechnik, kann in der galvanischen Zelle elektrische Energie gewonnen werden, während die Elektrolyse elektrische Energie benötigt.
Beim Entladen von galvanischen Zellen ist der Minuspol immer die Anode (= Pol, an dem die Oxidation stattfindet), der Pluspol immer die Kathode (= Pol, an dem die Reduktion stattfindet). Eine Eselsbrücke hierfür lautet „OMA (Oxidation, Minuspol und Anode)“. Während des Ladevorgangs von Sekundärzellen sind die chemischen Reaktionen an den Polen vertauscht: Die Oxidation findet am Pluspol statt, weswegen er dann abweichend als Anode fungiert – entsprechend ist dann der Minuspol der Ort der Reduktion und damit die Kathode. Die Eselsbrücke für die Reaktion beim Ladevorgang lautet dementsprechend: „OPA (Oxidation, Pluspol und Anode)“.
Eine galvanische Zelle liefert so lange eine Spannung, bis das chemische Gleichgewicht erreicht ist. Eine galvanische Zelle, in der kein Strom fließt, aber eine Elektrodenspannung vorliegt, befindet sich hingegen im elektrochemischen Gleichgewicht.
An der Anode findet die Oxidation statt und an der Kathode die Reduktion.
Beispiele
Neben dem Daniell-Element (Kupfer/Zink) kann so beispielsweise auch aus Kupfer- und Silberelektroden ein galvanisches Element erzeugt werden: Die Kupferelektrode taucht in eine Kupfersulfat-Lösung, die Silberelektrode in Silbersulfat-Lösung. Verbunden werden diese durch einen Draht (Elektronenleiter) mit Voltmeter und einen Ionenleiter.
Wenn beide Elektroden über einen elektrischen Leiter miteinander verbunden werden, sorgen die unterschiedlichen Redoxpotentiale der Elektroden dafür, dass die Reaktion weiterlaufen kann. Da das Redoxpotential von Kupfer niedriger ist als das von Silber, gehen an der Kupferelektrode mehr Ionen in Lösung als an der Silberelektrode. Daher ist die negative Ladung in der Kupferelektrode höher als die in der Silberelektrode, es entsteht also eine Spannung, bei der die Elektronen zur Silberelektrode hin „gedrückt“ werden. Das führt dazu, dass die Lösung der Silberatome gestoppt wird, stattdessen reagieren die überschüssigen Elektronen mit den Ag+-Ionen der Silbersulfatlösung und sorgen dafür, dass sich diese als normale Silberatome an der Silberelektrode festsetzen.
An der Silberelektrode werden also Silberionen zu elementarem Silber reduziert:
Die Silberelektrode ist damit die Kathode (Elektrode, an der die Reduktion stattfindet) und der Pluspol der galvanischen Zelle (da hier ein Elektronenmangel entsteht).
An der Kupferelektrode findet hingegen folgende Oxidation statt:
Die Kupferelektrode ist die Anode (Elektrode, an der die Oxidation stattfindet) und der Minuspol der galvanischen Zelle (da hier ein Elektronenüberschuss entsteht).
In der galvanischen Zelle läuft also eine Redoxreaktion ab, deren Reaktionsteile jedoch räumlich voneinander getrennt sind. Deswegen sind die Elektrodenräume über eine Ionenbrücke (Salzbrücke) miteinander verbunden, welche notwendig ist, um den Stromkreis zu schließen. Die Ionenbrücke ist häufig ein U-Rohr, das mit einem Elektrolyten gefüllt ist und dessen Enden mit einer Membran oder einem Diaphragma (Elektrochemie) versehen sind. Über die Salzbrücke erfolgt Ionendiffusion, um so der Aufladung der einzelnen Zellen entgegenzuwirken. Eine andere Möglichkeit, die Elektrodenräume voneinander zu trennen, besteht in einer selektivpermeablen (ausgewählt durchlässigen) Membran, welche ebenfalls einen Ladungsausgleich ermöglicht. Über die Ionenbrücke wandern also die Salzionen (in diesem Fall Nitrationen) von der Kathode zur Anode, also von der Silberhalbzelle zur Kupferhalbzelle.
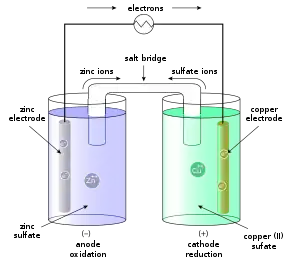
Bei dem Daniell-Element handelt es sich um ein Zink-Kupfer-Zelle. Die Zinkhalbzelle ist aufgrund des unedleren Charakters des Zinks die Halbzelle, in der vornehmlich die Oxidation der Zink-Atome erfolgt, denn unedlere Metall haben eine Tendenz zur Elektronenabgabe.
An dieser Donatorhalbzelle (die Halbzelle die Elektronen abgibt) liegt ein Elektronenüberschuss vor; Sie bildet den Minuspol.
Vom Zinkstab fließen nun Elektronen über die leitende Verbindung zum Pluspol, dem Kupferstab. Die Kupferhalbzelle ist die Akzeptorhalbzelle, da hier die Reduktion stattfindet. Im Kupferstab herrscht Elektronenmangel.
Würden nur die beiden Elektrodenreaktionen ablaufen, müsste sich die Lösung der Zinkhalbzelle positiv und die der Kupferhalbzelle negativ aufladen und der Elektronenfluss würde zum Erliegen kommen. Die Gesamtladung in den Halbzellen verändert sich jedoch nicht, da durch das Wandern von Kationen und Anionen ein Ladungsausgleich in den Lösungen entsteht.
Es gibt auch galvanische Zellen mit zwei gleichen Halbzellen, die sich in ihrer Konzentration unterscheiden, diese nennt man Konzentrationselement. Der Deflagrator ist ebenfalls eine Galvanische Zelle.
Verkürzte Schreibweise
Eine galvanische Zelle wird auch manchmal in verkürzter Schreibweise beschrieben. Das oben grafisch dargestellte Daniell-Element sähe in dieser Schreibweise folgendermaßen aus:
Beide Halbzellen werden in einer galvanischen Zelle durch ein Diaphragma, also eine dünne, halbdurchlässige Membran (semipermeable Membran) getrennt. Durch diese Membran werden fast ausschließlich die negativ geladenen Anionen hindurchgelassen. Im Falle des Daniell-Elements sind das SO42−-Ionen (Sulfationen), welche in den Salzlösungen beider Halbzellen vorhanden sind.
Dieses Diaphragma wird in der verkürzten Schreibweise durch den doppelten senkrechten Strich (||) dargestellt. Rechts und links von diesem doppelten Strich werden die beiden Halbzellen der galvanischen Zelle und die darin stattfindenden Reaktionen verkürzt dargestellt. Zudem wird die Konzentration der Metallsalzlösung, also die Konzentration der gelösten Metalle in beiden Halbzellen angegeben. Die Anodenhalbzelle steht üblicherweise links.[3]
Weblinks
- Verständliche, einfache Erklärung der galvanischen Zelle mit anschaulicher Animation
- Galvanisches Element Informationen
- Flash-Animation auf Englisch
- Videotutorial zur Galvanischen Zelle
- Video: Was passiert an den Elektroden? – Strom und Spannung bei Elektrolyse und Galvanischen Zellen. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15232.
Einzelnachweise
- Roland M. Horn: Menschheitsrätsel: Von Atlantis bis zum Sirius, ISBN 978-3-7418-3767-8 (Teilvorschau online)
- Michael Buchholz: Subspace-Identification zur Modellierung von PEM-Brennstoffzellen-Stacks. KIT Scientific Publishing, 2010, ISBN 978-3-86644-477-5, S. 109.
- Elemente Chemie II - Gesamtband, ISBN 3-12-756700-6, S. 157.