Kohlensäure
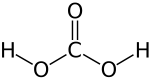
Kohlensäure (H2CO3) ist eine anorganische Säure und das Reaktionsprodukt ihres Säureanhydrids Kohlendioxid (CO2) mit Wasser. Die Salze der zweiprotonigen Säure sind die Carbonate und Hydrogencarbonate. Ihre Ester werden ebenfalls Carbonate oder Kohlensäureester genannt. Technische Bedeutung haben die Polyester, die als Polycarbonate bezeichnet werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kohlensäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | H2CO3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 62,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
existiert bei Anwesenheit von Wasser nur gelöst[2] | ||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Das Gas CO2 ist im Vergleich zu O2 und N2 relativ gut löslich in Wasser und reagiert zu einem geringen Anteil (etwa 0,2 %, je nach Temperatur und Druck) zu Kohlensäure:
Das Gas CO2 wird umgangssprachlich oft ungenau als Kohlensäure bezeichnet. Tatsächlich wird in der Wasserchemie gelöstes CO2 mit der eigentlichen Säure H2CO3 üblicherweise als freie Kohlensäure zusammengefasst. Sie steht der Summe von Carbonat und Hydrogencarbonat als der gebundenen Kohlensäure gegenüber.
Kohlensäure spielt eine wichtige Rolle im Säure-Basen-Haushalt sowohl des Wassers als auch des Blutes und der Körperflüssigkeiten.
Geschichte
Die Natur der Kohlensäure als gelöstes Kohlendioxid erkannte 1741 William Brownrigg. Für die Erfindung des Sodawassers ist allerdings Joseph Priestley bekannt (in seiner Zeit als Priester in Leeds ab 1767, wo ihm genug Kohlendioxid aus einer nahen Brauerei zur Verfügung stand).
Vorkommen in der Natur
Im Regenwasser gelöstes Kohlendioxid bildet Kohlensäure, die Kalkgestein unter Bildung von Calciumhydrogencarbonat zu lösen vermag:[7]
Tropft solches Wasser in einen unterirdischen Hohlraum, so scheidet sich aus dem hängenden Tropfen durch Abdampfen von Kohlendioxid aus dem löslichen Hydrogencarbonat das schwerlösliche Calciumcarbonat als Stalaktit ab; fällt der Tropfen zu Boden, wird am Boden weiteres Calciumcarbonat abgeschieden und es entsteht ein Stalagmit:[7]
Dissoziationsgleichgewicht
Gelöstes Kohlenstoffdioxid steht in wässriger Lösung im Gleichgewicht mit Kohlensäure:
- (1)
Die Erlenmeyer-Regel beschreibt die Instabilität von Molekülen mit zwei Hydroxygruppen am selben Kohlenstoff-Atom. Daher liegt das Gleichgewicht sehr weit auf der Seite des Anhydrids; der Anteil des Säuremoleküls liegt in wässriger Lösung bei nur rund 0,2 %. Dieser Anteil ist mäßig von der Temperatur abhängig. In Organismen wird die Reaktion durch das Enzym Carboanhydrase beschleunigt. Die vergleichsweise langsam erfolgende Hydration von CO2 wird durch das Enzym katalysiert, wodurch physiologisch ausreichende Geschwindigkeiten der Austauschprozesse erreicht werden. Ein Enzymmolekül katalysiert dabei die Umwandlung von etwa 36 Millionen CO2 in H2CO3-Moleküle pro Minute.[3]
Die Kohlensäure ist eine zweiprotonige Säure. Sie gibt daher ihre Protonen in zwei Dissoziationsstufen an Wasser oder andere Basen ab:
- (2)
Der pKs-Wert der ersten Säurekonstante kann lediglich berechnet werden. Er liegt mit temperaturabhängigen Abweichungen eigentlich bei ca. 3,6. Kohlensäure ist damit eine mittelstarke Säure vergleichbar mit Essigsäure (pKs 4,76) und Ameisensäure (pKs 3,77). Da aber der Anteil der Kohlensäure gemäß Gleichung (1) schlecht zu bestimmen ist, werden die Reaktionen (1) und (2) zu (3) zusammengefasst:[3]
- (3)
und ergeben den (fast immer genannten und experimentell bestimmbaren) Wert von ca. 6,5 für den pKs-Wert. Freie Kohlensäure ist damit eine schwache Säure.[3]Reaktionsprodukt ist das Hydrogencarbonat-Ion HCO3−.
- (4)
Der pKs-Wert für die zweite Säurekonstante liegt um 10,5. Reaktionsprodukt ist das Carbonat-Ion CO32−.
Die Konzentrationen der drei (eigentlich vier) Kohlensäure-Spezies, also der freien Kohlensäure (H2CO3 und gelöstes CO2), des Hydrogencarbonats und des Carbonats sowie der Oxoniumionen stehen miteinander durch das Massenwirkungsgesetz in einem berechenbaren Zusammenhang. Die Konzentration der Oxoniumionen wird durch den pH-Wert ausgedrückt. Bei einem gegebenen pH-Wert ist somit das Mengenverhältnis der Spezies festgelegt.
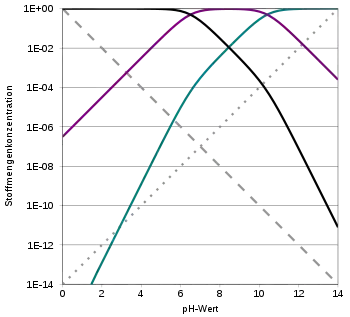
pH-Indikation Wasser
- Bei pH 4 liegen über 99 % als Kohlendioxid/Wasser-Mischung vor. (z. B. in Mineralwasser)
- Bei einem pH-Wert von 6,5, der also gleich ist dem pKs der ersten Säurekonstante, liegt daneben gleich viel Hydrogencarbonat vor; der Anteil des Carbonats ist noch weit unter 1 %.
- Bei ca. pH 7,5 in Leitungswasser bestimmt das enthaltene Hydrogencarbonat in Verbindung mit wenig gelöstem Kohlendioxid den Säurehaushalt. (menschliches Blut mit pH 7,4 enthält Kohlendioxid und Hydrogencarbonat im Verhältnis 1 : 24)
- Etwa bei pH 8,3 liegt der maximale Anteil an Hydrogencarbonat mit ca. 98 % vor; je knapp 1 % sind Kohlendioxid und Carbonat. Dies ist der typische pH-Wert von Natrium- oder Kaliumhydrogencarbonat in Wasser. Auch abgekochtes Trinkwasser zeigt diesen pH, da gelöstes Kohlendioxid ausgetrieben wurde.
- Bis fast zur Trockene eingekochtes Trinkwasser zeigt einen pH von bis zu 9, da sich hierbei ein geringer Hydrogencarbonat-Anteil in Carbonat umwandelt (siehe Kesselstein-Bildung).
- Bei einem pH gleich dem pKs der zweiten Säurekonstante von 10,5 liegen gleiche Mengen Hydrogencarbonat und Carbonat sowie ein verschwindend geringer Anteil an Kohlendioxid vor.
- Bei pH 12,5 hat das Carbonat einen Anteil um 99 %, Hydrogencarbonat liegt bei knapp 1 %. Dies ist der typische pH-Wert von Natrium- oder Kaliumcarbonat in Wasser.
Diese Eckwerte spiegeln die Zusammenhänge im vielfach genutzten Bicarbonat-Puffer wider.
Verwendung
Kohlensäure wird für unzählige Produktionsprozesse weltweit eingesetzt, wobei sie dem Endverbraucher wohl am ehesten aus Erfrischungsgetränken bekannt sein dürfte. Jacob Schweppe entwickelte im späten 18. Jahrhundert ein Verfahren, mittels dessen sich Wasser mit Kohlenstoffdioxid versetzen lässt. Im 19. Jahrhundert begann man, Mineralwasser Kohlenstoffdioxid beizumischen, um dieses haltbar zu machen.
Siehe dazu Verwendung von Kohlenstoffdioxid in der Lebensmitteltechnologie.
Kohlensäure als Reinsubstanz
Durch Entwässern einer CO2-Lösung (Verdampfen oder Gefrieren des Wassers) lässt sich die mit Kohlendioxid im Gleichgewicht stehende Kohlensäure H2CO3 = C=(OH)2 ebenso wenig wie die Orthokohlensäure H4CO4 = C(OH)4 oder die Dikohlensäure H2C2O5 = (HO)OC—O—CO(OH) isolieren, da hierbei wegen der Überschreitung der Löslichkeit das Anhydrid CO2 entweicht. Auch die Peroxomono- und -dikohlensäure H2CO4 = CO(OH)(OOH) und (HO)OCCO(OH) lassen sich als solche nicht aus konzentrierten wässerigen Lösungen isolieren.[3]
Im Labor ist es gelungen, Kohlensäure (im engeren Sinn) als reine (vermutlich kristalline) Reinsubstanz zu erzeugen, wobei es in zwei unterschiedlichen Modifikationen existiert. Die α-Form der Kohlensäure wird bei der Synthese in Methanol erhalten. Die β-Form der Kohlensäure wird durch Bestrahlung von festen Mischungen aus Kohlendioxid und Wasser mit Protonen oder durch Protonierung von Carbonat mit Bromwasserstoff-Hexahydrat bei −73 °C gebildet. Dies hat derzeit jedoch (außer dem möglichen Auftreten als Bestandteil stratosphärischer Wolken der oberen Atmosphäre, in interstellaren Eispartikeln, auf Kometen, in extrasolarer Körper sowie auch auf der Marsoberfläche und/oder Marsatmosphäre[3]) keine praktische Bedeutung.[7]
Bei tiefen Temperaturen und unter absoluter Abwesenheit von Wasser oder Metallionen (beide katalysieren stark die Zersetzungsreaktion zu Kohlenstoffdioxid und Wasser) kann die Kohlensäure H2CO3 als Reinstoff dargestellt werden.
In absoluter Reinheit hat die Verbindung bei Raumtemperatur die einer Halbwertszeit von 180.000 Jahren entspricht. Die Zugabe eines einzigen Wassermoleküls zum Kohlensäuremolekül erhöht durch Autokatalyse die Reaktionsgeschwindigkeit um einen temperaturabhängigen Faktor von 107−109, d. h., die Halbwertszeit wird auf 10 Stunden bei 300 K erniedrigt. Die Zugabe eines weiteren Wassermoleküls beschleunigt die Reaktion um einen weiteren Faktor 100 bis 1000, was zu einer Halbwertszeit von 119 Sekunden bei 300 K führt. Das ist der Grund, aus dem die meisten Chemiker "Kohlensäure" für instabil halten. Statt Kohlensäure meinen sie jedoch Kohlendioxid in Wasser gelöst (was zu einem Gleichgewicht von 1 % H2CO3 und 99 % schwach hydratisiertem CO2 sowie saurem Verhaltem wegen des H2CO3/HCO3-Säure-Base-Paares führt). Kristalline und amorphe Kohlensäure ist damit in einer Eis-Matrix bei 225 K kinetisch bemerkenswert stabil darstellbar. Diese Stabilität auch im gasförmigem Zustand in Abwesenheit von Wasser lässt Schlüsse auf deren Bildung und Nachweisbarkeit im Weltall zu. Feste Kohlensäure bildet sich nicht nur durch Protonenbestrahlung von festen CO2/H2O-Gemischen, sondern auch von reinem, festen CO2.[8] Sie besteht aus einem Netzwerk miteinander über H-Brücken verknüpfter H2CO3-Moleküle.[3] Gasförmige Kohlensäure liegt in einer Mischung aus H2CO3-Monomeren und Dimeren vor, deren Mischungsverhältnis von der Temperatur abhängt.[8]
Derivate der Kohlensäure
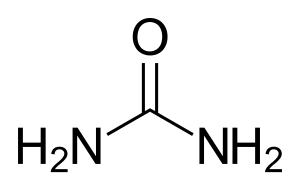
Darüber hinaus sind organische Derivate der Kohlensäure bekannt, so verschiedene Kohlensäureester. Sie sind leicht zugänglich durch die Reaktion von Phosgen mit Alkoholen. Polyester der Kohlensäure sind die Polycarbonate. Eine andere Stoffgruppe sind die Amide der Kohlensäure. Ihre Stammverbindung ist der Harnstoff, ein Diamid der Kohlensäure; als Beispiel seien die Urethane (von Urea, Harnstoff) genannt. Es sind substituierte Ester des Monoamids der Kohlensäure, der Carbaminsäure; diese sind die Stammverbindungen überaus wichtiger Kunststoffe, der Polyurethane.
Aggressive Kohlensäure und Verwandte
Eine weitere Gruppe von Trivialnamen, die nicht chemisch unterschiedliche Spezies, sondern Mengenanteile bezeichnen, stammt aus dem Bereich der Wasserchemie für kalkhaltige Wässer. Es sei darauf hingewiesen, dass die folgenden Begriffe jeweils Mengenanteile der sogenannten freien Kohlensäure betreffen, bei denen zwischen Kohlenstoffdioxid und der Kohlensäure im engeren Sinn nicht unterschieden wird.
Entsprechend dem Kalk-Kohlensäure-Gleichgewicht sind die Konzentrationen von Calcium und Kohlensäure voneinander abhängig. Man unterscheidet die Menge der zugehörigen Kohlensäure von der Menge der überschüssigen und der (kalk-)aggressiven Kohlensäure. Zugehörige Säure hält im Mengengleichgewicht der Kohlensäurespezies den pH-Wert gerade so niedrig, dass die hiervon abhängige Konzentration des Carbonates multipliziert mit der des Calciums gerade noch nicht das Löslichkeitsprodukt des Calciumcarbonats überschreitet. Darüber hinaus vorhandene freie Kohlensäure gilt als überschüssig. Davon wiederum ein Teil könnte weiteren Kalk in Lösung bringen, ist also (kalk-)aggressiv; der Rest des Überschusses würde danach als zusätzliche zugehörige Kohlensäure benötigt.
Mit steigenden Werten für die Carbonathärte steigt der Anteil der zugehörigen freien Kohlensäure überproportional an. Beispielsweise beträgt dieser Wert bei 5,1 °dH 1,83 mg/l CO2 und bei 10,2 °dH 11,67 mg/l CO2. Dies führt bei der Mischung von Wässern zu einem Mischwasserproblem. Die Mischung von Wässern mit unterschiedlicher Carbonathärte ergibt Mischwässer mit aggressiver Kohlensäure, selbst wenn die Ausgangswässer im Kalk-Kohlensäure-Gleichgewicht waren.
Die mathematischen Zusammenhänge sind in der Tillmansschen Gleichung zusammengefasst, mit der die zugehörige „freie Kohlensäure“ für jeden Gehalt an Calcium berechnet werden kann. Nachfolgend die Kurzfassung dieser Gleichung:
Die Elemente der Gleichung bedeuten:
- = Konzentration der zu berechnenden zugehörigen freien Kohlensäure (CO2) in mol/kg
- = Tillmanssche Konstante
- = Quadrat der Konzentration der Hydrogencarbonate (HCO3) in mol/kg
- = Konzentration des Calciums in mol/kg
Weitere Einzelheiten hierzu unter Tillmanssche Gleichung.
Für die Aufbereitung und Entkarbonisierung von Wässern ist die genaue Kenntnis dieses Gleichgewichtes und seiner Einstellgeschwindigkeit von großer Bedeutung. So wird bei der Trinkwasseraufbereitung das Rohwasser über halbgebranntes Dolomit (Calciummagnesiumcarbonat, CaMg(CO3)2) geleitet, damit es keine überschüssige „freie Kohlensäure“ enthält, da Eisen oder andere Metalle mit dieser reagieren und so beispielsweise Rohrleitungen aus Stahl korrodieren würden. Auch diese Reaktionen sind konzentrationsabhängig im Gleichgewicht mit entsprechenden Carbonaten. Deshalb spricht man dann z. B. von „Eisen-aggressiver Kohlensäure“. Dolomit wird verwendet, weil in Anwesenheit von Magnesiumionen die Einstellgeschwindigkeit des Tillmans’schen Gleichgewichtes erheblich beschleunigt wird, was mit reinem Calciumcarbonat viel zu lange dauern würde.
Bei manchen Anwendergruppen, z. B. in der Fischerei, werden die hier genannten Mengenbegriffe oft so missverstanden, als ob z. B. die „aggressive Kohlensäure“ besonders schädlich wäre, etwa für die Fische. Da aber Fische nicht aus Kalk bestehen, richtet sich die aggressive Kohlensäure nicht in anderer Weise gegen sie als der Rest der Kohlensäure. Für die Atmung der Fische ist vielmehr die gesamte gelöste CO2-Konzentration ausschlaggebend, für eine allfällige sauere Verätzung ausschließlich der pH-Wert des Wassers. Die „zugehörige Kohlensäure“ wird dort so missverstanden, als ob sie in besonderer Weise an das Hydrogencarbonat gebunden und deshalb nicht durch Wasserbelüftung auszutreiben oder durch Photosynthese von Algen zu verbrauchen wäre. Tatsächlich steht beiden Vorgängen die gesamte „freie Kohlensäure“ zur Verfügung, so dass es zu einer Steigerung des pH-Wertes, dadurch zu einer Verschiebung des Mengengleichgewichts hin zu mehr Carbonat und dadurch schließlich zu einer Überschreitung des Löslichkeitsproduktes des Kalkes, also zu einer Kalkfällung kommt. Siehe dazu auch Kalk-Kohlensäure-Gleichgewicht.
Literatur
- Ulrich Kölle: Rund um Kohlensäure. In: Chemkon.10, Nr. 2, 2003, S. 66–68.
- Th. Loerting, Chr. Tautermann, R. T. Kroemer: On the Surprising Kinetic Stability of Carbonic Acid. In: Angew. Chem. Int. Ed. 39, Nr. 5, 2000, S. 891–894.
deutsch: Th. Loerting, Chr. Tautermann, R. T. Kroemer: Zur überraschenden kinetischen Stabilität von Kohlensäure. In: Angew. Chem. 112, 2000, S. 919–922 (doi:10.1002/(SICI)1521-3757(20000303)112:5<919::AID-ANGE919>3.0.CO;2-Y). - Kurt Bauer: Zur Bedeutung der Kohlensäure in Karpfenteichen. In: Österreichs Fischerei 44, 1991, S. 49–64.[9]
- Julius Pia: Kohlensäure und Kalk – Einführung in das Verständnis ihres Verhaltens in den Binnengewässern. In: Die Binnengewässer. Bd. XIII, Schweizerbart, Stuttgart 1933, ISBN 978-3-510-40713-2.
- H. E. Hömig: Physikochemische Grundlagen der Speisewasserchemie. 2. Auflage, Vulkan-Verlag, Essen 1963, Kap. 2.25–2.30.
Einzelnachweise
- Eintrag zu CARBONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. März 2020.
- RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999: Band 3: H - L. Georg Thieme Verlag, 2014, ISBN 978-3-13-199991-7, S. 2199 (books.google.com).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- K. Adamczyk, M. Prémont-Schwarz, D. Pines, E. Pines und E. T. J. Nibbering: Real-Time Observation of Carbonic Acid Formation in Aqueous Solution. In: Science. 2009, 326, S. 1690–1694, doi:10.1126/science.1180060. – C. Ho and J. M. Sturtevant The Kinetics of the Hydration of Carbon Dioxide at 25. In: J. Biol. Chem. 238, 3499–3501 (1963) PDF.
- D.H. Ripin, D.A. Evans: pKa's of Inorganic and Oxo-Acids (Englisch, PDF) Abgerufen am 15. Juli 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Kohlensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Januar 2022.
- Bericht: uni-protokolle.de. - T. Loerting, C. Tautermann, R. T. Kroemer, I. Kohl, A. Hallbrucker, E. Mayer, K. R. Liedl: in Angewandte Chemie 2000, 112, 919–922. Zur überraschenden kinetischen Stabilität von Kohlensäure (H2CO3), doi:10.1002/(SICI)1521-3757(20000303)112:5<919::AID-ANGE919>3.0.CO;2-Y.
- Zur Bedeutung der Kohlensäure in Karpfenteichen. Teilabdruck des Originals.