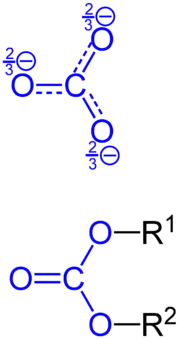
Carbonate
Carbonate (fachsprachlich) oder Karbonate sind die anorganischen Salze und organischen Ester der per definitionem anorganischen Kohlensäure (H2CO3). Von der zweiprotonigen (zweibasigen) Säure leiten sich zwei Reihen von Salzen ab, nämlich die Hydrogencarbonate, die auch primäre Carbonate genannt werden, mit der allgemeinen Formel MIHCO3 und die sekundären Carbonate, mit der allgemeinen Formel MI2CO3. Die sekundären Carbonate basieren auf dem zweifach negativ geladenen Carbonat-Ion CO32−.
Die Ester der Kohlensäure mit der allgemeinen Strukturformel R1−O−C(=O)−O−R2, wobei R1 und R2 kohlenstoffhaltige Alkyl- oder Aryl-Reste sind, werden auch Carbonate genannt und unter Kohlensäureester beschrieben. Polymere Carbonate haben die allgemeine Strukturformel (O−R−O−C(=O)−)n und werden unter Polycarbonate behandelt.
Von der in freier Form nicht existierenden Orthokohlensäure (C(OH)4) leiten sich die Orthokohlensäureester mit der Strukturformel C(OR)4 ab.
Eigenschaften
Das Carbonat-Anion ist vollkommen planar gebaut, mit 120°-Bindungswinkeln zwischen den einzelnen Sauerstoffatomen. Die Abstände aller drei O-Atome zum zentralen Kohlenstoffatom sind gleich und liegen mit etwa 130 pm zwischen der Länge von C-O-Einfachbindungen (143 pm) und C=O-Doppelbindungen (123 pm).[1]
Carbonate sind ionische Salze und deshalb bei Raumtemperatur in der Regel kristalline Feststoffe. Das Carbonat-Anion bringt keine Eigenfarbe in die Verbindungen ein, so dass deren Farbe ggf. durch das betreffende Kation bestimmt wird. Carbonate sind geruchlos. Mit Ausnahme der Alkali-Carbonate sind sie nur wenig wasserlöslich, so dass die meisten Metallionen in wässriger Lösung bei Reaktion mit Alkalicarbonaten ausgefällt werden.
Vorkommen
Carbonate kommen überall in der Natur vor, meist in Form verschiedener Minerale. In der Systematik der Minerale nach Strunz (9. Auflage) bilden sie zusammen mit den verwandten Nitraten eine gemeinsame Mineralklasse. In der veralteten 8. Auflage der Strunz'schen Systematik sowie in der im englischen Sprachraum gebräuchlichen Systematik der Minerale nach Dana sind zusätzlich noch die Borate mit in die Klasse aufgenommen.
Wichtige bzw. bekannte Vertreter der Carbonate sind unter anderem das Bariumcarbonat Witherit; die Calciumcarbonate Aragonit, Calcit und Vaterit; das Eisencarbonat Siderit (Eisenspat); die basischen Kupfercarbonate Azurit und Malachit; das Magnesiumcarbonat Magnesit; das Mangancarbonat Rhodochrosit (Manganspat); die Natriumcarbonate Gaylussit, Natrit, Pirssonit, Soda und Trona, das Zinkcarbonat Smithsonit (Zinkspat)[2] sowie Bastnäsit als Rohstoff zur Gewinnung der Metalle der Seltenen Erden. Weitere Vertreter der Carbonatfamilie sind Dolomit (Calciummagnesiumcarbonat) und die in der Natur nur als Stoffgemisch bekannte „Pottasche“ (Kaliumcarbonat). Die Gesamtmenge des in der Lithosphäre enthaltenen Kohlenstoffs beträgt etwa 2,9·1016 t.[1]
Weiterhin enthält auch die Hydrosphäre der Meere, Seen und Flüsse große Mengen gelöster Carbonate und nahezu alle Lebewesen tragen sowohl gelöste Carbonate in sich oder benutzen unlösliche Carbonate als Gerüstsubstanz. Geologisch betrachtet treten Carbonate meist als Sedimentite (Kalkstein) seltener Metamorphite oder gar magmatische Gesteine (Karbonatit) auf.





.jpg.webp)
 Rhodochrosit (rot)
Rhodochrosit (rot).jpg.webp) Violett- bis rosafarbener Smithsonit
Violett- bis rosafarbener Smithsonit

Reaktionen
- Reaktion zwischen Kohlensäure und Calciumcarbonat:
- Calciumcarbonat reagiert mit Wasser und Kohlenstoffdioxid zu Calciumhydrogencarbonat.
Diese Reaktion spielt sich bei der Lösung von Kalkstein in kohlensäurehaltigem Grundwasser ab. Sie ist der Ursprung der Wasserhärte.
- Dissoziation in Wasser:
- Magnesiumcarbonat dissoziiert zu einem Magnesiumion und einem Carbonation.
- Zerfall beim Erhitzen:
- Calciumcarbonat zerfällt zu Calciumoxid und Kohlenstoffdioxid.
Dies ist die Reaktion bei der Herstellung von Branntkalk.
Siehe auch: Carbonat-Silicat-Zyklus
Basische Reaktion
Die Carbonationen reagieren mit Wasser zu Hydrogencarbonat- und Hydroxidionen. Es handelt sich dabei um eine Säure-Base-Reaktion.
Dieses Gleichgewicht liegt zwar auf der linken Seite, durch die erhöhte Konzentration an Hydroxidionen reagieren Lösungen von Carbonaten aber deutlich alkalisch.
Nachweis
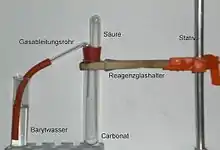
Carbonat-Ionen (CO32−) lassen sich durch Zugabe von Salzsäure nachweisen, bei der Kohlenstoffdioxid entsteht:
Kohlenstoffdioxidgas wird in die Nachweisreagenz Kalk- oder Barytwasser geleitet. Dort erzeugt es eine weiße Trübung von Calcium- bzw. Bariumcarbonat:
- Bariumhydroxid und Kohlenstoffdioxid reagieren zu Bariumcarbonat und Wasser
Der quantitative Nachweis geringer Carbonatkonzentrationen in Wässern erfolgt zusammen mit der Bestimmung von Hydrogencarbonaten oft durch eine Titration mit Salzsäure („SBV“): weist das Messgut zu Beginn einen pH-Wert über 8,3 auf, so ist der Salzsäureverbrauch bis zum Erreichen von pH 8,3 äquivalent der Carbonatkonzentration. Der weitere Säureverbrauch bis zum Erreichen von pH 4,3 entspricht der Summe von Carbonat und Hydrogencarbonat. Bei Wässern mit pH-Werten unter 8,3 titriert man gleich nur bis 4,3 (nur noch Hydrogencarbonat) und errechnet den ursprünglichen, dann sehr geringen Anteil an Carbonat-Ionen aus dem Dissoziationsgleichgewicht der Kohlensäure.
Carbonate und Hydrogencarbonate können auch durch Ionen-HPLC oder durch Kapillarelektrophorese bestimmt werden. In beiden Fällen wird ein „Gesamtcarbonat“ ermittelt und die Komponenten Carbonat, Hydrogencarbonat und „Freie Kohlensäure“ unter Berücksichtigung von pH-Wert, Ionenstärke und Temperatur wiederum aus dem Dissoziationsgleichgewicht der Kohlensäure errechnet.
Weblinks
- Carbonat (varaltet: Karbonat). In: Mineralienatlas Lexikon. Stefan Schorn u. a., abgerufen am 14. Oktober 2019.
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Carbonat. Spektrum.de, 4. Dezember 2014, abgerufen am 14. Oktober 2019.