Cholecalciferol
Cholecalciferol (auch Colecalciferol oder kurz Calciol; Vitamin D3 oder ungenau Vitamin D) ist die wichtigste physiologische Form des Vitamin D in allen nichtpflanzlichen Eukaryoten und so auch im Menschen. Cholecalciferol ist ein Secosteroid und wird im Körper auch mit Hilfe von UVB-Strahlung (Dorno-Strahlung, nach Carl Dorno) in der Haut aus 7-Dehydrocholesterol gebildet, daher ist der historische Begriff Vitamin der Definition nach nicht völlig zutreffend.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
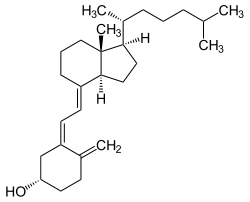 | ||||||||||
| Allgemeines | ||||||||||
| Trivialname | Vitamin D3 | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C27H44O | |||||||||
| CAS-Nummer | 67-97-0 | |||||||||
| PubChem | 5280795 | |||||||||
| ATC-Code |
A11CC05 | |||||||||
| DrugBank | DB00169 | |||||||||
| Kurzbeschreibung | farbloser Feststoff | |||||||||
| Vorkommen | nicht-pflanzliche Eukaryoten | |||||||||
| Physiologie | ||||||||||
| Funktion | Vorstufe des Calcitriol, als solches: Regulierung des Calcium-Haushalts, Reifung von Immunzellen | |||||||||
| Täglicher Bedarf | 20 µg (800 IE) täglich (Summe aus Hautproduktion und Nahrungsaufnahme) | |||||||||
| Folgen bei Mangel | Rachitis, Osteomalazie | |||||||||
| Überdosis | Siehe Hypervitaminose D | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 384,64 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
Zersetzung | |||||||||
| Löslichkeit | fettlöslich, im Blut zu 50–80 % proteingebunden (an VDBP) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
In der Nahrung kommt es vor allem in Fettfischen vor oder wird den Lebensmitteln als Nahrungsergänzungsmittel zugefügt. Es hat im Körper die Funktion eines Prohormons und wird über die Zwischenstufe Calcidiol in seine physiologisch wirksame Form, das Hormon Calcitriol, umgewandelt.
Biochemie
Cholecalciferol spielt eine wesentliche Rolle bei der Regulierung des Calcium-Spiegels im Blut und beim Knochenaufbau.
Biosynthese von Vitamin D3
Die meisten Wirbeltiere einschließlich des Menschen decken einen Großteil ihres Vitamin-D-Bedarfs durch Sonnenbestrahlung ihrer Haut; dies kommt auch bei bestimmten Planktonarten vor (Phytoplankton coccolithophor Emeliani huxleii).[4]
Definitionsgemäß sind Vitamine Substanzen, die der Körper selbst nicht herstellen kann, die aber zum Leben benötigt werden und daher zugeführt werden müssen. Die Vorstufen des sogenannten Vitamin D3 werden aber vom Körper selbst hergestellt. Zum im Körper vorhandenen Provitamin 7-Dehydrocholesterol (der Ausgangssubstanz der Vitamin-D-Synthese) muss dann allerdings noch Sonnenlicht hinzukommen. Vitamin D3 wird also aus historischen Gründen als Vitamin bezeichnet. Aufgrund seiner endogenen Synthese und der Tatsache, dass seine Wirkung neben dem Syntheseort auch andere Gewebe betrifft, müsste Vitamin D3 als Prohormon bezeichnet werden.
Wird 7-Dehydrocholesterol mit Ultraviolett mit Wellenlängen im Bereich 290–315 nm (UV-B-Strahlung) und mindestens 18 mJ/cm²[5] bestrahlt, kann im 7-Dehydrocholesterol durch eine fotochemisch induzierte 6-Elektronen-konrotatorische elektrocyclische Reaktion der B-Ring aufgebrochen werden: Es entsteht Prävitamin D3.[6] Das Prävitamin D3 ist thermodynamisch instabil und unterliegt einer (1-7)sigmatropen Umlagerung, bei der ein Proton von C-19 nach C-9 wandert, mit anschließender Isomerisation: Es entsteht Vitamin D3. Das Vitamin D3 gelangt in das Blut und wird dort vor allem an das Vitamin-D-bindende Protein (DBP) gebunden zur Leber transportiert, wo es weiter zu Calcidiol (25(OH)-Vitamin-D3) hydroxyliert wird. Im Reagenzglas sind nach drei Tagen 80 % des Prävitamin D3 zu Vitamin D3 isomerisiert, in der Haut ist dies nach acht Stunden geschehen.[4]
- Selbstregulation der Ultraviolett-induzierten Synthese
Wird 7-Dehydrocholesterol im Reagenzglasversuch simulierter äquatorialer Sonnenstrahlung ausgesetzt, ist nach einigen Minuten ca. 20 % der Ausgangsmenge zu Prävitamin D3 umgewandelt. Diese Menge an Prävitamin D3 bleibt bei weiterer Bestrahlung im Gleichgewicht, denn auch Prävitamin D3 ist photolabil und wird durch weitergehende UV-B-Bestrahlung während der nächsten acht Stunden zum physiologisch inaktiven Lumisterol und zu Tachysterol abgebaut, bevor es zu Vitamin D3 isomerisiert. In dieser Zeit sinkt das 7-Dehydrocholesterol auf ca. 30 % der Ausgangsmenge ab. Unter unnatürlicher Schmalspektrum-UV-B-Bestrahlung mit einer Wellenlänge von 290 bis 300 nm wird dagegen 65 % des ursprünglichen 7-Dehydrocholesterols in Prävitamin D3 umgewandelt.[4]
Auch das aus Prävitamin D3 entstandene Vitamin D3 ist photolabil: Kann das Vitamin D3 nicht schnell genug im Blut abtransportiert werden, entstehen aus ihm durch UV-B- und UV-A-Strahlung (bis zu 345 nm) mindestens drei weitere unwirksame Produkte: Suprasterol-1 und -2 und 5,6-Transvitamin D3.
So wird bei einer kurzen Sonnenbestrahlung (mit genügend hohem UV-B-Anteil) über einige Minuten ähnlich viel Vitamin D3 gebildet wie bei einer vergleichbaren Bestrahlung über längere Zeit. Hierdurch ist der Körper kurzfristig vor einer Vitamin-D-Intoxikation durch zu viel Strahlung geschützt.
Langfristig ergibt sich ein Schutz vor einer Vitamin-D-Intoxikation durch eine vermehrte Bildung von Melanin (Bräunung, dunkler Hauttyp in südlichen Ländern) in der Haut, welches Ultraviolett der Wellenlängen 290–320 nm absorbiert.
Der 7-Dehydrocholesterolgehalt der Haut sinkt mit dem Alter. Ferner nimmt beim Menschen im Alter die Fähigkeit der Haut, Vitamin D3 zu bilden, ungefähr um den Faktor 3 ab im Vergleich zu einem 20-jährigen Menschen.[4]
Für die blasse Haut eines hellhäutigen, jungen Erwachsenen ist die minimale Erythemdosis (MED) (wenn die Haut anfängt, rot zu werden) an einem sonnigen Sommermittag auf 42° Breite in Meereshöhe (entsprechend Boston, Barcelona oder Rom) nach 10 bis 12 Minuten erreicht, ein dunkelhäutiger Mensch benötigt entsprechend 120 Minuten. Wird die Haut dieser Menschen ganzkörperbestrahlt, gibt sie innerhalb der nächsten 24 Stunden eine Menge vergleichbar mit 10.000 bis 20.000 IE (250 µg bis 500 µg) Vitamin D3 aus Nahrungsmitteln an das Blut ab, ein Vielfaches der Nahrungsempfehlungen von 200 bis 500 IE Vitamin D3 täglich.[5] Eine starke Vitamin-D3-Bildung in der Haut ist also schon bei einer kurzen, aber intensiven Sonnenbestrahlung mit hohem UV-B-Anteil möglich.
Da die Knochendichte bei dunkelhäutigen Menschen von der etwas verminderten Vitamin-D-Bildung aufgrund der geringeren Durchlässigkeit der Haut für UV-Strahlen nicht vermindert ist, wird davon ausgegangen, dass Dunkelhäutige eine geringere Konzentration des Vitamin-D-bindenden Proteins aufweisen.[7]
Verstoffwechselung von Vitamin D3
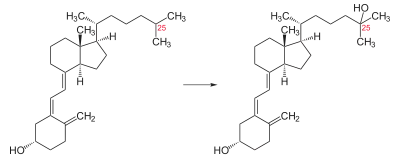
Vitamin D3 wird, vor allem gebunden an das Vitamin-D-bindende Protein, über das Blut in die Leber transportiert. Dort wird es von dem Enzym Cytochrom P450 2R1 in den Mikrosomen zu Calcidiol (25(OH)-Vitamin-D3) hydroxyliert. Eine frühere Vermutung, dass diese Reaktion auch in den Mitochondrien stattfindet, wurde inzwischen widerlegt.[8][9]
Calcidiol (25(OH)-Vitamin-D3) wird in der Leber wieder an Vitamin-D-bindendes Protein gebunden und in das Blut abgegeben. Dort hat es eine Halbwertszeit von ca. 19 Tagen.[1]
Diese enzymatische Reaktion ist wahrscheinlich keiner nennenswerten Regulation unterworfen, da der 25(OH)Vitamin-D3-Spiegel im Blut ziemlich genau die längerfristige Vitamin-D3-Versorgung der letzten drei bis vier Monate widerspiegelt, während der Vitamin-D3-Spiegel die Versorgung der letzten Stunden bis Tage anzeigt.
Calcidiol (25(OH)-Vitamin-D3) ist eine Speicherform des Vitamin D3. Eine solche muss es geben, um die großen Spitzen und Pausen der hauptsächlichen Vitamin-D-Versorgung durch das Licht abfangen zu können. Die mittel- bis längerfristige Vitamin-D-Versorgung eines Organismus lässt sich am besten über den Blutspiegel des Calcidiols bestimmen (Näheres siehe unten).
1,25(OH)2D3 (Calcitriol) wird durch 24-Hydroxylase zur wasserlöslichen Calcitroinsäure abgebaut, die über die Galle ausgeschieden wird.[10] Die 24-Hydroxylase wird durch das Gen CYP24A1[11] codiert.
Vitamin-D-Mangel
Siehe auch: Vitamin-D3-Mangel
Ein Vitamin-D-Mangel führt mittelfristig bei Kindern zu Rachitis und bei Erwachsenen zu Osteomalazie. Auf folgende Erkrankungen hat ein Vitamin-D-Mangel ungünstige Auswirkungen:
- Osteopathien (Knochenerkrankungen)
- Myopathien (Muskelerkrankungen)
- Infektionen
- entzündliche Erkrankungen
- Bluthochdruck
- Schuppenflechte
- Typ-1- und Typ-2-Diabetes[12]
- kardiovaskuläre Erkrankungen
Natürliche Quellen
Die Nahrungsaufnahme deckt meist nur 5 bis 20 % des Vitamin-D3-Bedarfs.[13][14] Daher ist eine direkte Sonnenbestrahlung der Haut zur Vitamin-D3-Bildung unerlässlich. An sonnigen Sommertagen wird der Tagesbedarf allein hierdurch um ein Vielfaches gedeckt. In den Wintermonaten jedoch ist eine Bildung durch Sonnenexposition wegen des fehlenden UV-B-Anteils im Sonnenlicht gar nicht möglich. Die im Sommer aufgebauten Vitamin-D-Reserven im Körper und die Nahrung sind dann alleinige natürliche Quellen.[15]
Bildung durch Sonnenlicht
Verantwortlich für die Vitamin-D3-Bildung durch Sonnenexposition ist der UV-B-Anteil im Sonnenlicht. Diverse Faktoren beeinflussen die Lichtintensität und die letztendliche Vitamin-D3-Bildung in der Haut, wie z. B. die Hautfarbe der Person,[16] der Sonnenstand, die Höhe über dem Meeresspiegel, die Beschaffenheit der Erdoberfläche, die Bewölkung, Smog oder das Ozon. Fensterglas absorbiert nahezu alle UV-B-Anteile im Sonnenlicht und Sonnencreme behindert die Vitamin-D3-Produktion bereits bei LSF 8 um mehr als 97 %.[17] Ein Solarienbesuch ist in der Regel nicht förderlich, da die Haut hier meist mit UV-A- und nicht mit UV-B-Licht bestrahlt wird.
Aufnahme durch die Nahrung
Vitamin D3 ist kein gewöhnlicher Nahrungsbestandteil. Der zu empfehlende Tagesbedarf (RDA) an Vitamin D3 wird unter Wissenschaftlern und Verantwortlichen für die Gesundheitsversorgung diskutiert.[18] Die derzeitigen Empfehlungen werden von Forschern auf diesem Gebiet als entweder irrelevant (für ausreichend UV-B-lichtexponierte Personen) oder unzureichend (für die Mehrzahl der Bevölkerung höherer Breiten) angesehen. Für Risikogruppen einer Vitamin-D-Defizienz (dunklere Hautfarbe, Lichtmangel und andere Ursachen) wird eine Überprüfung des Vitamin-D-Spiegels empfohlen.[19] Für Kinder im ersten Lebensjahr wird eine tägliche orale Gabe von 400 Internationalen Einheiten (IE) empfohlen.[19] Für Schwangere und Stillende wird eine tägliche orale Aufnahme von 600 IE empfohlen.[20]
Vitamin-D-Bestimmung
Die Bestimmung des Vitamin-D-Spiegels im Blutserum reflektiert nur die Vitamin-D-Aufnahme mit der Nahrung bzw. die Eigensynthese in der Haut während der letzten Stunden bis Tage. Für eine Untersuchung des längerfristigen Vitamin-D-Status ist die Bestimmung des Calcidiol-Spiegels im Blut, in das Vitamin D3 in der Leber rasch umgewandelt wird (siehe oben), sinnvoller. Die Halbwertszeit des Calcidiols in der Blutzirkulation ist je nach Vitamin-D-Gesamtstatus 1–2 Monate. Bis sich nach einer Änderung der täglichen Vitamin-D-Zufuhr ein neues Fließgleichgewicht mit einem dann wieder stabilen Serumwert einstellt, vergehen bis zu vier Monate.[21]
Das Calcidiol lässt sich seit Anfang der 1980er Jahre bestimmen und ermöglichte ein weitergehendes Verständnis für die Physiologie des Vitamin D3. Die Angabe der Messwerte erfolgt entweder in Gewichts- oder molaren Konzentrationseinheiten, wobei 1 ng/ml etwa 2,5 nmol/l entspricht.
Überdosierung und Toxizität
Eine akute oder chronische Vitamin-D-Überdosierung kann zu einer Vitamin-D-Hypervitaminose führen. Die Europäische Behörde für Lebensmittelsicherheit (EFSA) hat 2012 folgendermaßen zur Sicherheit von Vitamin D3 Stellung genommen:
- Eine maximale tägliche Dosis von 100 µg (4000 IE) für Jugendliche und Erwachsene (inklusive Schwangere und stillende Mütter) und 50 µg (2000 IE) für Kinder von 1 bis 10 Lebensjahren sind von Gesunden ohne Risiko von Nebenwirkungen auch ohne medizinische Aufsicht langfristig einnehmbar.
- Gemessen an den üblichen Vitamin-D-Dosierungen lässt diese Stellungnahme für Erwachsene sogar einen weiteren Spielraum zu: Die EFSA zitiert 2 Studien, die einen NOAEL (no observed adverse effect level) für Vitamin D von 250 µg (10000 IE) etablierten. Bei Säuglingen ist der Sicherheitsbereich geringer.[22]
Von den meisten Autoren wird für Erwachsene eine tägliche Zufuhr bis zu 100 µg (4000 IE) Vitamin D3 über sechs Monate als sicher angesehen, das heißt ohne nachprüfbare Nebenwirkungen wie eine erhöhte Calciumausscheidung im Urin.[23][24]
Die Packungsbeilagen von apothekenpflichtigen Vitamin-D-Präparaten geben für Erwachsene mit normaler Funktion der Nebenschilddrüsen eine Überdosierungschwelle zwischen 40.000 und 100.000 IE pro Tag über 1 bis 2 Monate an. Säuglinge und Kleinkinder können schon auf weitaus geringere Dosen empfindlich reagieren. Die Packungsbeilage eines Medikaments gilt normalerweise sowohl medizinisch als auch juristisch als ausschlaggebend.[25]
Herstellung
Häufig angewandt wird das Verfahren zur Herstellung von Cholecalciferol aus Wollwachs. Hierzu wird zunächst Cholesterol aus dem Wollwachs isoliert. Das gewonnene Cholesterol wird dann analog zur Biosynthese des Cholecalciferols bis zum 7-Dehydrocholesterol weiterverarbeitet. Dieses wird im Anschluss mit Ultraviolettstrahlung behandelt, sodass nach der fotochemischen Ringspaltung noch 7-Dehydrocholesterol, Prävitamin D3 sowie die Vitamin D3-Enantiomere Lumisterol und Tachysterol vorliegen. Das 7-Dehydrocholesterol wird nun durch Zugabe und Reaktion mit Methanol entfernt. Das Gemisch wird anschließend noch erhitzt um aus dem vorliegenden Prävitamin D3 das physiologisch verwertbare Cholecalciferol zu erhalten.[26]
Cholecalciferol kann aus dem Schlachtnebenerzeugnis Rinderhirn hergestellt werden.[27]
Verwendung zur Bekämpfung von Nagetieren
Cholecalciferol kann auch als Rattengift bzw. Gift gegenüber Nagetieren verwendet werden: Der LD50 (oral) bei der Ratte liegt bei etwa 42 mg/kg Körpergewicht, bei der Hausmaus bei ca. 43 mg/kg Körpergewicht[28] und bei der Kleinen Bandikutratte (Bandicota bengalensis) je nach Geschlecht bei 31-35 mg/kg[29]. Da Cholecalciferol in der Natur selten frei vorkommt, konnten Nagetiere evolutionär gegenüber hohen Dosen keine Toleranz entwickeln.[30] Ursprünglich ging man davon aus, dass es als Rodentizid gegenüber anderen Arten, wie beispielsweise Hunde oder Katzen, schwach toxisch sei; es zeigte sich aber, dass dies nicht der Fall ist.[31] Bei Hunden gilt eine LD50 von ca. 88 mg/kg Körpergewicht, es ereigneten sich bereits Todesfälle bei 2 mg/kg, besonders Welpen sind anfälliger.[32] Katzen zeigen sich resistenter. In Neuseeland wurden Cholecalciferol-haltige Köder in Feldversuchen zur Bekämpfung des Fuchskusu erfolgreich eingesetzt.[33]
Cholecalciferol ist in der EU und in der Schweiz für die Verwendung als Biozid der Produktart 14 (Rodentizide) zugelassen.[34]
Handelsnamen
Monopräparate: Dekristol (D), Vigantol (D), Oleovit D3 (A), diverse Nahrungsergänzungsmittel
Siehe auch
Literatur
- A. S. Dusso, A. J. Brown, E. Slatopolsky: Vitamin D. In: American Journal of Physiology-Renal Physiology. 289, 2005, S. F8–F28. (Review). PMID 15951480.
- Hajo Zeeb, Rüdiger Greinert: Bedeutung von Vitamin D in der Krebsprävention. In: Deutsches Ärzteblatt International. Jg. 107, Nr. 37, Köln 2010, S. 638–643.[35]
- R. Bouillon et al.: Vitamin D and human health, lessons from vitamin D receptor null mice. In: Endocrine Reviews. Band 29, 2008, S. 726–776. (Review) doi:10.1210/er.2008-0004 PMID 18694980 PMC 2583388 (freier Volltext).
- Philippe Autier, Mathieu Boniol, Cecile Pizot, Patrick Mullie: Vitamin D status and ill health: a systematic review. In: The Lancet Diabetes & Endocrinology. 2, 2014, S. 76–89. doi:10.1016/S2213-8587(13)70165-7.
Weblinks
- Cholecalciferol Compound – C05443 in der Kyoto Encyclopedia of Genes and Genomes
- Bedeutung von Vitamin D in der Krebsprävention: Konflikt zwischen UV-Schutz und Anhebung niedriger Vitamin-D-Spiegel? In: Ärzteblatt.
- Vitamin D. In: Robert Koch-Institut. 3. August 2020.
- Höchstmengenvorschläge für Vitamin D in Lebensmitteln inklusive Nahrungsergänzungsmitteln. In: Bundesinstitut für Risikobewertung. 2021.
Einzelnachweise
- Eintrag zu CHOLECALCIFEROL in der Hazardous Substances Data Bank, abgerufen am 29. Juli 2012 (online auf PubChem).
- Eintrag zu Colecalciferol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Colecalciferol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 27. August 2016. (JavaScript erforderlich)
- M. F. Holick: Environmental factors that influence the cutaneous production of vitamin D. In: Am J Clin Nutr. Band 61 (3 Suppl), 1995, S. 638S–645S.
- B. W. Hollis: Circulating 25-Hydroxyvitamin D Levels Indicative of Vitamin D Sufficiency: Implications for Establishing a New Effective Dietary Intake Recommendation for Vitamin D. In: J Nutr. Band 135(2), 2005, S. 317–322.
- Rudi Hutterer: Fit in Biochemie. Springer, 2009, ISBN 978-3-8348-9379-6, S. 501. eingeschränkte Vorschau in der Google-Buchsuche.
- Camille E. Powe, Michele K. Evans, Julia Wenger, Alan B. Zonderman, Anders H. Berg, Michael Nalls, Hector Tamez, Dongsheng Zhang, Ishir Bhan, S. Ananth Karumanchi, Neil R. Powe, Ravi Thadhani: Vitamin D–Binding Protein and Vitamin D Status of Black Americans and White Americans. In: New England Journal of Medicine. 369, 2013, S. 1991–2000, doi:10.1056/NEJMoa1306357.
- R. Shinkyo, T. Sakaki, M. Kamakura, M. Ohta, K. Inouye: Metabolism of vitamin D by human microsomal CYP2R1. In: Biochem. Biophys. Res. Commun. Band 324, Nr. 1, November 2004, S. 451–457, doi:10.1016/j.bbrc.2004.09.073, PMID 15465040.
- J. B. Cheng u. a.: De-orphanization of Cytochrome P450 2R1, a microsomal Vitamin D 25-Hydroxylase. In: J Biol Chem. Band 278(39), 2003, S. 38084–38093.
- G. S. Reddy, K. Y. Tserng: Calcitroic acid, end product of renal metabolism of 1,25-dihydroxyvitamin D3 through C-24 oxidation pathway. In: Biochemistry. Band 28, Nr. 4, 21. Februar 1989, S. 1763–1769, PMID 2719932.
- Cytochrome P450, Family 24, Subfamily A, Polypeptide 1; CYP24A1. In: Online Mendelian Inheritance in Man. (englisch)
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 30.
- Natalie J. Lauer: Gesundheit, Vitalität & Lebensfreude. Gesund mit veganer Ernährung. Hrsg. v. Eberhard J. Wormer u. Johann A. Bauer. Lingen, Köln 2015.
- Katja Egermeier: Mehr Sonne, weniger Knochenbrüche. In: Pharmazeutische Zeitung online. 29/2013; abgerufen am 26. März 2015.
- Sven Siebenand: Das Hormon der Streithähne. In: Pharmazeutische Zeitung online. 06/2012; abgerufen am 26. März 2015.
- Calcium plus Vitamin D: Schlüsselrolle in der Osteoporosebehandlung; 22 Tabellen. Georg Thieme Verlag, 2003, ISBN 978-3-13-133151-9, S. 14 (books.google.de).
- Gesundheitsamt Bremen (Hrsg.): Vitamin D-Mangel im Alter. In: Umwelt: Ernährung: Vitamin D-Mangel. Gesundheitsamt Bremen; abgerufen am 26. März 2015.
- K. D. Cashman, C. Ritz, M. Kiely,. Odin Collabora: Improved Dietary Guidelines for Vitamin D: Application of Individual Participant Data (IPD)-Level Meta-Regression Analyses. In: Nutrients. Band 9, Nummer 5, Mai 2017, S. , doi:10.3390/nu9050469, PMID 28481259, PMC 5452199 (freier Volltext).
- Z. Grossman, A. Hadjipanayis, T. Stiris, S. Del Torso, J. C. Mercier, A. Valiulis, R. Shamir: Vitamin D in European children-statement from the European Academy of Paediatrics (EAP). In: European Journal of Pediatrics. Band 176, Nummer 6, Juni 2017, S. 829–831, doi:10.1007/s00431-017-2903-2, PMID 28401345.
- C. F. Munns, N. Shaw, M. Kiely, B. L. Specker, T. D. Thacher, K. Ozono, T. Michigami, D. Tiosano, M. Z. Mughal, O. Mäkitie, L. Ramos-Abad, L. Ward, L. A. DiMeglio, N. Atapattu, H. Cassinelli, C. Braegger, J. M. Pettifor, A. Seth, H. W. Idris, V. Bhatia, J. Fu, G. Goldberg, L. Sävendahl, R. Khadgawat, P. Pludowski, J. Maddock, E. Hyppönen, A. Oduwole, E. Frew, M. Aguiar, T. Tulchinsky, G. Butler, W. Högler: Global Consensus Recommendations on Prevention and Management of Nutritional Rickets. In: The Journal of clinical endocrinology and metabolism. Band 101, Nummer 2, Februar 2016, S. 394–415, doi:10.1210/jc.2015-2175, PMID 26745253, PMC 4880117 (freier Volltext).
- Wissenschaftlicher Lebensmittelausschuss der Europäischen Kommission: Opinion of the Scientific Committee on Food on the Tolerable Upper Intake Level of Vitamin D. (PDF; 385 kB). 2002.
- Europäische Behörde für Lebensmittelsicherheit: Scientific Opinion on the Tolerable Upper Intake Level of vitamin D. In: EFSA Journal. 10, 2012, doi:10.2903/j.efsa.2012.2813.
- W. B. Grant, M. F. Holick: Benefits and Requirements of Vitamin D for Optimal Health: A Review. (PDF; 262 kB). In: Altern Med Rev. Band 10(2), 2005, S. 94–111.
- R. Vieth: Critique of the Considerations for Establishing the Tolerable Upper Intake Level for Vitamin D: Critical Need for Revision Upwards. In: J Nutr. Band 136, 2006, S. 1117–1122.
- Packungsbeilage Vitamin D der Woerwag-Pharma. (Memento vom 5. Januar 2012 im Internet Archive) (PDF)
- AGD Nutrition, LLC: Vitamin D3 Story. Abgerufen am 17. Januar 2021 (englisch).
- Mariel Kreis: Schlachtabfälle in der Schweiz - Was beim Schlachten übrig bleibt. In: srf.ch. 25. Januar 2020, abgerufen am 25. Januar 2020.
- Marshall, Edward F.: CHOLECALCIFEROL: A UNIQUE TOXICANT FOR RODENT CONTROL. In: DigitalCommons@University of Nebraska - Lincoln. 1984 (unl.edu [abgerufen am 3. Oktober 2018]).
- Neena Singla und Sumanpreet Kaur: Toxicity of cholecalciferol to lesser bandicoot rat, Bandicota bengalensis: Biochemical and histopathological changes. In: International Biodeterioration & Biodegradation. Band 103, September 2015, S. 125–133, doi:10.1016/j.ibiod.2015.04.021.
- Manjit S. Saini und V. R. Parshad: Control of Rattus rattus with cholecalciferol: laboratory acceptance of freshly prepared and ready-to-use bait formulations. In: International Biodeterioration & Biodegradation. Band 30, Nr. 1, 1. Januar 1992, S. 87–96, doi:10.1016/0964-8305(92)90027-L.
- Merck Veterinary Manual - Rodenticide Poisoning: Introduction. Archiviert vom Original am 17. Januar 2007.
- Michael E. Peterson, Kerstin Fluegeman: Cholecalciferol. In: Topics in Companion Animal Medicine. Band 28, Nr. 1, Februar 2013, S. 24–27, doi:10.1053/j.tcam.2013.03.006, PMID 23796485.
- David R. Morgan: Field efficacy of cholecalciferol gel baits for possum(Trichosurus vulpecula)control. In: New Zealand Journal of Zoology. Band 33, Nr. 3, Januar 2006, S. 221–228, doi:10.1080/03014223.2006.9518449.
- Eintrag in der ECHA-Datenbank der bioziden Wirkstoffe, abgerufen am 27. Februar 2020.
- Zeeb arbeitet am Leibniz-Institut für Präventionsforschung und Epidemiologie