Ionenselektive Elektrode
Eine ionenselektive Elektrode, auch ionenspezifische oder ionensensitive Elektrode (ISE) genannt, dient als Sensor für die Konzentration oder genauer die Aktivität eines bestimmten gelösten Ions. Für die Messung taucht man die ionenselektive Elektrode und eine zweite Elektrode, die Bezugselektrode, in die Messlösung und misst die Spannung zwischen den Elektroden. Daraus kann man dann die gesuchte Konzentration bestimmen.
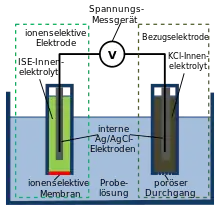
Die Messgröße ist also eine konzentrationsabhängige Spannung gegen die Bezugselektrode. Diese Spannung hängt nach der Nernstgleichung logarithmisch von der Aktivität des betreffenden Ions ab. Die bekannteste ionenselektive Elektrode ist die pH-Elektrode, die auf Protonen (Wasserstoff- oder Hydroniumionen) anspricht. Ionenselektive Elektroden werden in vielen Bereichen eingesetzt, z. B. in der analytischen Chemie einschließlich der Umweltanalytik, in biochemischer und biophysikalischer Forschung und in industriellen Prozessen. Es wird geschätzt, dass in klinischen Laboratorien jedes Jahr weit über eine Milliarde Analysen mit ionenselektiven Elektroden ausgeführt werden,[1] so dass die medizinische Untersuchungen heute die wichtigste Routineanwendung von ionenselektiven Elektroden sind.[2]
Vorteile
- Messungen mit ionenselektiven Elektroden sind schnell – sie dauern nur Sekunden bis wenige Minuten – und einfach, z. B. im Vergleich mit Titrationen.
- Die Messung der Konzentration kann kontinuierlich erfolgen. Immer dann, wenn eine lückenlose Aufzeichnung und/oder eine schnelle Regelung erfolgen soll, haben ionenselektive Elektroden einen Vorteil im Vergleich zu diskontinuierlichen Messverfahren.
- Auch wenn die Messlösung eventuell gepuffert werden muss werden für die eigentliche Analyse keine Reagenzien benötigt, im Gegensatz zu Titrationen oder zu vielen photometrischen Verfahren. Das trägt dazu bei, dass das Verfahren relativ preisgünstig bleibt.
- Ein System aus ionenselektiver Elektrode und Bezugselektrode liefert eine Spannung als Messgröße; dies eignet sich gut für die weitere elektronische Verarbeitung.
- Viele Messungen können direkt in biologischen Flüssigkeiten wie Pflanzensaft, Blut oder Urin durchgeführt werden. Zumeist braucht vor der Analyse keine Trennung zu erfolgen, d. h. zeitraubende Schritte wie Filtration, Destillation oder Fällung sind nicht nötig. Trübungen oder Färbungen stören in der Regel nicht, im Gegensatz zu photometrischen Verfahren.
- Die Elektroden können zwar verschmutzen, zeigen aber ansonsten keinen Verschleiß und können daher im besten Falle jahrelang ohne Wartung verwendet werden.
- Im Vergleich zu vielen Analyseautomaten wie z. B. Titratoren sind ionenselektiven Elektroden preiswert.
- Viele Geräte sind portabel und können nicht nur im Labor, sondern auch im Feldeinsatz verwendet werden.
- Die Analysen können in einem sehr weiten Konzentrationsbereich ausgeführt werden, oft z. B. von 1 · 10−6 mol/l bis 0,1 mol/l, manchmal auch bis zur Sättigungsgrenze des Ions. Für mindestens 12 Ionen gibt es selektive Elektroden, deren Detektionslimit im Bereich 10−8 mol/l bis 10−11 mol/l oder noch darunter liegt.[3]
Wichtige mit ionenselektiven Elektroden bestimmbare Ionen
Es gibt ionenselektiven Elektroden für mehr als 50 zu bestimmende Ionen.[3] Für die Anwendungspraxis besonders wichtig sind die kommerziell erhältlichen, die für die folgenden Ionen verfügbar sind:
Kationen
Anionen
- Halogenid: Fluorid F−, Chlorid Cl−, Bromid Br−, Iodid I−,
- Sonstige: Sulfid HS−/S2−, Cyanid CN−, Nitrat NO3−, Perchlorat ClO4−, Fluoroborat BF4−, Thiocyanat SCN−
Die klinisch wichtigen Ionen, die mit ionenselektiven Elektroden bestimmt werden, sind H+, Na+, K+, Ca2+ und Cl−.[2]
Messaufbau
Das zentrale Bauteil ist die ionenselektive Membran, die eine im Elektrodengehäuse enthaltene Elektrode von der zu bestimmenden Lösung trennt.
Membrantypen
Das wichtigste Teil der ionenselektiven Elektrode, die ionenselektive Membran, hat eine Zusammensetzung, die je nach zu bestimmenden Ion variiert. Die wichtigsten Membrantypen sind kristalline oder glasförmige Festkörper oder Komposite mit Polymeren.
Glasmembranen
Glasmembranen haben meist eine hervorragende chemische Beständigkeit und werden vor allem für pH-Elektroden und für natriumselektive Elektroden verwendet.
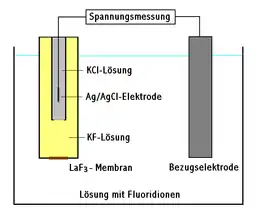
Kristalline Membranen
Kristalline Membranen können polykristallin sein oder aus einem Einkristall hergestellt werden. Für die meisten Fluoridelektroden werden Einkristallmembranen aus Lanthanfluorid verwendet.
Polymerbasierte Membranen
Polymerbasierte Membranen können aus einem Ionenaustauscherharz bestehen. Ein Beispiel ist die kaliumselektive Elektrode, die Valinomycin als Ionentransporter (Ionophor) enthält.
Querempfindlichkeit
Die ideale ionenselektive Elektrode wäre ionenspezifisch, d. h., sie würde nur auf das zu bestimmende Ion ansprechen und würde nicht auf andere Ionen reagieren. In der Praxis haben ionenselektive Elektroden oft eine Querempfindlichkeit gegenüber anderen Ionen; daher empfiehlt die IUPAC, den Begriff „ionenspezifisch“ nicht zu verwenden.[4] Beispielsweise reagieren viele pH-Elektroden nicht nur auf Protonen, sondern auch gegenüber hohen Konzentrationen an Natriumionen, vor allem bei hohen pH-Werten. Fluoridelektroden sind gegenüber Hydroxidionen empfindlich. Eine ionenselektive Elektrode ist also in den seltensten Fällen vollständig ionenspezifisch, und mögliche Quereinflüsse anderer Ionen müssen daher für genaue Analysen berücksichtigt werden. Eine quantitative Beschreibung kann mit der Nicolsky-Eisenman-Gleichung erfolgen[5][6]:
- ;
Beispiele für die Selektivitätskoeffizienten findet man in[5][7].
Historisches
Der prinzipielle Aufbau von ionenselektiven Elektroden und die Konzentrationsabhängigkeit der Spannung war schon in der ersten Hälfte des 20. Jahrhunderts bekannt: Zygmunt Klemensiewicz hatte im Labor von Fritz Haber das Prinzip der pH-Elektrode gefunden[8][9] und Izaak Kolthoff hatte Zellen mit Silberhalogenidmembranen untersucht.[10] Zur praktischen Anwendung der Glaselektrode kam es aber erst, nachdem verbesserte Formen und Gläser[11] verwendet wurden, und nachdem Arnold Orville Beckman ein empfindliches Spannungsmessgerät entwickelt hatte.[12] Die gezielte Entwicklung und Anwendung anderer ionenselektiven Elektroden fand erst in den 1950er und 1960er Jahren statt, z. B. wurde 1957 eine Natriumelektrode bekanntgegeben.[13] 1962 gründete der Glashersteller Corning die Firma Orion Research zur Entwicklung neuer Elektroden. Diese stellte 1966 eine Calcium-[14] sowie eine Fluoridelektrode[15] vor und hatte 1967 neun verschiedene Elektroden im Programm (für Ag+, Ca2+, Cu2+, F−, Br−, I−, ClO4−, NO3− und S2−).
Einzelnachweise
- Eric Bakker, Philippe Bühlmann, Ernö Pretsch: Carrier-Based Ion-Selective Electrodes and Bulk Optodes. 1. General Characteristics. In: Chemical Reviews. Band 97, Nr. 8, Dezember 1997, S. 3083–3132, doi:10.1021/cr940394a.
- Eric Bakker, Dermot Diamond, Andrzej Lewenstam, Ernö Pretsch: Ion sensors: current limits and new trends. In: Analytica Chimica Acta. Band 393, Nr. 1–3, Juni 1999, S. 11–18, doi:10.1016/S0003-2670(99)00056-2.
- Ernö Pretsch: The new wave of ion-selective electrodes. In: Trends in Analytical Chemistry. Band 26, Nr. 1, Januar 2007, S. 46–51, doi:10.1016/j.trac.2006.10.006, PMC 2358928 (freier Volltext).
- Eintrag zu ion-selective electrode (ISE). In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.I03244 – Version: 2.3.3.
- Yoshio Umezawa, Philippe Bühlmann, Kayoko Umezawa, Koji Tohda, Shigeru Amemiya: Potentiometric Selectivity Coefficients of Ion-Selective Electrodes – Part I. Inorganic Cations. In: Pure and Applied Chemistry. Band 72, Nr. 10, Januar 2000, S. 1851–2082, doi:10.1351/pac200072101851.
- Hendrik Rohler: 2. Potentiometrische Sensorik, 2.1 Einführung in die Potentiometrie, 2.1.2 Die Nikolski-Gleichung. (PDF) In: Konzeption und Einsatz ionenselektiver Bohrlochmesssonden. ETH Zürich, Dissertation; Kassel University Press, 1997, abgerufen am 18. März 2015.
- Yoshio Umezawa, Kayoko Umezawa, Philippe Bühlmann, Naoko Hamada, Hiroshi Aoki, Jun Nakanishi, Moritoshi Sato, Kang Ping Xiao, Yukiko Nishimura: Potentiometric selectivity coefficients of ion-selective electrodes. Part II. Inorganic anions (IUPAC Technical Report). In: Pure and Applied Chemistry. Band 74, Nr. 6, Juni 2002, S. 923–994, doi:10.1351/pac200274060923.
- Zygmunt Aleksander Klemensiewicz, Fritz Haber: Über elektrische Phasengrenzkräfte. In: Zeitschrift für physikalische Chemie. Band 67, 1909, S. 385–431.
- Barbara Marczewska, Krzysztof Marczewski: First Glass Electrode and its Creators F. Haber and Z. Klemensiewicz – On 100th Anniversary. In: Zeitschrift für physikalische Chemie. Band 224, 2010, S. 795–799, doi:10.1524/zpch.2010.5505.
- Izaak M. Kolthoff, H. L. Sanders: Electric Potentials at Crystal Surfaces, and at Silver Halide Surfaces in Particular. In: Journal of the American Chemical Society (JACS). Band 59, Nr. 2, 1937, S. 416–420, doi:10.1021/ja01281a059.
- D. A. MacInnes, Malcolm Dole: The Behavior of Glass Electrodes of Different Compositions. In: Journal of the American Chemical Society (JACS). Band 52, Nr. 1, 1930, S. 29–36, doi:10.1021/ja01364a005.
- Patent US2058761: Apparatus for Testing Acidity. Angemeldet am 12. Oktober 1934, veröffentlicht am 27. Oktober 1936, Anmelder: National Technical Laboratories, Erfinder: Arnold Orville Beckman, Henry E. Fracker.
- George Eisenman, Donald O. Rudin, James U. Casby: Glass Electrode for Measuring Sodium Ion. In: Science. Band 126, Nr. 3278, Oktober 1957, S. 831–834, doi:10.1126/science.126.3278.831.
- Martin S. Frant: Historical perspective. History of the early commercialization of ion-selective electrodes. In: Analyst. Band 119, 1994, S. 2293–2301, doi:10.1039/AN9941902293.
- Martin S. Frant, James W. Ross Jr.: Electrode for Sensing Fluoride Ion Activity in Solution. In: Science. Band 154, Nr. 3756, 23. Dezember 1966, S. 1553–1555, doi:10.1126/science.154.3756.1553.