Strontiumchlorid
Strontiumchlorid ist ein Salz des Strontiums. Es besitzt die Formel SrCl2 und gehört zur Stoffgruppe der Chloride.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
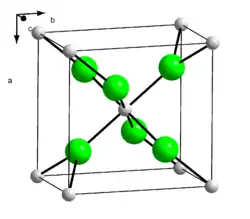 | ||||||||||||||||||||||
| _ Sr2+ _ Cl− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Strontiumchlorid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | SrCl2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses bis weißes, geruchsloses Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V10BX01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,95 g·cm−3 (Hexahydrat)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1250 °C[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Strontiumchlorid bildet farblose Kristalle. Diese sind hygroskopisch und bilden ein Hexahydrat, dessen Kristalle farblos und durchscheinend sind. Strontiumchlorid verwittert an trockener Luft und gibt oberhalb von 60 °C sein Kristallwasser ab, so dass es bei 873 °C wasserfrei schmilzt. Die Lösung von Strontiumchlorid in Wasser schmeckt scharf und bitter.
Herstellung
Strontiumchlorid wird aus den Mineralien Cölestin oder Strontianit unter Verwendung von Salzsäure (HCl) gewonnen. Dabei reagiert das aus Cölestin über Zwischenschritte gewonnene oder im Strontianit als Hauptbestandteil enthaltene Strontiumcarbonat mit der Salzsäure zu Strontiumchlorid und Kohlensäure, die wiederum in Kohlendioxid und Wasser zerfällt:
Verwendung
Strontiumchlorid wird vor allem in der Pyrotechnik zur Rotfärbung von Feuerwerken eingesetzt. Ebenso findet es Verwendung als Zusatz in der Glasindustrie und in der Metallurgie.
Als Strontiumchlorid-Hexahydrat (SrCl2 • 6H2O) wird es in der Labortechnik zum Nachweis anderer Strontiumverbindungen und in der Atomabsorptionsspektroskopie sowie in der Medizin verwendet. In manchen Zahnpflegemitteln (z. B. Sensodyne Classic) soll es der Vorbeugung gegen Parodontitis und zur Verminderung der Schmerzempfindlichkeit der Zahnhälse dienen. In der Homöopathie findet es zu ähnlichen Zwecken in stark verdünnter Form als Strontium chloratum Anwendung. Als schwach radioaktive Isotopenverbindung 89-Strontiumchlorid wird es auch in der Krebstherapie zur Behandlung von Schmerzen bei Knochenkrebs eingesetzt, wenn eine Hormontherapie bei fortgeschrittenen Metastasen nicht mehr anschlägt (Radionuklidtherapie).
Strontiumchlorid-Hexahydrat wird auch in der Meerwasseraquaristik zur ausreichenden Zufuhr von Strontium als Skelettbestandteil mancher Korallenarten verwendet.[6] Das Strontiumchlorid wird insbesondere von Steinkorallen dem Wasser entzogen und muss deshalb nachdosiert werden.[7] Allerdings ist zu beachten, dass Strontium für einige Meeresbewohner (wie Krabben) stark giftig wirkt.[8]
Weblinks
- Omikron Chemikalien-Lexikon (Memento vom 7. Mai 2012 im Internet Archive)
Einzelnachweise
- Eintrag zu STRONTIUM CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. Mai 2020.
- Eintrag zu Strontiumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Datenblatt Strontiumchlorid bei AlfaAesar, abgerufen am 1. April 2020 (PDF) (JavaScript erforderlich).
- Datenblatt Strontiumchlorid bei AlfaAesar, abgerufen am 14. März 2010 (PDF) (JavaScript erforderlich).
- Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 14. (PDF)
- Robert Jay Goldstein: Marine Reef Aquarium Handbook. Barron's Educational Series, 2007, ISBN 0-7641-3674-7, S. 24 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sven Gehrmann: Die Fauna der Nordsee: Niedere Tiere. Weichtiere, Moostierchen, Nesseltiere ... BoD – Books on Demand, 2010, ISBN 3-9812553-2-1, S. 125 (eingeschränkte Vorschau in der Google-Buchsuche).
- Aquarist Magazine and Blog: Aquarium Chemistry: Strontium and the Reef Aquarium, abgerufen am 12. Mai 2014.
