Calciumiodid
Calciumiodid ist eine chemische Verbindung des Calciums und zählt zu den Iodiden. Es ist ein weißer, sich an der Luft langsam gelb färbender Feststoff.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
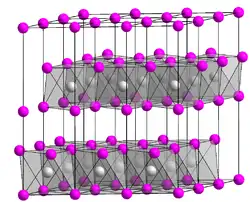 | |||||||||||||||||||
| _ Ca2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumiodid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | CaI2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 293,89 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,956 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1100 °C[2] | ||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Durch Reduktion von Calciumiodid mit Natrium gelang es Henri Moissan erstmals, reines Calcium zu gewinnen.[3]
Gewinnung und Darstellung
Wasserhaltige Calciumiodide kristallisieren beim Einengen aus wässrigen Lösungen aus. Je nach Konzentration bildet sich dabei das Hexa- oder Tetrahydrat. Wasserfreies Calciumiodid lässt sich nicht durch Entwässerung des Hydrates gewinnen, stattdessen kann es aus einer Calciumhydroxid-Lösung und Iod dargestellt werden. Dabei bilden sich Calciumiodid und Calciumiodat, dieses wird danach reduziert.[4]
Ein möglicher weiterer Weg zur Darstellung wasserfreien Calciumiodides ist die Zersetzung von Calciumoxalat mit Iod.[4]
Eigenschaften
In ihren Eigenschaften unterscheiden sich das wasserfreie und wasserhaltige Calciumiodid deutlich. Die verschiedenen Hydrate sind leicht zerfließende, kristalline Massen, die schon bei 42 °C schmelzen, das heißt in ihrem eigenen Kristallwasser auflösen. Ist Calciumiodid-Hydrat im Kontakt mit Luft oder Licht, kann es Kohlenstoffdioxid aufnehmen bzw. Iod abgeben und verfärbt sich infolgedessen gelblich.[5]
Das wasserfreie Calciumiodid ist dagegen ein hochschmelzender kristalliner Feststoff, der in einer typischen Schichtstruktur, der hexagonalen Cadmiumiodid-Struktur kristallisiert. Im gasförmigen Zustand bildet es lineare Moleküle.[6]
Verwendung
Calciumiodid ist wie Kaliumiodid ein Expektorans.[7]
In der Technik wird die Verbindung als Szintillationskristall und in Halogenlampen verwendet.[5]
Einzelnachweise
- Calcium diiodide bei webelements.com.
- Datenblatt Calcium iodide, ultra dry, 99.999% (metals basis) bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- Alain Tressaud: Henri Moissan: Chemie-Nobelpreisträger 1906. In: Angewandte Chemie. 2006, 118, S. 6946–6950, doi:10.1002/ange.200601600.
- Beate Blümer-Schwinum, Hermann Hager, Franz von Bruchhausen, E. Nürnberg, Peter Surman: Hagers Handbuch der pharmazeutischen Praxis, Band 1-4. 5. Auflage, Birkhäuser, 1995, ISBN 978-3-540-52688-9, S. 607.
- Eintrag zu Calciumiodid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1241.
- Kenneth L. Becker, John P. Bilezikian: Principles and practice of endocrinology and metabolism. 3. Auflage, Lippincott Williams & Wilkins, 2001, ISBN 978-0-781-71750-2, S. 362.
