Heparin
Heparine (zu altgriechisch ἧπαρ Hepar „Leber“) sind körpereigene Vielfachzucker (Polysaccharide), die hemmend auf die Gerinnungskaskade wirken und daher auch therapeutisch zur Antikoagulation (Blutgerinnungshemmung) verwendet werden.[7] Chemisch gesehen handelt es sich bei diesen Polyelektrolyten um Glykosaminoglykane, bestehend aus einer variablen Anzahl von Aminozuckern mit einer molaren Masse zwischen 4.000 und 40.000 (Häufigkeitsgipfel etwa 15.000). Natürliche Heparine werden am ergiebigsten aus Dünndarmmukosa vom Schwein extrahiert.[8] Die Gewinnung aus Rinderlungen wird seit der BSE-Epidemie nicht mehr praktiziert. Heparin wird nicht über den Magen-Darm-Trakt aufgenommen und wird deshalb parenteral verabreicht, das heißt, je nach Anwendungsbereich als Spritze oder als kontinuierliche Infusion. Zur äußeren Anwendung werden Heparin-Zubereitungen als Gel oder Salbe zur unterstützenden Behandlung bei akuten Schwellungszuständen nach stumpfen Verletzungen (Blutergüssen) angeboten,[9] obwohl Heparin aufgrund seiner physikochemischen Eigenschaften die Haut nicht nachweisbar durchdringen und daher nicht wirksam resorbiert werden kann.[10]
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
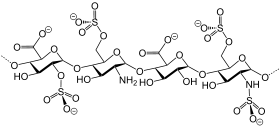 | |||||||||
| Darstellung eines Ausschnitts aus der Struktur von Heparin[1] | |||||||||
| Allgemeines | |||||||||
| Name | Heparin | ||||||||
| Andere Namen | |||||||||
| CAS-Nummer |
| ||||||||
| Monomere/Teilstrukturen | abwechselnd D-Glucosamin und D-Glucuronsäure oder L-Iduronsäure | ||||||||
| PubChem | 772 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB01109 | ||||||||
| Kurzbeschreibung |
weißes bis graues, amorphes und hygroskopisches Pulver (Heparin-Natrium)[3] | ||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse | |||||||||
| Wirkmechanismus | |||||||||
| Eigenschaften | |||||||||
| Löslichkeit |
leicht löslich in Wasser und Salzlösung, praktisch unlöslich in Ethanol, Aceton, Benzol und Diethylether (Heparin-Natrium)[3] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten |
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Die gerinnungshemmende Wirkung beruht darauf, dass im Blut Antithrombin III zirkuliert, ein Proteaseinhibitor, der aktivierte Gerinnungsfaktoren wie Thrombin und Faktor Xa hemmt. Heparin bindet an Antithrombin III, wodurch die Bindung an die Gerinnungsfaktoren etwa tausendfach schneller abläuft.
Heparin wird angewandt zur Prophylaxe sowie Therapie von Thrombosen und um das Gerinnen von Blutproben zu vermeiden.
Seine Dosis wird nicht in Gramm angegeben, sondern in Internationalen Einheiten (IE): Eine Einheit verhindert die Gerinnung von 1 ml citrathaltigem Plasma nach Zugabe von CaCl2 bei 37 °C über eine Stunde.
Geschichte
Entdeckt wurde Heparin 1916 von Jay McLean. Nachdem die US-amerikanischen Hämostaseologen William Henry Howell (1860–1945) und Luther Emmett Holt Jr. 1918 auf diese gerinnungshemmende Substanz aufmerksam gemacht hatten und sie wegen des Vorkommens vor allem in der Leber (griechisch hepar) „Heparin“ genannt haben, wurde es in den 1920er Jahren von Howell und Charles Best näher untersucht. Howell hatte bereits am 7. April 1917 in einer Harvey Lecture auf die Untersuchungen seine Mitarbeiter McLean hingewiesen, die zur Entdeckung des „antikoagulierenden Proantithrombins“, also des Heparin, geführt hatten.[11] Chemisch entschlüsselt war Heparin 1935. Die erste therapeutische Anwendung von aus Rinderlunge und Schweinedarm extrahiertem Heparin erfolgte 1937 zur Behandlung der tiefen Beinvenenthrombose durch Clarence Crafoord[12] in Stockholm. Die Markteinführung als Medikament zur Therapie und Prophylaxe von thromboembolischen Erkrankungen erfolgte dann in den 1940er Jahren.[13]
Struktur
Heparine sind variabel veresterte Glycosaminoglycane, bestehend aus jeweils abwechselnden Folgen von D-Glucosamin und einer Uronsäure (D-Glucuronsäure oder L-Iduronsäure).[14] Viele Monomereinheiten enthalten an Sauerstoff- und Stickstoffatome gebundene Sulfat-Gruppen.
Ab einer Kettenlänge von fünf Monosacchariden (drei D-Glucosamine und zwei Uronsäuren) wirken die Glykosaminoglycane gerinnungshemmend. Den Kettenbausteinen entsprechend besitzen sie viele negative Ladungen, über welche sie auch an Antithrombin III koppeln. Natives Heparin wird auch als unfraktioniertes Heparin (UFH), depolymerisierte Heparine mit mittleren relativen Molmassen unterhalb von 8000 (mit mindestens 80 % unterhalb von 8000)[15] als niedermolekulare Heparine (NMH), englisch Low Molecular Weight Heparine (LMWH) bezeichnet.
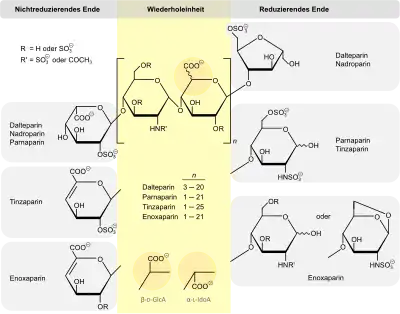
Das arzneilich verwendete, unfraktionierte Heparin (auch Standardheparin genannt) weist eine Molmasse von 6000 bis 30.000 Dalton (Da) auf. Durch chemische oder enzymatische Spaltung und Fraktionierung werden niedermolekulare, therapeutisch verwendbare Heparine mit mittleren Molmassen um die 5000 Dalton gewonnen: Certoparin (5400 Da), Dalteparin (6100 Da), Enoxaparin (4500 Da), Parnaparin (5000 Da), Nadroparin (4300 Da), Reviparin (4400 Da) und Tinzaparin (6500 Da).[16]
Biosynthese
Heparin wird primär nicht im Bindegewebe gebildet, sondern fast nur in Mastzellen und dort gespeichert.
Wirkungsmechanismus
Sowohl NMH als auch UFH binden Antithrombine, vor allem Antithrombin III (AT III). Der daraus resultierende Komplex wird Sofortinhibitor genannt und beschleunigt die Inaktivierung von aktivierten Gerinnungsfaktoren um das Tausendfache. NMH inaktiviert vornehmlich den Prothrombinasekomplex, bestehend aus aktiviertem Faktor X (Stuart-Prower-Faktor), aktiviertem Faktor V (Proakzelerin), Calciumionen und Phospholipiden. UFH inaktiviert neben dem Prothrombinasekomplex auch den aktivierten Faktor II = Thrombin. Insofern erklärt sich die schneller gerinnungshemmende Wirkung von UFH gegenüber NMH.
Des Weiteren werden die Faktoren IX (Antihämophilie Faktor B bzw. Christmas-Faktor), XI (Rosenthal-Faktor) und XII (Hagemann-Faktor) inaktiviert. Die fibrinolytisch aktive Serinprotease Kallikrein wird außerdem aktiviert. Ein weiterer Wirkmechanismus besteht darin, dass das Polyanion Heparin Ca-Ionen bindet, die Verminderung von Ca-Ionen ist gerinnungshemmend.
Pharmakokinetik
Heparin wird intravenös, subkutan oder perkutan verabreicht, wobei die Wirksamkeit der perkutanen Verabreichung umstritten ist.[10] Bei subkutaner Gabe von UFH resultiert eine 30%ige Bioverfügbarkeit. Bei intravenöser Applikation kommt es initial zu einer schnellen Elimination von 40 % des injizierten UFH (schnell ablaufender Sättigungsprozess aufgrund der vielen negativen Ladungen bindet UFH am Endothel und an Makrophagen sowie an Plasmaproteine) mit einer Halbwertszeit von 5–15 Minuten, welche dann in eine langsamere Elimination mit einer HWZ von 60–90 Minuten mündet (renale Elimination über glomeruläre Filtration und tubuläre Sekretion). Erst wenn alle Bindungsstellen abgesättigt sind, wird die Dosis-Wirkungs-Beziehung linear und der therapeutisch wirksame Spiegel erreicht. UFH ist nicht plazentagängig und tritt nicht in die Muttermilch ein, es kann somit in der Schwangerschaft und Stillzeit eingesetzt werden.
NMH weisen eine geringere Affinität zu Plasmaproteinen, vaskulären Matrixproteinen, Makrophagen, Thrombozyten und Endothelzellen auf. Daraus erklärt sich eine bessere Bioverfügbarkeit, die längere Eliminationshalbwertszeit und die ausschließlich renale Clearance der NMH. Nach subkutaner Injektion ergibt sich eine 90 % + Bioverfügbarkeit. Bei eingeschränkter Nierenfunktion muss ggf. eine Dosisreduktion erfolgen. NMH ist nicht plazentagängig, ein Übertritt in die Muttermilch ist nicht bekannt.
Indikationen

UFH ist unter anderem indiziert:
- Prophylaxe peri- und postoperativer Thrombosen
- Therapie der tiefen Venenthrombose und der Lungenembolie
- Therapie arterieller Embolien
- Antikoagulans bei extrakorporaler Zirkulation (z. B. Dialyse)
- unter besonderen Gesichtspunkten:
- zur Therapie der DIC (= disseminierte intravasale Coagulation)
- zur Begleittherapie der Thrombolyse
- zur Therapie des akuten Myokardinfarktes.
NMH ist unter anderem angezeigt:
- zur peri- und postoperativen Prophylaxe von venösen Thrombosen
- Therapie der tiefen Venenthrombose
- Therapie der nicht massiven (normotensiven) Lungenembolie
- Thromboseprophylaxe bei instabiler Angina Pectoris sowie teilweise beim Akuten Koronarsyndrom
- Antikoagulans bei der Hämodialyse.
Ferner wird Heparin in Form eines sogenannten Heparinblocks zum Offenhalten von Gefäßkathetern verwendet. Die Zuleitung wird dazu mit heparinisierter NaCl-Lösung gespült, so dass darin keine Koagulation stattfinden kann.
In Deutschland besteht für viele NMH noch keine Zulassung für jede dieser Indikationen.
Gegenanzeigen und Anwendungsbeschränkungen
Nicht angewendet werden dürfen Heparine bei vermuteter oder bestehender Blutungsneigung, Magen-Darm-Geschwüren und drohender Fehlgeburt.[17] Eine kritische Nutzen-Risiko-Analyse und sorgfältige laboranalytische Überwachung des Patienten sind notwendig bei:
- therapieresistente arterielle Hypertonie und hypertensive Retinopathie
- Leber- und Nierenerkrankungen mit eingeschränkter Funktion, akute Pankreatitis
- schwere Stoffwechselerkrankungen wie Diabetes mellitus
- fortgeschrittenes Malignom
- fortgeschrittenes Alter (mit erhöhter Morbidität)
- Überempfindlichkeit oder vorausgegangene HIT II
hochdosiert:
- bestehende oder drohende innere Blutungen
- Punktion an Arterien und parenchymatösen Organen, intramuskuläre Injektionen (<7 Tage)
- frische Operationen (Abhängig von Dauer und Art des Eingriffs)
- bakterielle Endokarditis
- Mitralklappenfehler mit Vorhofflimmern.
Bei rückenmarksnahen Regionalanästhesie-Verfahren (Spinalanästhesie bzw. Periduralanästhesie) sollte unfraktioniertes Heparin (UFH) vier bis sechs Stunden vorher abgesetzt werden und frühestens eine Stunde nach dem Eingriff wieder gegeben werden. Bei NMH-Prophylaxe sollte der Wirkstoff 12 Stunden vorher, bei NMH-Therapie 24 Stunden vorher abgesetzt werden und erst vier Stunden nach dem Eingriff wieder gegeben werden.[18][19]
Unerwünschte Wirkungen
Die Hauptnebenwirkung von Heparin sind Blutungen. Das Risiko ist dosisabhängig und steigt mit gleichzeitiger Anwendung anderer die Blutgerinnung hemmender Medikamente. Als Gegenmittel kann Protamin intravenös verabreicht werden. Heparin kann als Nebenwirkung eine Heparin-induzierte Thrombozytopenie auslösen. Dabei kann es durch Antikörper gegen Heparin sowohl zu lebensgefährlichen Blutungen als auch Blutgerinnselbildungen kommen. Eine Behandlung länger als vier Wochen kann eine messbare Verminderung der Knochendichte auslösen. Bis zu 2–3 % der Patienten unter Langzeitbehandlung mit Heparin erleiden osteoporotische Wirbelkörperfrakturen. Ebenso sind reversible Erhöhungen der Transaminasen häufig. Niedermolekulare Heparine weisen eine geringere Häufigkeit dieser Nebenwirkungen auf. Sie haben jedoch gegenüber dem längerkettigen Heparin aufgrund ihrer geringeren Wirkung auf die Deaktivierung von Thrombin einen geringeren therapeutischen Effekt.[20]
Kontrolle
Damit weder zu viel (Gefahr der Blutung) noch zu wenig (Gefahr der Thrombose) Heparin gegeben wird, sollte bei Patienten mit UFH die PTT (Partial Thromboplastin Time, partielle Thromboplastinzeit) bestimmt werden.
Niedermolekulares Heparin muss normalerweise nicht kontrolliert werden – ein wichtiger Vorteil für den Patienten. Bei Bedarf kann aber die richtige Dosierung durch Messung der Anti-Xa-Aktivität bestimmt werden. Dabei muss die Messung vier Stunden nach der subkutanen Injektion erfolgen, um standardisierte Bedingungen zu schaffen.[21]
Niedermolekulare Heparine in der Übersicht
Die Tabelle zeigt eine Übersicht charakteristischer Daten für einige therapeutisch genutzte niedermolekulare Heparine im Vergleich zu Standardheparin.
| Name | Mittlere Molmasse (kD)[22][23] | Sulfatierungsgrad[24][22] | Verhältnis Anti-Xa- zu Anti-IIa-Aktivität[23] |
HWZ (Stunden)[25][17] |
|---|---|---|---|---|
| Heparin-Natrium | 6,0 – 30,0 | 1,0 (0,9 – 1,1) | 2 | |
| Bemiparin-Natrium | 3,6 (3,0 – 4,2) | 2 | 8 [26] | 5 – 6 [26] |
| Nadroparin-Calcium | 4,3 (3,6 – 5,0) | 2,1 | 2,5 – 4,0 | 3,5 |
| Enoxaparin-Natrium | 4,5 (3,5 – 5,5) | 2 | 3,3 – 5,3 | 5 – 7 |
| Parnaparin-Natrium | 5,0 (4,0 – 6,0) | 2,0 – 2,6 | 1,5 – 3,0 | 6 [27] |
| Certoparin-Natrium | 5,0 – 7,0 4,2 – 6,2 [28] |
2 – 2,5 | 2,2 [28] | 4,3 |
| Dalteparin-Natrium | 6,0 (5,6 – 6,4) | 2,0 – 2,5 | 1,9 – 3,3 | 4 |
| Tinzaparin-Natrium | 6,5 (5,5 – 7,5) | 1,8 – 2,5 | 1,5 – 2,5 | 3,7 |
Fertigarzneimittel
Monopräparate (Standardheparin)
Calciparine (CH), Gelparin (CH), Lioton (A, CH), Liquemin (CH), Lyman (CH), Sportino (D), Thrombareduct (D), Thrombophob (D), Vetren (D), zahlreiche Generika (D, A, CH)
Monopräparate (niedermolekulare Heparine)
Mono-Embolex, Fragmin P, Clexane, Lovenox, Fraxiparin, Clivarin, Innohep
Siehe auch
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 345.
- Eintrag zu HEPARIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Heparin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2014.
- Datenblatt Heparin sodium salt, Thermo Scientific bei AlfaAesar, abgerufen am 18. Juni 2019 (PDF) (JavaScript erforderlich).
- Eintrag zu Heparin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Eintrag zu Heparin sodium in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- AOK.de: Therapien: Heparinisierung (Memento vom 23. Juli 2012 im Webarchiv archive.today).
- Aktories, Förstermann, Hofmann, Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, S. 531.
- Gebrauchsinformation Heparin AL Gel 30.000. (Memento vom 21. März 2014 im Internet Archive) (PDF; 43 kB) Aliud Pharma, April 2010.
- Heinz Lüllmann, Klaus Mohr: Pharmakologie und Toxikologie. Arzneimittelwirkungen verstehen – Medikamente gezielt einsetzen. 17. Auflage. Georg Thieme Verlag, 2010, ISBN 978-3-13-368517-7, S. 198.
- Jost Benedum: Die Frühgeschichte der künstlichen Niere. In: AINS. Anästhesiologie Intensivmedizin Notfallmedizin Schmerztherapie. Band 38, Nr. 11, November 2003, S. 681–688, hier: S. 686.
- Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 63.
- Doris Schwarzmann-Schafhauser: Heparin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 570.
- Wissenschaft-Online-Lexika: Eintrag zu Heparin im Lexikon der Biochemie. abgerufen am 30. März 2009.
- European Pharmacopoeia Commission (Hrsg.): European Pharmacopoeia 9.0. 2016, S. 2194 f.
- E. Mutschler, G. Geisslinger, H. K. Kroemer, S. Menzel, P. Ruth: Mutschler Arzneimittelwirkungen. Pharmakologie − Klinische Pharmakologie – Toxikologie. 10. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012, ISBN 978-3-8047-2898-1, S. 478 f.
- G. Geisslinger, S. Menzel, T. Gudermann, B. Hinz, P. Ruth: Mutschler Arzneimittelwirkungen. Pharmakologie – Klinische Pharmakologie – Toxikologie. Begründet von Ernst Mutschler, 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, ISBN 978-3-8047-3663-4. S. 480 ff.
- Wiebke Gogarten, Hugo K. Van Aken: Perioperative Thromboseprophylaxe – Thrombozytenaggregationshemmer – Bedeutung für die Anästhesie. In: AINS – Anästhesiologie · Intensivmedizin · Notfallmedizin · Schmerztherapie. Ausgabe 04, April 2012, S. 242–254, doi:10.1055/s-002-23167.
- S. A. Kozek-Langenecker, D. Fries, M. Gütl, N. Hofmann, P. Innerhofer, W. Kneifl, L. Neuner, P. Perger,T. Pernerstorfer, G. Pfanner u. a.: Lokoregionalanästhesien unter gerinnungshemmender Medikation. Empfehlungen der Arbeitsgruppe Perioperative Gerinnung (AGPG) der Österreichischen Gesellschaft für Anästhesiologie und Intensivmedizin (ÖGARI). In: Der Anaestesist. Volume 54, Number 5 2005, S. 476–484, doi:10.1007/s00101-005-0827-0.
- Jeffrey I. Weitz: Antiplatelet, Anticoagulant and Fibrinolytic Drugs. In: Anthony S. Fauci u. a. (Hrsg.): Harrison’s Principles of Internal Medicine. 18. Auflage. New York 2012, S. 994–996.
- med4you.at: Anti-Xa-Aktivität („Heparinspiegel“) – Übersicht, 6. Februar 2009.
- WHO: Lists of Recommended and Proposed INNs (sofern nicht anders angegeben); L31, L32, L34, L37, L39.
- Europäisches Arzneibuch, 9. Ausgabe, Grundwerk 2017, jeweilige Stoffmonografie (sofern nicht anders angegeben).
- Durchschnittliche Zahl Sulfatgruppen pro Disaccharideinheit (Zirka-Angabe).
- HWZ = Plasmahalbwertszeit, gemessen als Anti-Faktor-Xa-Aktivität.
- Fachinformation Ivor Injektionslösung, ROVI Pharma S.A., Stand Februar 2021.
- Riassunto delle Caratteristiche del Prodotto Fluxum Soluzione iniettabile, Alfasigma S.p.A, Stand März 2021.
- Fachinformation Mono-Embolex Injektionslösung, Aspen Pharma, Stand März 2020.