Calciumfluorid
Calciumfluorid (auch Kalziumfluorid, eigentlich Calciumdifluorid) ist das Calciumsalz der Fluorwasserstoffsäure.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
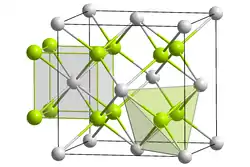 | ||||||||||||||||||||||
| _ Ca2+ _ F− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumfluorid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | CaF2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 78,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
3,18 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
2500 °C[2] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (15 mg·l−1 bei 18 °C)[2] | |||||||||||||||||||||
| Brechungsindex |
1,4338[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
1 mg·m−3[2] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Eigenschaften
Calciumfluorid bildet farblose, in Wasser, Alkohol und verdünnten Säuren schwerlösliche Kristalle mit dem weitverbreiteten Fluoritgitter. Natürlich vorkommendes Calciumfluorid heißt Fluorit oder Flussspat und ist meist durch Verunreinigungen gelb, grün, blau, braun, beige oder violett gefärbt. Für Ultraviolett- und Infrarotstrahlung besitzt es eine hohe Durchlässigkeit. Alkalilaugen greifen Calciumfluorid nicht an. Mit Wasserstoff und Sauerstoff erfolgt auch unter Rotglut keine Reaktion.
Reaktionen
- Calciumfluorid und Schwefelsäure setzen Fluorwasserstoff frei.
- Calcium-Kationen und Fluorid-Anionen bilden immer das schwerlösliche Calciumfluorid.
Vorkommen und Gewinnung

Flussspat wird in großen Mengen, mehrere Millionen Tonnen pro Jahr, im Tage- und Tiefbau bergmännisch gewonnen. Da es mit anderen Mineralien wie Schwerspat (Bariumsulfat BaSO4, Bleiglanz PbS und Quarz SiO2) vergesellschaftet ist, muss das 30–60 % CaF2 enthaltende Roherz vor einer industriellen Verwertung aufgearbeitet werden. Hierzu wird das geförderte Erz mechanisch zerkleinert und anschließend durch (mehrstufige) Flotation auf bis zu 98 % aufkonzentriert. Als Handelsform unterscheidet man
- Kristallspat mit mehr als 99 % CaF2
- Säurespat mit mehr als 97 % CaF2
- Keramikspat mit mehr als 95 % CaF2
- Hüttenspat mit mehr als 85 % CaF2
- Metallspat mit 75–82 % CaF2
Reines Calciumfluorid gewinnt man durch Umsatz von Fluorwasserstoff oder Hexafluorokieselsäure mit Calciumcarbonat, da ausgefälltes Calciumfluorid in Abwesenheit von Calciumcarbonat gelatinöse Konsistenz hat und daher schwer zu reinigen ist.[6]
Verwendung
Calciumfluorid ist neben den Fluoriden aus der Phosphorsäureherstellung der wichtigste Rohstoff zur Fluorherstellung. Entsprechend den oben genannten Flussspatqualitäten wird Calciumfluorid für folgende Anwendungen verwendet:
- Kristallspat zum Schleifen von Linsen und optischen Gläsern
- Säurespat für die Herstellung von Fluorwasserstoff
- Keramikspat für die Herstellung von Glas und Email
- Hüttenspat als Flussmittel und Schlacke in der Metallurgie
Weitere Anwendungen:
- Katalysator für die Kalkstickstoffherstellung
- Wegen ihrer Durchlässigkeit für ultraviolettes und infrarotes Licht werden Einkristalle in der instrumentellen Analytik und bei der Herstellung von elektronischen Schaltkreisen als Linsen verwendet.
- Wegen seiner optischen Eigenschaften kommen in hochwertigen Objektiven und Fernrohren Calciumfluoridlinsen in Apochromaten zum Einsatz.
- Aufgrund der gegenseitigen Kompensation der Änderung des Brechungsindex und der Wärmedehnung sind thermische Linsen nur schwach ausgeprägt. Aus diesem Grund wird Calciumfluorid als Fenster für Laserstrahlen mit hoher Leistungsdichte eingesetzt.
- Standardmineral der Mohsschen Härteskala (Härte 4).
Vorsichtsmaßnahmen
Bei Kontakt mit starken Säuren wird Fluorwasserstoff freigesetzt. Dieser ist außerordentlich giftig und stark ätzend.
Nachweis
Ätzprobe: CaF2 mit etwas konzentrierter Schwefelsäure in ein Reagenzglas geben. Die Benetzung der Glasoberfläche ändert sich, da Fluorwasserstoffsäure HF entsteht.
Ultradünne Schichten
Nanometerdünne kristalline CaF2-Schichten werden als Barrieren in den Festkörperheterostrukturen, insbesondere in den Resonanztunneldioden (mit CdF2 oder Si als Quantentopf) benutzt[7]. Ferner untersucht man die Möglichkeiten ihrer Verwendung als Gateisolator in den Feldeffekttransistoren[8], statt üblicher Materialien wie SiO2 und high-k-Oxide.
Solche Schichten werden mittels der Molekularstrahlepitaxie auf dem Silizium gewachsen[7][8]; gute Qualität wird dabei dank Ähnlichkeit der Gitterkonstanten von Si und CaF2 gewährt.
Einzelnachweise
- Eintrag zu CALCIUM FLUORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Dezember 2021.
- Eintrag zu Calciumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Dezember 2019. (JavaScript erforderlich)
- Korth Kristalle: Calciumfluorid, abgerufen am 9. Dezember 2015.
- H. Kojima, S. G. Whiteway, C. R. Masson: Melting points of inorganic fluorides. In: Canadian Journal of Chemistry. 46 (18), 1968, S. 2968–2971, doi:10.1139/v68-494.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, S. 10-245.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 233–4.
- M. Watanabe et al.: CaF2/CdF2 double-barrier Resonant Tunneling Diode with high room-temperature peak-to-valley ratio. Jpn. J. Appl. Phys., v. 39, no. 7B, p. L716. 2000. Abgerufen am 16. Dezember 2020.
- Ultradünne Isolatoren ebnen Weg zu weiterer Miniaturisierung bei Mikrochips. DerStandard. 28. Juli 2019. Abgerufen am 16. Dezember 2020.