Fluorit
Fluorit, auch unter der bergmännischen Bezeichnung Flussspat oder seiner chemischen Bezeichnung Calciumfluorid bekannt, ist das Calciumsalz der Flusssäure und ein sehr häufig vorkommendes Mineral aus der Mineralklasse der einfachen Halogenide. Fluorit kristallisiert im kubischen Kristallsystem mit der chemischen Zusammensetzung CaF2 und entwickelt kubische Kristalle mit vorwiegend würfeliger oder seltener oktaedrischer Kristallform sowie Durchdringungszwillinge, aber auch körnige, massige Aggregate.
| Fluorit | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| Andere Namen |
|
| Chemische Formel | CaF2 |
| Mineralklasse (und ggf. Abteilung) |
Halogenide |
| System-Nr. nach Strunz und nach Dana |
3.AB.25 (8. Auflage: III/A.08) 09.02.01.01 |
| Kristallographische Daten | |
| Kristallsystem | kubisch |
| Kristallklasse; Symbol | kubisch-hexakisoktaedrisch; 4/m 3 2/m |
| Raumgruppe | Fm3m (Nr. 225) |
| Gitterparameter | a = 5,463 Å[1] |
| Formeleinheiten | Z = 4[1] |
| Häufige Kristallflächen | {001}, {111} |
| Zwillingsbildung | Durchkreuzungszwillinge nach (111) |
| Physikalische Eigenschaften | |
| Mohshärte | 4 |
| Dichte (g/cm3) | 3,2 |
| Spaltbarkeit | vollkommen nach {111} |
| Bruch; Tenazität | muschelig bis splittrig |
| Farbe | in reiner Form farblos, gelb, grün, rot, violett auch schwärzlich |
| Strichfarbe | weiß |
| Transparenz | durchsichtig bis undurchsichtig |
| Glanz | Glasglanz |
| Radioaktivität | manchmal durch eingewachsene Uranminerale |
| Kristalloptik | |
| Brechungsindex | n = 1,433 bis 1,448 |
| Doppelbrechung | keine |
| Weitere Eigenschaften | |
| Chemisches Verhalten | wird durch Schwefelsäure gelöst |
| Besondere Merkmale | blaue bis blaugrüne Fluoreszenz, Phosphoreszenz, Tribolumineszenz |
Reiner Fluorit ist farblos und transparent, durch Verunreinigungen auch grau. Er kann jedoch durch Fremdbeimengungen fast alle Farben, zumeist in schwacher Intensität, annehmen. Verbreitet sind grüne, violette bis schwarzviolette und gelbe Kristalle („Honigspat“), aber auch blaue, rote und braune Fluorite werden gefunden. Ebenso kann häufig ein zonarer Farbwechsel beobachtet werden. Die Strichfarbe ist dagegen immer Weiß.
Fluorit ist das Leitmineral (Skalamineral) der Mohsschen Härteskala für die Härte 4.
Etymologie und Geschichte
Flussspat war schon im antiken Griechenland bekannt. Der deutsche Name geht auf die Verwendung als Flussmittel in der Metallverarbeitung zurück. 1824 entdeckte der deutsche Mineraloge Friedrich Mohs die im ultravioletten Licht sichtbar werdende Fluoreszenz.
Der irische Mathematiker und Physiker George Gabriel Stokes benannte das Phänomen der Fluoreszenz nach dem Fluorit in Analogie zur Opaleszenz zum Opal.[2]
Klassifikation
In der veralteten, aber teilweise noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Fluorit zur allgemeinen Abteilung der „Einfachen Halogenide“, wo er zusammen mit Coccinit, Frankdicksonit, Gagarinit-(Y), Laurelit, Tveitit-(Y) und Gagarinit-(Ce) (ehemals Zajacit-(Ce)) eine eigene Gruppe bildete.
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunzschen Mineralsystematik ordnet den Fluorit in die neue und präzisere Abteilung der „Einfachen Halogenide ohne H2O“ ein. Diese ist zudem weiter unterteilt nach dem Stoffmengenverhältnis von Kationen (M) und Anionen (X), so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „M : X = 1 : 2“ zu finden ist, wo es als Namensgeber die „Fluoritgruppe“ mit der System-Nr. 3.AB.25 und den weiteren Mitgliedern Fluorocronit (IMA 2010-023), Frankdicksonit, Strontiofluorit (IMA 2009-014) bildet.
Die im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Fluorit in die Klasse der „Halogenide (und Verwandte)“ und dort in die Abteilung der „Halogenide“ ein. Hier ist er namensgebendes Mineral der „Fluoritgruppe“ mit der System-Nr. 09.02.01 und den weiteren Mitgliedern Frankdicksonit, Tveitit-(Y) und Strontiofluorit innerhalb der Unterabteilung der „Wasserfreien und wasserhaltigen Halogenide mit der Formel AX2“.
Kristallstruktur
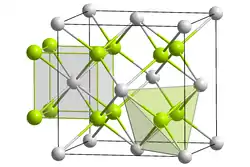
Fluorit kristallisiert im kubischen Kristallsystem in der höchstsymmetrischen Kristallklasse 4/m 3 2/m (kubisch-hexakisoktaedrisch) beziehungsweise der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit dem Gitterparameter a = 5,463 Å sowie 4 Formeleinheiten pro Elementarzelle.[1]
In der Kristallstruktur bilden die Ca2+-Ionen eine kubisch dichteste Kugelpackung, die einem kubisch flächenzentrierten Gitter (fcc, face centered cubic) entspricht. Die Flächenzentrierung der Elementarzelle (siehe Bild rechts) kann auch aus dem Raumgruppensymbol abgelesen werden („F“). Die Fluoridionen (F−) besetzen alle Tetraederlücken der dichtesten Kugelpackung aus Calciumionen. Da in einer dichtesten Kugelpackung immer doppelt so viele Tetraederlücken wie Packungsteilchen enthalten sind, ergibt sich in der Struktur ein Calcium-Fluor-Verhältnis von 1:2, was sich auch in der chemischen Formel des Fluorits, CaF2, widerspiegelt. Als Koordinationspolyeder ergibt sich für die Fluoridionen dadurch ein Tetraeder aus vier Calciumionen, die Calciumionen ihrerseits werden von acht Fluoratomen in Form eines Würfels umgeben. Die Kationen- und Anionen-Teilgitter sind nicht kommutativ, d. h. gegeneinander austauschbar. Die so genannte Fluorit-Struktur findet sich bei einer Reihe weiterer Salze, wie bei den Fluoriden SrF2, BaF2, CdF2, HgF2 und PbF2. Auch kommt die Fluorit-Struktur beispielsweise bei Li2O, Li2S, Na2O, Na2S, K2O, K2S, Rb2O und Rb2S vor. Seine Kristallstruktur ist isotyp mit Uraninit.
Eigenschaften
Morphologie
Fluorit bildet häufig gut ausgebildete, würfelförmige und oktaederförmige Kristalle. In Kombination mit diesen Hauptformen zeigen Fluoritkristalle oft Flächen weiterer Formen. Verbreitet sind Flächen des Rhombendodekaeders {110}, Tetrakishexaeders {210} (zusätzliche Flächen parallel zu den Würfelkanten), ferner des Ikositetraeders {211} oder {311} und Hexakisoktaeders {421}.
Die Kristalltracht der Fluoritkristalle ist temperaturabhängig. So entstehen bei hohen Bildungstemperaturen vorwiegend Oktaeder {111}, bei mittleren Temperaturen eher Rhombendodekaeder {110} und bei niedrigen Temperaturen Würfel {100} als trachtbeherrschende Formen.[3]
Die Würfelflächen sind meist glatt und glänzend. Oktaeder- und Rhombendodekaederflächen erscheinen dagegen oft rau und matt und sind dann meist aus winzigen Würfelflächen zusammengesetzt. Bei den im Handel verbreiteten losen, oktaederförmigen Fluoritkristallen mit glatten glänzenden Flächen handelt es sich fast nie um in dieser Form gewachsene Kristalle, sondern um Spaltoktaeder.
Weiterhin bildet Fluorit kugelförmige und traubenförmige Aggregate, Krusten oder auch Stalaktiten. Als Besonderheit sind die Skalenoeder-Fluorite zu nennen, wie Funde aus der Flussspatgrube Cäcilia bei Freiung (Gemeinde Stulln in der Oberpfalz) belegen. Bei genauerer Untersuchung stellte sich aber heraus, dass diese ebenfalls dem kubischen System zugeordnet werden müssen und nur durch Verätzung entstanden sind.[4]
- Kristallformen und Aggregate
 Würfel {100}
Würfel {100} Würfel {100}
Würfel {100} Oktaeder {111}
Oktaeder {111} Oktaeder {111}
Oktaeder {111} Würfel und Rhombendodekaeder {100}, {110}
Würfel und Rhombendodekaeder {100}, {110} Würfel und Oktaeder (Kuboktaeder) {100}, {111}
Würfel und Oktaeder (Kuboktaeder) {100}, {111} Oktaeder, Würfel und Rhombendodekaeder {111}, {100}, {110}
Oktaeder, Würfel und Rhombendodekaeder {111}, {100}, {110} Rhombendodekaeder, Oktaeder, Würfel {110}, {111}, {100}
Rhombendodekaeder, Oktaeder, Würfel {110}, {111}, {100} Kugelförmiger Fluorit
Kugelförmiger Fluorit Traubenförmiger Fluorit
Traubenförmiger Fluorit
Physikalische Eigenschaften



Durch Einlagerung von Lanthanoiden, zum Beispiel Eu2+, kann Fluorit unter Anregung mit UV-Licht starke Fluoreszenz zeigen und durch Erwärmung auch Phosphoreszenz[5] sowie bei starker mechanischer Beanspruchung Tribolumineszenz.
Fluorit ist ein elektrischer Nichtleiter. Sein Schmelzpunkt beträgt 1392 °C.[5]
Im Dünnschliff unter dem Mikroskop ist Fluorit im linear-polarisierten Licht dadurch auffällig, dass er aufgrund seines relativ niedrigen Brechungsindexes gegenüber fast allen Begleitmineralien ein stark negatives Relief zeigt. Unter gekreuzten Polfiltern zeigt er als kubisch kristallisiertes Mineral Isotropie, d.h., er bleibt dunkel.[6]
Chemische Eigenschaften
Bei Kontakt mit starken Säuren wie z. B. Schwefelsäure setzt Fluorit hochgiftigen Fluorwasserstoff frei.
Farbe
Obwohl reines CaF2 farblos ist, gehört Fluorit zu den Mineralen mit den meisten Farbvariationen überhaupt. Die dunkle Färbung vieler Fluorite entsteht durch eingelagerte seltene Erden oder radioaktive Bestrahlung des Flussspats (Stinkspat), wobei auch eingewachsene Uranminerale die Färbung verstärken können.
Die Farbursachen sind vielfältig und nicht immer vollständig geklärt.[7] Färbend wirken zumeist Spurengehalte von Seltenerdelementen, die oft erst durch radioaktive Bestrahlung zu färbenden Ionen ionisiert werden. Welche Seltenerdelemente hierbei ionisiert werden, kann von der Art der Bestrahlung abhängen. So können Fluorite bei gleichen Gehalten an Spurenelementen in der Umgebung von thoriumhaltigen Mineralen andere Farben entwickeln als in der Umgebung von uranhaltigen Mineralen. Weiterhin kann die Temperaturgeschichte die Farbe beeinflussen sowie der Einbau von Sauerstoffionen und OH− oder weiterer färbender Ionen. Spurengehalte nicht färbender Ionen wie Na+ oder Fe3+ stabilisieren färbende Gitterdefekte und beeinflussen so ebenfalls die Farbe.[8]
- Gelb: Die Farbe gelber Fluorite beruht auf dem Einbau von O3− und O2− anstelle von zwei benachbarten F−-Ionen. Der Ladungsausgleich erfolgt über den Ersatz von Ca2+ durch Na+.[9]
- Hellgrün: Die hellgrüne Farbe vieler Fluorite beruht auf Spurengehalten von Sm2+. Samarium (Sm) wird als Sm3+ anstelle von Ca2+ eingebaut. Die Reduktion zu Sm2+ erfolgt durch Aufnahme eines Elektrons, das bei der Oxidation anderer Kationen durch ionisierende Strahlung freigesetzt wird.[9]
Die Stabilität der grünen Farbe hängt davon ab, welche Kationen oxidiert werden. Unter reduzierenden Bedingungen gebildete Fluorite enthalten Spuren von Fe2+, das zu Fe3+ oxidiert werden kann und zusammen mit Samarium eine temperaturstabile grüne Farbe erzeugt. In unter eher oxidierenden Bedingungen gebildeten Fluoriten erfolgt die Erzeugung und Stabilisierung der grün färbenden Sm2+-Ionen durch Oxidation von Ce(Pr, Tb)3+ zu Ce(Pr, Tb)4+. Fluorite, die über diesen Mechanismus gefärbt sind, bleichen bei Tageslicht oder Erhitzung aus.[8]
- Gelbgrün: Fluorite einiger Lokalitäten (Redruth in England, Tübingen in Deutschland) zeigen eine grüne bis gelbgrüne Färbung, die auf das gemeinsame Vorkommen von Spuren von Yttrium (Y3+) und Cer (Ce3+) jeweils mit einem Farbzentrum (Leerstelle auf einer F−-Position, in der sich zwei Elektronen befinden) in direkter Nachbarschaft zurückzuführen ist.[9]
- Hellblau: Fluorite, die nur Y3+ enthalten, zusammen mit einer Leerstelle auf einer F−-Position, in der sich zwei Elektronen befinden, sind hellblau gefärbt.[9]
- Dunkelblau: Synthetische Fluorite können durch Bildung von kolloidalem Calcium (metallisch) intensiv blau bis violett gefärbt werden. Auch die blauviolette Farbe der natürlich vorkommenden „Blue John Fluorite“ aus Castelton bei Derbyshire in England wird darauf zurückgeführt.[9]
- Violett: Die Ursache der verbreiteten violetten Färbung natürlicher Fluorite ist nicht abschließend geklärt. Aktuell gelten Elektronendefekte im Kristallgitter als wahrscheinlichste Ursache der violetten Farbe von Fluorit.[7]
- Rosa, Rot: Die rosa bis rote Farbe von Fluoriten wird durch den Einbau von O23−-Molekülen verursacht, die durch benachbarte Y3+-Ionen stabilisiert werden.[9]
- Farbvariationen
 Violett
Violett Blauviolett
Blauviolett Hellblau
Hellblau Blaugrün
Blaugrün Hellgrün
Hellgrün Gelb
Gelb Orange
Orange Rot
Rot Rosa
Rosa Farblos
Farblos
Stinkspat (Antozonit)
Als Stinkspat bezeichnet man eine dunkelviolette bis schwarze Varietät des Fluorits, die beim Zerkleinern einen stechenden Geruch entwickelt. Stinkspat kommt oft (aber nicht immer) zusammen mit Uranmineralien vor, die teilweise als feinste Partikel im Stinkspat eingeschlossen sein können. Die Typlokalität und bekannteste deutsche Fundstelle ist Wölsendorf in der Oberpfalz.
Durch Reiben oder Schlagen des Kristalls wird gasförmiges giftiges Fluor (F2) freigesetzt, welches den Geruch verursacht.
Die dunkelviolette bis schwarze Farbe hat mehrere Ursachen. Eine große Rolle spielt kolloidales metallisches Calcium, das zu einer dunkelblauen bis schwarzen Färbung führt. Hinzu kommen freie Elektronen auf leeren Fluorpositionen (F-Zentren), die typisch für violetten Fluorit sind.
Alle diese Eigenschaften des Stinkspates haben ihre Ursache in radioaktiver Bestrahlung des Fluorits. Stinkspat tritt typischerweise zusammen mit uranhaltigen Mineralen auf. Das darin enthaltene Uran und Thorium zerfällt und gibt dabei Gammastrahlung ab. Diese Strahlung setzt Elektronen aus den F−-Ionen frei und es bildet sich ein H-Zentrum, ein neutrales Fluoratom auf einer ansonsten leeren Gitterposition, das eine Atombindung zu einem benachbarten F−-Ion ausbildet. Die freigesetzten Elektronen werden von Gitterfehlstellen, leeren Fluorpositionen, eingefangen und bilden dort F-Zentren, einzelne Elektronen auf einer F−-Position, die von 4 Ca2+-Ionen umgeben sind. Diese F-Zentren sind nicht ortsstabil. Sie diffundieren durch das Kristallgitter und verbinden sich mit weiteren F-Zentren zu fluorfreien Ca-Nanopartikeln mit 5 bis 30 nm Durchmesser. Diese Cluster werden auch als „kolloidales Ca“ bezeichnet und tragen zur blauschwarzen Farbe des Stinkspates bei.[10][11]
Varietäten
Bisher sind mehrere Varietäten von Fluorit bekannt, bei denen geringe Anteile des Calciums durch seltene Erden wie Cer und Yttrium ersetzt sind:
Yttrofluorit (1911[12]) und Cerfluorit wurden von Thorolf Vogt zunächst als neue Mineralarten aus dem nördlichen Norwegen beschrieben. Nach weitergehenden Schmelzfluss-Analysen 1913 durch Gustav Tammann und Vogt wurde festgestellt, dass Fluorit bis zu 50 Gewichts-% Yttriumfluorid (YF3, Yttrofluorit) und bis zu 55,8 % Cer(III)-fluorid (CeF3, Cerfluorit) enthalten kann. Es besteht daher theoretisch ein Dreistoff-Mischkristallsystem, wobei allerdings die idealisierten Zusammensetzungen YF3 und CeF3 bisher nur synthetisch bekannt und nur bis zu den oben genannten prozentualen Anteilen von Fluorit untersucht wurden.[13]
Weder Cerfluorit noch Yttrofluorit wurden bisher in einer für eine Anerkennung durch die International Mineralogical Association (IMA) ausreichend hohen Stoffreinheit in der Natur entdeckt. Yttrofluorit wurde 2006 offiziell von der IMA diskreditiert, Cerfluorit dagegen noch bis 2009 als hypothetisches Mineral in der IMA-Mineralliste geführt.[14]
Yttrocerit wurde 1815 von Johan Gottlieb Gahn und Jöns Jakob Berzelius als Mineral beschrieben;[15] Vogt hielt jedoch 1913 in seinen Analyseergebnissen fest, dass es sich hierbei um ein Gemisch aus Yttrofluorit und Cerfluorit handelt.[13]
Bildung und Fundorte
Fluorit kommt meist massiv, gelegentlich auch in kristalliner Form vor, und ist oft mit Baryt, Quarz, Topas, Calcit, Bleiglanz und Zinkblende assoziiert. Hydrothermale Gänge, in denen Fluorit die Gangart bildet, stellen die kommerziell bedeutendste Art seines Vorkommens dar. Daneben sind durch Metasomatose gebildete Lagerstätten von Bedeutung, wobei für manche Vorkommen in Sedimentgesteinen auch eine synsedimentäre Bildung in Betracht gezogen wird.[16] Ansonsten ist er als gesteinsbildendes Mineral selten und findet sich nur gelegentlich auch Nebengemengteil in fluorhaltigen Greisen, daneben in Graniten, Karbonatiten und anderen magmatischen Gesteinen wie Pegmatiten.
Der weltweit größte Flussspat-Bergbau findet sich in Mexiko, in der Lagerstätte Las Cuevas, die vulkanischen Ursprungs ist. Weitere reichhaltige Flussspat-Lagerstätten liegen in China, im indischen Amba Dongar, in Südafrika (Zwartkloof sowie Witkop im Transvaal), in Namibia (Okorusu), im kenianischen Kario Valley und in den US-amerikanischen Bundesstaaten Illinois und Kentucky. Eine bekannte Fundstätte des Flussspats in Europa sind die Berge und Höhlen um Castleton, im englischen Peak District, wo es unter dem Namen „Blue John“ bekannt ist und für die Schmuckherstellung abgebaut wird. Der Name ist eine Verballhornung des Französischen „bleu et jaune“, bedeutet also etwa „blau-gelb“.
Deutsche Lagerstätten sind zum Beispiel die Grube Clara bei Oberwolfach im Schwarzwald und die Grube Käfersteige bei Pforzheim; daneben findet sich Fluorit auch in der Oberpfalz, zwischen Nabburg und Schwarzenfeld, im Schortetal bei Ilmenau im Thüringer Wald (siehe auch: Schaubergwerk Volle Rose), im Erzgebirge bei Freiberg und Bärenstein,[17][18] im Vogtland in Schönbrunn (Vogtländische Flußspatwerke bzw. Patriot) und im östlichen Harz bei Straßberg. In geringen Mengen fand er sich in vielen Minerallagerstätten Deutschlands. In den 1970er Jahren wurde ein Vorkommen in Zechsteindolomiten im Raum Eschwege-Sontra in Nordhessen lagerstättenkundlich untersucht, doch wurden diese Aktivitäten aufgrund von Schwankungen auf dem Weltmarkt abgebrochen.[19]
In Österreich ist beispielsweise das – inzwischen erschöpfte – Vorkommen Vorderkrimml bekannt, heute Schaustollen.
Verwendung
Als Rohstoff
Industriell wird Fluorit hauptsächlich verwendet
- als Hüttenspat in der Metallindustrie als Flussmittel für Schlacken im Eisenhüttenprozess, insbesondere als Zuschlag im Siemens-Martin-Ofen und im Elektrohochofen, und zur Herstellung von künstlichem Kryolith für die Aluminiumgewinnung,
- als Säurespat für die Herstellung von Fluor und Fluorwasserstoffsäure sowie verschiedenen Fluoriden bzw. Folgeprodukten wie Fluorkohlenwasserstoffe und polymere Fluorverbindungen (z. B. Polytetrafluorethylen),
- als keramischer Spat in der Glasindustrie als Fluss- und Trübungsmittel für z. B. Milchglas, Mattglas und opaleszierende Gläser, für keramische Werkstoffe und als Grundstoff für optische Linsen (CaF2-Einkristalle, Fluoridgläser auf Basis von Berylliumfluorid, Fluorit, und Natriumfluorid). Durch die Eigenschaft, das Lichtspektrum gleichmäßig zu brechen, lässt sich die chromatische Aberration von Objektiven ausgleichen. Problematisch ist hier, dass für Hochleistungsobjektive besonders große Kristalle benötigt werden, diese werden künstlich gezüchtet. Kristalle dieser Größe haben die Eigenschaft, sich durch Hitze (durch Sonneneinstrahlung) bereits derart zu verziehen, dass sie die Rechnung der Optik signifikant verändern.
Als Schmuckstein


Aufgrund seiner eher geringen Härte und vollkommenen Spaltbarkeit ist Fluorit als Schmuckstein für die gewerbliche Schmuckindustrie eher uninteressant. Gelegentlich wird er von Glyptikern und Hobbyschleifern zu kleinen, kunstgewerblichen Gegenständen oder facettierten Schmucksteinen verarbeitet.[20]
Da er aber durch seine Farbenvielfalt mit vielen Edelstein-Mineralen verwechselt werden kann, dient er oft als Grundlage für Imitationen. Um die Farben zu verändern, wird Fluorit entweder gebrannt oder bestrahlt. Zum Schutz vor Beschädigung oder um Schäden durch Spaltrisse zu überdecken, werden Schmucksteine aus Fluorit oft mit Kunstharz stabilisiert[21] (siehe auch Schmuckstein).
Siehe auch
Literatur
Monographien:
- Gerhard Niedermayr: Mineral des Regenbogens: Fluorit. Doris Bode Verlag, Haltern 1990, ISBN 3-925094-44-X.
- H.G. Dill, B. Weber: Die Oberpfälzer Flussspat-Anthologie – „Bunte Steine“ prägen die Region und ihre Menschen um den Wölsenberg. Druckkultur Späthling, Weißenstadt, 2011, ISBN 978-3-942668-01-9.
In Kompendien:
- Walter Ehrenreich Tröger u. a. (Hrsg.): Optische Bestimmung gesteinsbildender Minerale, Schweizerbart, Stuttgart
- 1. – Bestimmungstabellen, 1982, ISBN 3-510-65106-5
- Martin Okrusch, Siegfried Matthes: Mineralogie. 7. Auflage. Springer Verlag, Berlin 2005, ISBN 3-540-23812-3
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel Verlag GmbH, Eggolsheim 2002, ISBN 3-89555-076-0, S. 73.
- Walter Schumann: Edelsteine und Schmucksteine. 13. Auflage. BLV Verlags GmbH, 1976/1989, ISBN 3-405-16332-3
Wissenschaftliche Fachartikel:
- H. Bill, G. Calas: Color centers, associated rare-earth ions and the origin of coloration in natural fluorites. In: Physics and chemistry of minerals. Nr. 3, 1978, S. 117–131, doi:10.1007/BF00308116.
- G. Bayer, H.G. Wiedemann: Fluorrohstoffe – Vorkommen, Verwendung und Probleme, Chemie in unserer Zeit, 19. Jahrg. 1985, Nr. 2, S. 35–41, doi:10.1002/ciuz.19850190202
- U. Kempe, M. Plötze, A. Brachmann and R. Böttcher: Stabilisation of divalent rare earth elements in natural fluorite. In: Mineralogy and Petrology. Nr. 76, 2002, S. 213–234, doi:10.1007/s007100200042.
- U. Kempe: On Violet Coloration of Natural Fluorite. RMS DPI, 2006, S. 162–164 (Online [PDF; 139 kB]).
- H. G. Dill, B. Weber: Variation of color, structure and morphology of fluorite and the origin of the hydrothermal F-Ba deposits at Nabburg-Wölsendorf, SE Germany. Neues Jahrbuch für Mineralogie – Abhandlungen, 2010, S. 113–132 (Zusammenfassung [PDF; 45 kB]).
Weblinks
- Mineralienatlas:Fluorit (technische Informationen), Mineralienatlas:Mineralienportrait/Fluorit (umfassendes Porträt)
- Virtueller Rundgang Flußspatgang Reichhartschacht
- MinDat – Fluorite (englisch)
- Webmineral (englisch)
Einzelnachweise
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 153.
- G. G. Stokes: On the Change of Refrangibility of Light. In: Philosophical Transaction Royal Society London. Band 142, 1852, S. 463–562 (online verfügbar bei archive.org – Internet Archive [abgerufen am 31. Juli 2017]).
- Helmut Schröcke, Karl-Ludwig Weiner: Mineralogie. Ein Lehrbuch auf systematischer Grundlage. de Gruyter, Berlin; New York 1981, ISBN 3-11-006823-0, S. 322–327.
- Mineralienatlas: Grube Cäcilia. Abgerufen am 31. Juli 2017.
- Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4. durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie (VEB), Leipzig 1987, ISBN 3-342-00288-3, S. 355–356.
- Hans Pichler, Cornelia Schmitt-Riegraf: Gesteinsbildende Minerale im Dünnschliff. 2. Auflage. Enke, Stuttgart 1993, ISBN 3-8274-1260-9, S. 50.
- U. Kempe: On Violet Coloration of Natural Fluorite. RMS DPI, 2006, S. 162–164 (PDF 139 kB (Memento vom 7. September 2016 im Internet Archive)).
- U. Kempe, M. Plötze, A. Brachmann, R. Böttcher: Stabilisation of divalent rare earth elements in natural fluorite. In: Mineralogy and Petrology. Band 76, 2002, S. 213–234, doi:10.1007/s007100200042.
- H. Bill, G. Calas: Color centers, associated rare-earth ions and the origin of coloration in natural fluorites. Physics and chemistry of minerals Vol. 3, 1978, S. 117–131, doi:10.1007/BF00308116.
- Jörn Schmedt auf der Günne, Martin Mangstl, Florian Kraus: Elementares Fluor F2 in der Natur – In-Situ-Nachweis und Quantifizierung durch NMR-Spektroskopie. In: Angewandte Chemie. Band 124, 2012, S. 7968–7971, doi:10.1002/ange.201203515.
- Marten Huisinga: Ultraviolet photoelectron spectroscopy and electron stimulated desorption from CaF2. 1999, abgerufen am 31. Juli 2017.
- Thorolf Vogt: Vorläufige Mitteilung über Yttrofluorit, eine neue Mineralspezies aus dem nördlichen Norwegen. In: Chemisches Centralblatt. Band 2, Nr. 5, 2. August 1911, S. 299–300 (Online [PDF; 11,2 MB; abgerufen am 31. Juli 2017]).
- Thorolf Vogt: Über die Flussspat-Yttrofluoritgruppe. In: M. Bauer, Fr. Frech, Th. Liebisch (Hrsg.): Neues Jahrbuch für Mineralogie, Geologie und Paläontologie. Band 2. Schweizbart, Stuttgart 1914, S. 9–15 (online verfügbar bei archive.org – Internet Archive [abgerufen am 31. Juli 2017]).
- IMA/CNMNC List of Mineral Names 2009. (PDF; 1,9 MB) Abgerufen am 31. Juli 2017 (S. 49 u. 310).
- Johan Gottlieb Gahn, Jöns Jakob Berzelius: Afhandlingar I Fysik. In: Kemi och Mineralogi. Band 4. Stockholm 1815, S. 161 (Online [PDF; 3,7 MB; abgerufen am 31. Juli 2017]).
- Walter L Pohl: Mineralische und Energie-Rohstoffe. 5. Auflage. Schweizerbart, Stuttgart 2005, ISBN 978-3-510-65212-9, S. 252–256.
- Sächsische Zeitung: Neues Bergwerk im Erzgebirge. 10. September 2009, abgerufen am 31. Juli 2017.
- Sächsische Zeitung: Im Erzgebirge beginnt wieder Erzbergbau. 27. Oktober 2010, abgerufen am 31. Juli 2017.
- H. Ziehr, K: Matzke, E. Sawary: Flußspat im Zechsteindolomit bei Eschwege, Hessen. In: Vereinigung der Freunde der Mineralogie und Geologie (Hrsg.): Der Aufschluss. Sonderband 28. Heidelberg 1978, S. 248–259.
- realgems.org – Fluorit (mit Bildern verschiedener Schmucksteinschliffe bei Fluorit). Abgerufen am 31. Juli 2017.
- Bernhard Bruder: Geschönte Steine. Das Erkennen von Imitationen und Manipulationen bei Edelsteinen und Mineralien. Neue Erde Verlag, 2005, ISBN 3-89060-079-4, S. 67.