Glykogen
Das Glykogen (auch Glycogen, tierische Stärke oder Leberstärke) ist ein Oligosaccharid oder ein verzweigtes Polysaccharid (Vielfachzucker), das aus Glucose-Monomeren aufgebaut ist. Glykogen dient als in Zellen (vor allem der Leber) gespeichertes Kohlenhydrat der kurz- bis mittelfristigen Speicherung und Bereitstellung des Energieträgers Glucose im tierischen, also auch menschlichen, Organismus. Auch Pilze und einige Bakterien verwenden diese Form der Energiespeicherung, während Pflanzen Stärke als Kohlenhydratspeicher benutzen. Der Vorgang des Aufbaus von Glykogen aus Glucose wird als Glykogensynthese bezeichnet, der umgekehrte Prozess des Glykogenabbaus als Glykogenolyse.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Glykogen | ||||||
| Andere Namen | |||||||
| CAS-Nummer | 9005-79-2 | ||||||
| Monomer | Glucose | ||||||
| Summenformel der Wiederholeinheit | C6H10O5 | ||||||
| Molare Masse der Wiederholeinheit | 162,14 g·mol−1 | ||||||
| Art des Polymers | |||||||
| Kurzbeschreibung | |||||||
| Eigenschaften | |||||||
| Aggregatzustand |
fest[2] | ||||||
| Schmelzpunkt |
270–280 °C (Zersetzung)[4] | ||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Vor allem in Leber- und Muskelzellen wird bei einem Überangebot von Kohlenhydraten Glykogen aufgebaut, bis dessen Massenanteil in der Leber 20 % beträgt.[5] Bei vermehrtem Energiebedarf verwenden die Muskelzellen ihr gespeichertes Glykogen. Auch das in Leber und Nieren[6] gespeicherte Glykogen wird bei Bedarf wieder zu Glucose aufgespalten, wobei hier die Glucose über das Blut dem Gesamtorganismus zur Verfügung gestellt wird.
Struktur des Glykogens
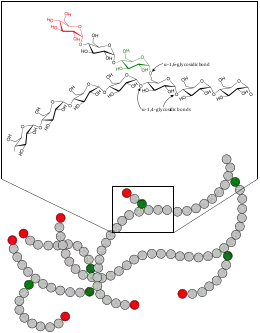
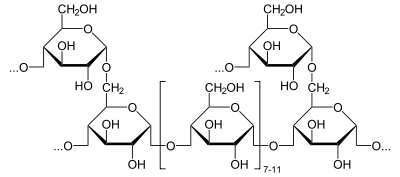
Glykogen besteht aus einem zentralen Protein (Glykogenin), an das bis zu 50.000 Glucosebausteine meist α-1,4-glykosidisch geknüpft sind. Alle 8 bis 12 Glucose-/Monosaccharid-Bausteine erfolgt neben der α-1,4-glykosidischen Bindung eine weitere α-1,6-glykosidische Verknüpfung, wodurch das Molekül baumartig verzweigt wird. So kann bei Bedarf an vielen verschiedenen Stellen innerhalb eines Moleküls Glykogen zu Glucose abgebaut werden. Amylopektin, ein Bestandteil der pflanzlichen Stärke, ist genau so aufgebaut wie Glykogen, hat allerdings einen geringeren Verzweigungsgrad, da nur ca. jedes 25. Glucose-Molekül eine 1,6-glycosidische Verknüpfung besitzt. Die molare Masse des Glykogens beträgt etwa 106 bis 107 Dalton.
Glykogen im menschlichen Stoffwechsel
Mit der Nahrung aufgenommene Stärke wird durch das Enzym alpha-Amylase (genauer Ptyalin) im Mund und im Zwölffingerdarm in die beiden Disaccharide Maltose und Isomaltose gespalten, welche durch weitere Enzyme in Glucose überführt werden.
Die Muskeln nutzen ihren Glykogenvorrat ausschließlich selbst, die Leber und die Nieren dienen als Glykogenspeicher und stellen es hauptsächlich anderen Zellen zur Verfügung. Dies ist vor allem im Schlafzustand als Energieversorgung für Zellen des Nebennierenmarks und Erythrozyten wichtig, da diese Zellen auf Glucose als Energielieferant angewiesen sind.[7]
Der Blutzuckerspiegel wird unter anderem mittels Glykogenauf- und -abbau durch verschiedene Hormone reguliert: Adrenalin und Glucagon regen den Glykogenabbau an, Insulin fördert den Glykogenaufbau. Insulin und Glucagon werden in Teilen der Bauchspeicheldrüse gebildet. Der Glykogengehalt der Leber variiert dabei je nach Ernährungszustand des menschlichen Körpers. Im Hungerzustand beträgt er weniger als 1 % des Lebergewichtes. Bei gutem Ernährungszustand und kohlenhydratreicher Kost kann er auf bis zu 20 % des Lebergewichtes anwachsen.[5] Pro Gramm Gewebe gerechnet ist die Glykogen-Kapazität der Nieren höher als die der Leber.[6][8] Da die Leber aber das deutlich größere Organ ist, ist die absolute Kapazität der Leber höher.
Glykogen-Synthese
Für die Synthese eines Glykogenmoleküls wird jeweils ein so genanntes Core-Protein benötigt. Dieses Glykogenin genannte Molekül bildet das Zentrum eines jeden Glykogen-Moleküls. Es besitzt selbst einige Moleküle α-1,4-glykosidisch gebundener Glucose, die von der Glykogen-Synthase als Primer benötigt werden – dieses Enzym gleitet wie der Schieber eines Reißverschlusses auf der bestehenden Kette von Glucose-Molekülen entlang und kann nicht selbst einen Startpunkt festlegen.
Glucose kommt in Körperzellen kaum in seiner freien Form vor, sondern ist an seinem 6-C-Atom phosphoryliert, damit es nicht durch die Zellmembran hinausdiffundieren und auch leichter verstoffwechselt werden kann. Damit das Glucose-6-phosphat an bestehendes Glycogen angebaut werden kann, muss es zunächst durch das Enzym Phosphoglucomutase in Glucose-1-phosphat isomerisiert und nachfolgend durch Uridintriphosphat aktiviert werden – es entsteht UDP-Glucose und freies Pyrophosphat, das zum Antrieb der Synthese schnell weiter in 2 anorganische (i = inorganic) Phosphatmoleküle zerlegt wird. Diese Aktivierung wird vom Enzym UDP-Glucose-Pyrophosphorylase katalysiert und folgt folgender Gleichung:
- Glucose-1-phosphat + UTP → UDP-Glucose + PPi
- PPi + H2O → 2 Pi
Die aktivierte Glucose wird dann durch die Glycogen-Synthase an den Primer bzw. die bestehende Glykogenkette am nicht-reduzierenden Ende angefügt:
- Glykogen (n Glucose) + UDP-Glucose → Glykogen (n+1 Glucose) + UDP
Während die Glykogen-Synthase eine lange Kette erzeugt, ist ein anderes Enzym für die Verzweigung zuständig: Das 1,4-α-Glucan-verzweigende Enzym (branching enzyme), zerschneidet die Kette alle 7 bis 12 Glucose-Moleküle und fügt das abgeschnittene Stück „seitlich“ (alpha-1,6-glykosidisch) an eine mindestens 11 Moleküle lange Kette wieder an.[9]
Glykogen-Abbau
Der lineare Anteil des Glykogens wird von dem Enzym Glycogenphosphorylase abgebaut. Dieses ist Pyridoxalphosphat-abhängig. Es katalysiert die Bindung freien Phosphats am C1-Atom der Glucose. Dabei wird die glykosidische Bindung zwischen den Glucose-Molekülen aufgespalten und es entsteht Glucose-1-phosphat. Dieses kann von einer Mutase in Glucose-6-phosphat überführt werden. Glucose-6-phosphat ist die normale Form der Glucose in einer Zelle. Entstünde freie Glucose, müsste die Hexokinase IV, ein Enzym, das auch in der Glykolyse eine Rolle spielt, unter Verwendung einer Phosphorylgruppe aus ATP Glucose-6-phosphat herstellen. Außerdem verursacht eine erhöhte Konzentration von Glucose in der Zelle eine Abnahme des Konzentrationsgradienten zwischen Zytosol und Extrazellularraum, sodass der Glucosetransport in die Zelle vermindert wird.
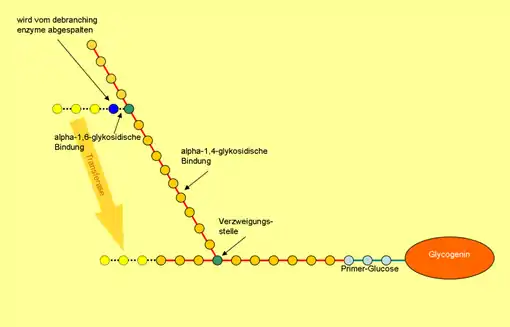
Die Glykogen-Phosphorylase kann Glykogen nur bis zum vierten Glucose-Molekül vor einer Verzweigungsstelle abbauen. An dieser Stelle kommt die 4-α-Glucanotransferase (eine enzymatische Aktivität des debranching enzyme) ins Spiel: Dieses Enzym überträgt drei der vier Glucose-Moleküle vor der Verzweigungsstelle auf eine andere Kette und fügt sie linear an. Das verbleibende alpha-1,6-glykosidisch gebundene Glucose-Molekül wird nun von der anderen enzymatischen Aktivität des Debranching enzyme abgespalten, wobei freie Glucose entsteht. Beim Glykogen-Abbau entsteht somit zu etwa 90 % Glucose-1-phosphat, da im Schnitt nur jedes zehnte Glucose-Molekül an einer Verzweigungsstelle sitzt.[10]
Mengenmäßig besitzt die Muskulatur die größte Glykogenmenge. Aber ihr fehlt das Enzym Glucose-6-phosphatase, welches den Phosphatrest am C-Atom 6 der Glucose abspalten kann. Dieses kommt nur in Leberzellen, Nierenzellen und Enterozyten vor. Somit können Leber und Nieren ihren Glykogen-Speicher effektiv dazu benutzen, einen geringen Blutzuckerspiegel (z. B. nachts) abzupuffern.
Hormonelle Regulation des Auf- und Abbaus von Glykogen
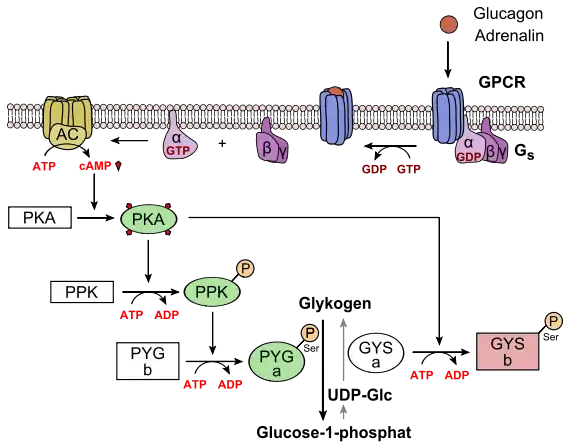
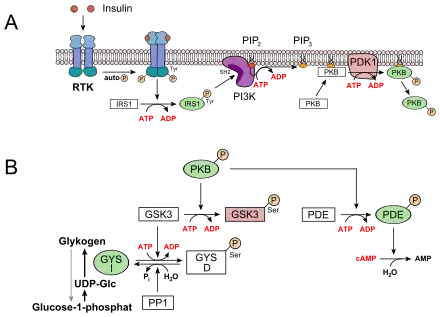
Sowohl von der Glykogenphosphorylase als auch von der Glykogensynthase gibt es zwei Formen: eine a- und eine b-Form. Die beiden Formen sind durch Phosphorylierung mittels einer Kinase bzw. Dephosphorylierung mittels einer Phosphatase ineinander umwandelbar. Da die a-Form jeweils wesentlich höhere Aktivität besitzt als die b-Form, kann auf diese Weise die Geschwindigkeit der jeweiligen Reaktion den Erfordernissen des Stoffwechsels angepasst werden.
Im Fall der Glykogenphosphorylase ist die phosphorylierte die a-Form. Sie wird durch eine hormonell gesteuerte Phosphorylase-Kinase phosphoryliert und eine ebenfalls hormonell gesteuerte Protein-Phosphatase dephosphoryliert. Während die b-Form durch allosterische Kontrolle vor allem durch Adenosinmonophosphat (AMP) den lokalen Bedürfnissen in der Leberzelle angepasst wird, ist die a-Form immer aktiv und liefert in kurzer Zeit große Mengen an Glucose für periphere Gewebe. Die Überführung der inaktiven in die aktive Form durch Phosphorylierung ist hormongesteuert. Die Aktivierung der Glykogenphosphorylase durch die Kinase ist eine typische Stress-Reaktion. Die Protein-Phosphatase wird hingegen bei einem Überangebot an Glucose aktiviert, um eine zusätzliche Freisetzung zu verhindern. Der wichtigste Aktivierungsmechanismus der Glykogenphosphorylase erfolgt über eine Phosphorylierungskaskade, die vom second messenger zyklisches Adenosinmonophosphat (cAMP) in Gang gesetzt wird. Bindet ein Hormon, das eine Erhöhung des Blutzuckers bewirkt, wie z. B. Glucagon oder Adrenalin, an die entsprechenden Rezeptoren in der Membran der Hepatozyten, so erfolgt über die Aktivierung eines trimeren G-Proteins die Stimulierung des Enzyms Adenylylcyclase. Diese bildet das cAMP aus ATP. cAMP aktiviert allosterisch eine spezifische Proteinkinase, die Proteinkinase A, diese phosphoryliert die schon genannte Phosphorylase-Kinase, die dann in weiterer Folge die Glycogenphosphorylase phosphoryliert und damit von der b- in die a-Form umwandelt.
Die Folge dieser Kaskadenaktivierung ist eine enorme Verstärkung des ursprünglichen Hormonsignals (des nanomolar vorliegenden first messengers) zu einer metabolischen Reaktion im Millimolbereich. Durch eine Phosphodiesterase wird cAMP wieder abgebaut, so dass das Signal zeitlich begrenzt bleibt.
Die Vorgänge im Muskel sind analog, allerdings wirkt das typische Hungerhormon Glucagon dort nicht. Insulin hingegen aktiviert die Protein-Phosphatase (PP1) und die Phosphodiesterase (PDE) und wirkt dadurch antagonistisch zu den Stress- und Hungersignalen. Die Glykogensynthese wird gegensinnig reguliert, d. h., sie wird durch Phosphorylierung inaktiviert und durch Dephosphorylierung aktiviert, wobei jedenfalls zum Teil die gleichen Kinasen und Phosphatasen an dieser Regulation beteiligt sind. Die a-Form ist demnach die dephosphorylierte, die b-Form die phosphorylierte. Letztere ist nur in Gegenwart hoher Konzentrationen an Glucose-6-phosphat aktiv, wie etwa bei einem starken Überangebot an Nahrungsglucose in der Leber. Entsprechend ist auch die hormonelle Regulation zu verstehen, d. h., Insulin stimuliert, Adrenalin und Glucagon hemmen die Glykogen-Synthase.
Siehe auch
Literatur
- Berg, Tymoczko, Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6
- M. M. Adeva-Andany, M. González-Lucán, C. Donapetry-García, C. Fernández-Fernández, E. Ameneiros-Rodríguez: Glycogen metabolism in humans. In: BBA clinical. Band 5, Juni 2016, S. 85–100, doi:10.1016/j.bbacli.2016.02.001, PMID 27051594, PMC 4802397 (freier Volltext).
Weblinks
- Biochemie Uni-München: Enzymatischer Abbau und Aufbau des Glykogens (Memento vom 16. Juni 2010 im Internet Archive)
- Glycogen Metabolism – gut verständliche Seite zum Thema Glykogenmetabolismus (engl.)
Einzelnachweise
- Eintrag zu GLYCOGEN in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt Glycogen, from oysters, Ultrapure, Thermo Scientific bei AlfaAesar, abgerufen am 8. Februar 2019 (PDF) (JavaScript erforderlich).
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 296 (eingeschränkte Vorschau in der Google-Buchsuche).
- W. L. F. Armarego, Christina Chai, Christina Li Lin Chai: Purification of Laboratory Chemicals. Butterworth-Heinemann, 2003, ISBN 978-0-7506-7571-0, S. 604 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eckehard Buddecke: Grundriss der Biochemie, Walter de Gruyter Verlag, 6. Auflage, 1980, S. 166, ISBN 3-11-008388-4.
- A. Mitrakou: Kidney: its impact on glucose homeostasis and hormonal regulation. In: Diabetes research and clinical practice. Band 93 Suppl 1, August 2011, S. S66–S72, doi:10.1016/S0168-8227(11)70016-X. PMID 21864754. (Review).
- Emil Lehnartz: Der Chemismus der Muskelmaschine. Physiologische Forschung als Voraussetzung zur Bestgestaltung der menschlichen Arbeit. Ernährung und Leistungsfähigkeit. Springer-Verlag, 2013, ISBN 978-3-322-98646-7, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. A. Krebs: Renal gluconeogenisis. In: Advances in enzyme regulation. Band 1, 1963, S. 385–400, PMID 14190368.
- reactome: Glycogen synthesis
- reactome: Glycogen breakdown (glycogenolysis)