Calciumperoxid
Calciumperoxid ist eine anorganische chemische Verbindung aus der Gruppe der Peroxide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
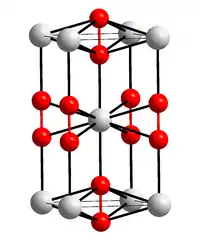 | |||||||||||||||||||
| _ Ca2+ _–_ [O–O]2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumperoxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | CaO2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff oder als Octahydrat perlmuttartige Schuppen[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 72,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,92 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (< 0,01 % bei 20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Calciumperoxid kann durch Reaktion eines löslichen Calciumsalzes (z. B. Calciumchlorid oder Calciumnitrat) mit Wasserstoffperoxid in alkalischer Lösung (z. B. Natriumhydroxid oder Ammoniak) gewonnen werden.[4] Technisches Calciumperoxid enthält zu großen Teilen auch Calciumcarbonat und Calciumhydroxid und wird durch Reaktion von Calciumoxid bzw. Calciumhydroxid und Wasserstoffperoxid gewonnen.[5]
Eigenschaften
Calciumperoxid ist ein starkes Oxidationsmittel und von mittlerer brandfördernder Wirkung, da es bei Erhitzung Sauerstoff abspaltet. Es liegt häufig als Octahydrat vor, das bei etwa 130 °C das Kristallwasser verliert. Das Octahydrat hat eine tetragonale Kristallstruktur mit a = 619,7 pm, c = 1096,7 pm und der Raumgruppe P4/mcc (Raumgruppen-Nr. 124).[6] Die Löslichkeit in Wasser bei 20 °C und neutralem pH-Wert ist kleiner 0,01 %. Die Reaktion mit Wasser ist eine Hydrolyse, die zwischen 6 und 8 Wochen dauert und molekularen Sauerstoff[3] freisetzt:
In Säure löst sich Calciumperoxid unter Freisetzung von Wasserstoffperoxid. Calciumperoxid bildet mit Orthophosphat unlöslichen Apatit und kann daher den Phosphatgehalt in Wasser senken.[7]
Verwendung
Calciumperoxid wird als Trocknungsbeschleuniger für Polysulfidelastomere, Antiseptikum in Zahnpasten und Kaugummi, als Stabilisator in der Gummiindustrie, in der Zahnheilkunde (zur Desinfektion des Wurzelkanals und Heilung der periapikalen Entzündungen[8]), als Teigverbesserer in der Backindustrie und als Saatgutdesinfektionsmittel verwendet. Aufgrund seiner phosphorbindenden Eigenschaften wird Calciumperoxid in Gewässern als Phosphatbindemittel verwendet. Wegen der langsamen Freisetzung von Sauerstoff können organische Bestandteile von Sedimenten in Gewässern dabei in situ abgebaut werden (Seenrestauration).
Weblinks
- E. Vernon Ballou, Peter C. Wood, LeRoy A. Spitze, Theodore Wydeven: The Preparation of Calcium Superoxide from Calcium Peroxide Diperoxyhydrate. In: Ind. Eng. Chem. Prod. Res. Dev., 1977, 16 (2), S. 180–186 (doi:10.1021/i360062a015).
Einzelnachweise
- Eintrag zu CALCIUM PEROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu Calciumperoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2020. (JavaScript erforderlich)
- Yong Ma, Bo-Tao Zhang u. a.: Study on the generation mechanism of reactive oxygen species on calcium peroxide by chemiluminescence and UV-visible spectra. In: Luminescence. 22, 2007, S. 575, doi:10.1002/bio.1003.
- Eintrag zu Calciumperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- Datenblatt Calciumperoxid (PDF; 159 kB) bei Solvay, abgerufen am 1. Februar 2018.
- G. V. Shilov, A. I. Karelin, D. G. Lemesheva, L. S. Leonova, L. O. Atovmyan: Crystal Structure and Properties of CaO2 · 8H2O, Russian Journal of Inorganic Chemistry, Vol. 50, No. 6, June 2005, S. 842–847.
- Patent: EP 1080042
- Malyk Yuriy: In-Vitro Untersuchungen zum Einsatz von Calciumperoxid haltigen Sealermaterialien in der endodontischen Therapie. urn:nbn:de:bvb:19-43959

