Calciumnitrat
Calciumnitrat ist das Calciumsalz der Salpetersäure und hat die Summenformel Ca(NO3)2. „Kalk- oder Norgesalpeter“ wird als Düngemittel verwendet. Die Bezeichnung „Norgesalpeter“ stammt von den Norwegern Kristian Birkeland und Sam Eyde, die ein Verfahren zur Salpeterherstellung entwickelten.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
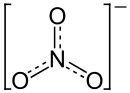 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumnitrat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farblose, zerfließende, monokline Prismen (Tetrahydrat)[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (1470 g·l−1 bei 0 °C, 2710 g·l−1 bei 40 °C als Tetrahydrat)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Calciumnitrat entsteht, wenn Ammoniumnitrat aus Tierdung oder -urin mithilfe von kapillar transportierter Feuchtigkeit Mauern durchdringt und mit dem Kalk aus dem Zement-Mörtel oder dem früher häufiger verwendeten Kalkmörtel reagiert. So entsteht das sogenannte Mauersalz oder Mauersalpeter, welche die Wände (zum Beispiel von Viehställen, Kellern und Aborten) langsam zerstören. In der Geschichte gab es Salpeterer, die herumwanderten und dieses ausblühende Salz von den Mauern kratzten, säuberten und verkauften. Auf Grund seines hohen Wasseranziehungsvermögens ist es nicht direkt verwendbar, sondern muss mithilfe von Pottasche zu Kaliumnitrat konvertiert werden. Aus diesem Produkt wurde dann seit dem Mittelalter Schwarzpulver[5] hergestellt.
Wegen fluoreszierender Eigenschaften war es im 17. Jahrhundert nach dem Entdecker Christian Adolf Balduin auch als Balduins Phosphor bekannt.
Das Tetrahydrat von Calciumnitrat kommt natürlich in Form des Minerals Nitrocalcit vor.
Mauersalze anderer Zusammensetzung entstehen auch, wenn freie Schwefelsäure aus dem Kondensat von Heizgasen auf den Zement und die carbonathaltigen Zuschlagstoffe in Mörtel, Kaminsteinen und -putz einwirken. Dabei wird unter anderem der im Zement enthaltene Kalk zu Gips und Ettringit umgewandelt. Die Reaktionsprodukte „treiben“, das heißt, sie quellen auf, und zersprengen die Baumasse. Derart vernässtes Mauergefüge kann im Winter zusätzlich durch Frostsprengungen beeinträchtigt werden.
Gewinnung und Darstellung
Calciumnitrat lässt sich aus Calciumcarbonat bzw. Calciumoxid und Salpetersäure darstellen:
Die Reaktion von Calcium mit Salpetersäure ist ebenso möglich:
Calciumnitrat bildet zudem auf Mauern eine Art weißen Schleiers, der die Konsistenz von Watte hat. Man kann es mit einem Besen abfegen oder mit einem Spachtel abtragen. Das Salz wird in Wasser gelöst, die Verunreinigungen sinken dann auf den Boden. Die Salzlösung wird abgegossen, vorsichtig eingedampft und getrocknet. Es ist jedoch meist mit anderen Salzen verunreinigt.
Siehe: Salpetersieder
Eigenschaften
Calciumnitrat ist ein weißer, hygroskopischer, oxidierender Feststoff, der sehr leicht löslich in Wasser ist. Es bildet eine Reihe von Hydraten, so ein Di-, Tri- und Tetrahydrat.[6] Die Verbindung zersetzt sich bei Erhitzung, wobei Sauerstoff und Stickstoffoxide entstehen. So beginnt die Kristallwasserabspaltung des Tetrahydrats bei Temperaturen über 100 °C, oberhalb von 130 °C erfolgt Sauerstoffabspaltung und ab 225 °C beginnende Zersetzung zu Calciumoxid.[2] Als Tetrahydrat bildet es farblose, zerfließende, monokline Prismen.[1]
Das Tetrahydrat hat eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und ist dimer.[7] Das Anhydrat besitzt eine kubische Kristallstruktur mit der Raumgruppe Pa3 (Raumgruppen-Nr. 205).[8]
Verwendung
Calciumnitrat wird neben seinem Einsatz als Düngemittel auch als Bestandteil von Kühlsolen und von Koagulierungsbädern von Latex empfohlen. Außerdem findet es Verwendung als Ausgangsmaterial zur Herstellung anderer Calciumverbindungen oder Calcium-haltiger Materialien, z. B. Calciumphosphat, Calciumsilicat-Nanokristalle, Hydroxylapatit-Fasern sowie elektrisch leitfähigen Keramikmaterialien. Es findet auch Verwendung bei der Herstellung von pyrotechnischen Artikeln (Sprengschlämme[9]), Knochenimplantaten und in der Elektronikindustrie für Radioröhren.[1] Eine weitere Anwendung ist die Zugabe in Abwasserkanälen, um die H2S-Bildung zu unterbinden.[10] Im Bauwesen wird Calciumnitrat als Hauptinhaltstoff von Erstarrungsbeschleunigern für Beton eingesetzt.[11]
Einzelnachweise
- Eintrag zu Calciumnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Calciumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Datenblatt Calcium nitrate tetrahydrate bei Sigma-Aldrich, abgerufen am 1. Februar 2017 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-55.
- Wilhelm Hassenstein: Das Feuerwerksbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdrucks aus dem Jahr 1529 (erschienen im gleichen Jahr bei Egenolph in Straßburg unter dem Titel Büchsenmeysterei) mit Übertragung ins Hochdeutsche und Erläuterungen, München 1941, S. 49 und 53.
- C. Doelter: Die Elemente und Verbindungen von: Ti, Zr, Sn, Th, Nb, Ta, N, P, As, Sb, Bi, V und H Band III. Erste Abteilung. Springer-Verlag, 2013, ISBN 978-3-642-49781-0, S. 290 (eingeschränkte Vorschau in der Google-Buchsuche).
- B. Ribár, V. Divjaković: A new crystal structure study of Ca(NO3)2·4 H2O. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. Band 29, Nr. 7, 15. Juli 1973, ISSN 0567-7408, S. 1546–1548, doi:10.1107/S0567740873004929.
- Angel Vegas: Inorganic 3D Structures. Springer, 2011, ISBN 978-3-642-20341-1, S. 48 (eingeschränkte Vorschau in der Google-Buchsuche).
- Josef Köhler, Rudolf Meyer, Axel Homburg: Explosivstoffe. Zehnte, vollständig überarbeitete Auflage. John Wiley & Sons, 2012, ISBN 3-527-66007-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- https://www.schwefelwasserstoff.de/Ca(NO3)2.html
- Sika: Sicherheitsdatenblatt Sika Rapid C-100. (PDF) Abgerufen am 6. November 2017.


