Kalkseife
Kalkseifen oder Calciumseifen sind in Wasser schwer lösliche Calcium- oder Magnesium-Salze, in der Regel von Fettsäuren.
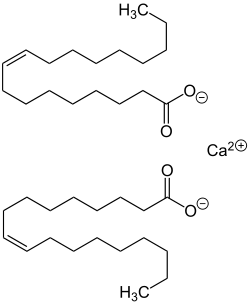
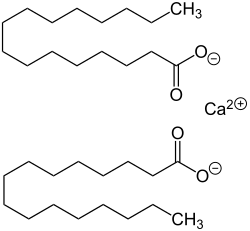
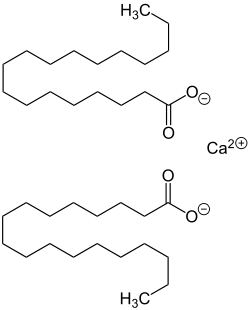
| Kalkseifen einzelner Fettsäuren, z. B. Calciumsalze |
 |
 |
 |
Sie bilden sich bei der Verwendung von Seifen in hartem Wasser. Durch die Bildung dieser Kalkseifen wird die Waschwirkung vermindert, da sich die aktive Seifenmenge verringert. Die Kalkseifen setzen sich auf Oberflächen ab (Vergrauung) und bilden auch in Abwasserrohren schwer entfernbare graue Ablagerungen. Der Bildung von Kalkseifen kann mit Enthärtern, die die Calcium- und Magnesium-Ionen binden, entgegengewirkt werden.[1]
Die heute überwiegend im Haushalt benutzten Reinigungsmittel enthalten keine oder wenig Seife, sondern andere waschaktive Substanzen (Tenside). Diese bilden wenig bis keine Kalkseifen, führen so nicht zu Vergrauung und behalten in hartem Wasser auch ohne Enthärter ihre Waschwirkung. Dafür entfetten sie die Haut sehr viel stärker, wodurch sie schnell austrocknet, und machen sie durchlässig für beispielsweise vorhandene Konservierungsmittel, Farb- und Duftstoffe.
Kalkseifen können als unerwünschte Verunreinigung in Ölen auftreten, die für Anwendungen in der Kosmetik und der Nahrungsmittelindustrie vorgesehen sind. Sie werden dort qualitativ analytisch beispielsweise mit Phenolphthalein-Lösung nachgewiesen, die sich rot färbt, wenn Kalkseifen vorhanden sind.
Herstellung
Die Verseifung natürlicher Fette und Öle mit Calciumhydroxid liefert Gemische von Calciumsalzen der Fettsäuren und Glycerin. Die Anteile der einzelnen Fettsäure-Anionen im Gemisch der Calciumsalze hängt dabei von der Natur und Provenienz des als Rohstoff verwendeten Triglycerides ab. Eine chemisch weitgehend einheitliche Kalkseife kann man durch Umsetzung einer reinen Fettsäure mit einer stöchiometrischen Menge Calciumhydroxid erhalten. Beispiele für solche Kalkseifen sind:
- Calciumoleat, das Calciumsalz der Ölsäure.
- Calciumpalmitat, das Calciumsalz der Palmitinsäure (Hexadecansäure).
- Calciumstearat, das Calciumsalz der Stearinsäure (Octadecansäure), ein farbloses, fettiges Pulver, das in der Hitze in chlorierten und aromatischen Kohlenwasserstoffen löslich ist.[2]
Verwendung

Verwendung finden Kalkseifen als Verdickungsmittel in Mineralöl-basierten Schmierfetten und Gleitmitteln, zur Herstellung von Bleistiften, Zement, wasserfesten Textilien, Tabletten, Kunststoffen, zum Ziehen von Eisen- und Stahldraht und als Mattierungsmittel.[2]
Beim Anmischen von Kalkfarbe und der Behandlung von Kalkputzen (Tadelakt) und Beton[3] mit Pflanzenölen bilden sich Kalkseifen, welche einerseits die Wasserdichtigkeit erhöhen, andererseits die Festigkeit verringern, da das gebundene Calcium nicht mehr zur Carbonatisierung zur Verfügung steht.
Calciumoleat dient als Sikkativ für Lacke, Calciumstearat zur Herstellung von Grundier- und Mattierungsmitteln sowie als Stabilisator und Gleitmittel in der Kunststoffindustrie sowie als Feuerlöschpulver.[4] Zur Herstellung von Puder und Creme in der kosmetischen und pharmazeutischen Industrie benutzt man Calciumstearat. Der Stearinsäure-Anteil der Fettsäuren im Calciumstearat muss laut Europäischem Arzneibuch zur Verwendung in der Pharmazie mindestens 40,0 %, die Summe der Stearin- und Palmitinsäure-Anteile in der Fettsäurefraktion muss mindestens 90,0 % betragen.[5]
Die wasserabweisende (Hydrophobie) Eigenschaft der Kalkseife wird zum Beispiel bei Tadelakt, einer marokkanischen Verputztechnik, oder bei Opus signinum, einer altrömischen Verputztechnik, genutzt. Die Bildung kleinerer Mengen an Kalkseifen dient in modernen Waschmitteln dazu, eine übermäßige Schaum-Entwicklung zu vermeiden. In der EU sind sie als Lebensmittelzusatzstoffe der Nummern E 470a (die Calcium-Salze von Speisefettsäuren, neben den darunter ebenfalls erfassten Natrium- und Kalium-Salzen) und E 470b (Magnesiumsalz von Speisefettsäuren) ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen. Sie werden in der Lebensmitteltechnik als Emulgatoren, Stabilisatoren, Trennmittel, Überzugsmittel oder auch als Trägersubstanzen für andere Zusatzstoffe und Aromen verwendet und finden sich unter anderem in Back- und Süßwaren. Die Rohstoffe können aus gentechnisch veränderten Pflanzen gewonnen werden, was üblicherweise beim Endprodukt nicht deklariert wird.[6]
Kalkseifen werden auch zur Herstellung von Kosmetikprodukten verwendet, Calciumstearat und andere Kalkseifen auch als wasserabweisendes Schmiermittel Staufferfett.
Siehe auch
Literatur
- Siegfried Hauptmann: Organische Chemie. Neuauflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 2001, ISBN 3-342-00635-8 (Nachdruck der Ausgabe Leipzig 1991).
- Hans-Georg Henning, Werner Jugelt, Günther Sauer: Praktische Chemie. Ein Studienbuch für Mediziner und Naturwissenschaftler. 5. Auflage. Verlag Deutsch, Thun 1991, ISBN 3-8171-1139-8 (Nachdruck der Ausgabe Berlin 1982).
- Hugo Janistyn: Taschenbuch der modernen Parfümerie und Kosmetik. 4. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1974, ISBN 3-8047-0473-5.
- Hermann Pardun: Analyse der Nahrungsfette (Grundlagen und Fortschritte der Lebensmitteluntersuchung und Lebensmitteltechnologie; 16). Parey, Berlin 1976, ISBN 3-489-78814-1 (völlige Neubearbeitung von Werner Wachs: „Öle und Fette – Analyse der Nahrungsfette“).
Einzelnachweise
- Hauptmann: 1985, Seite 740.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 575.
- H. Weigler und E. Segmüller: Betontechnische Berichte 67 – Schutz von Beton gegen chemische Angriffe – Gekürzte Bearbeitung eines des "ACI Committee 515".
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 870.
- Europäisches Arzneibuch, Deutscher Apotheker Verlag Stuttgart, 6. Ausgabe, 2008, S. 1947–1949, ISBN 978-3-7692-3962-1.
- transGEN: Fettsäuren E 570 (Memento vom 12. Februar 2012 im Internet Archive).