Calciumcarbonat
Calciumcarbonat (fachsprachlich), Kalziumkarbonat oder in deutscher Trivialbezeichnung kohlensaurer Kalk, ist eine chemische Verbindung der Elemente Calcium, Kohlenstoff und Sauerstoff mit der chemischen Formel CaCO3. Als ein Calcium-Salz der Kohlensäure gehört es zur Stoffgruppe der Carbonate. Es ist ein farbloser, kristalliner Feststoff, dessen Kristallstruktur aus den Ionen Ca2+ und CO32− im Verhältnis 1:1 besteht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
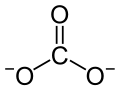 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumcarbonat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | CaCO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner und geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 100,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (14 mg·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub)[4] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen

Calciumcarbonat ist eine der am weitesten verbreiteten Verbindungen auf der Erde, vor allem in Form von Sedimentgesteinen. Es tritt vor allem in der Form des Minerals Calcit (Kalkspat, Doppelspat) auf, das zu den häufigsten Mineralen der Erdkruste gehört. Es ist nicht nur in den massiven Kalkgesteinen das vorherrschende Mineral, in Verbindung mit Quarz, Baryt und Fluorit bildet es auch das Muttergestein sehr vieler Erzgänge. Es kann sogar der einzige Bestandteil von Gängen sein, deren Mächtigkeit von einigen Zentimetern bis zu einigen zehn Metern reicht. Weitere Modifikationen von Calciumcarbonat sind die Minerale Aragonit und Vaterit. Der Name Aragonit leitet sich vom bedeutendsten Vorkommen des Minerals in Aragonien ab. Es kommt vermehrt im Umfeld von marinen Gewässern vor. Die Ursache hierfür ist das im Meerwasser enthaltene Magnesium, das die Bildung von Aragonit gegenüber Calcit begünstigt. Aragonit ist neben Calcit das häufigste Biomineral. Es ist der anorganische Bestandteil in Perlmutt in Muscheln, ist auch häufig in Perlen enthalten und kommt außerdem in Schalen von marinen Einzellern und Korallen vor. Im Vergleich zu Calcit und Aragonit kommt Vaterit in der Natur nur selten vor. Es ist nach dem deutschen Chemiker und Mineralogen Heinrich Vater benannt. In den Gehäusen mancher Schnecken kommen alle drei Anhydratmodifikationen der Verbindung nebeneinander vor.[7][8]
Daneben existieren mit Monohydrocalcit und Ikait zwei weitere pseudopolymorphe Minerale, die Hydrate von Calciumcarbonat darstellen. Das instabile Monohydrocalcit ist das Monohydrat des Calciumcarbonats. Das erste natürliche Vorkommen von Monohydrocalcit wurde 1959 und 1964 als ein unreines Sediment im Issyk-Kul-See in Kirgisien beschrieben. In Lebewesen kommt es in Blasensteinen von Meerschweinchen und in den Gehörsteinchen einiger Wirbeltiere vor. Ikait ist das Hexahydrat von Calciumcarbonat und wurde in der Natur erstmals 1963 in Form von bis zu 20 Meter hohen Säulen am Ikkafjord auf Grönland entdeckt. Der Fundort verlieh dem Mineral auch seinen Namen. Das Mineral ist bei Atmosphärendruck über 0 °C instabil und geht darüber in Calcit über. Seine Bildung wird von Magnesium (das in Meerwasser reichlich enthalten ist) und von anderen Additiven begünstigt.[9]
Calciumcarbonat ist der Hauptbestandteil des sedimentär gebildeten Kalksteins, des metamorphen Marmors und weiterer Sedimentgesteine wie zum Beispiel Oolith oder Stromatolith. In der belebten Natur kommt es im Außenskelett von Krebstieren, Korallen, Muscheln, Schnecken sowie Einzellern vor. In diesen liegt es zum Teil auch in einer der mehreren bekannten amorphen Calciumcarbonatphasen (ACC) vor.[10]
Die ersten Kalkgesteine nennenswerten Ausmaßes entstanden durch Stromatolithe vor über zwei Milliarden Jahren.
Calciumcarbonat ist im Boden weiträumig vorhanden. Die wichtigsten Calcium-Minerale in unseren Boden sind Calcit und Dolomit [CaMg(CO3)2]. Sie werden im Boden freigesetzt, wenn Karbonatgesteine oder Mergel verwittern.[7]
Entgegen landläufiger Meinung enthalten die Knochen und Zähne der Wirbeltiere kein Calciumcarbonat, sondern die ebenfalls calciumhaltigen Stoffe Hydroxylapatit (in Knochen)[11] und zusätzlich Fluorapatit in den Zähnen. Allerdings kommt Calciumcarbonat beispielsweise bei Pflanzen vor. Die Blatthaare des Roten Hartriegels sind mit Calciumcarbonat überzogen, das bei Berührung mit empfindlichen Stellen der menschlichen Haut zu Reizerscheinungen führen kann.[12]
Calciumcarbonat wurde auch auf dem Planeten Mars nachgewiesen.[13]
Modifikationen in der Natur

In der Natur bildet Calciumcarbonat verschiedene Gesteine, die zwar chemisch identisch sind, sich jedoch in mancherlei Hinsicht unterscheiden. Calcit ist eines der wenigen Minerale, das in reiner Form als Gesteinsbildner in allen drei Hauptgruppen vertreten ist. Denn neben den Sedimenten Kreide und Kalkstein sowie dem Metamorphit Marmor gibt es auch magmatische Calciumcarbonat-Gesteine – die Carbonatite.
Kreide

Kreide ist ein feines, mikrokristallines Sedimentgestein, das durch Ablagerung von durch photosynthetischen Kohlensäureentzug gefälltem Calcit sowie der aragonitischen Schalen von fossilen Kleinlebewesen, wie Coccolithen der Coccolithophoriden und Schalen der Foraminiferen, entstanden ist. Kreide tritt an zahlreichen Standorten entlang des europäischen Kreidegürtels zutage, von Großbritannien über Frankreich bis hin zur Insel Rügen in Norddeutschland, und wird stellenweise abgebaut. Seekreide am Grund von Seen oder in verlandeten Seebecken besteht fast vollständig aus gefälltem Calcit. Die in der Schule verwendete Tafelkreide wird inzwischen allerdings meist nicht mehr aus echter Kreide, sondern vor allem aus Gips (Calciumsulfat) hergestellt.
Kalkstein
Kalkstein wird ebenfalls überwiegend von Lebewesen gebildet und ist stärker verfestigt als Kreide. Die Kalkablagerung geschieht entweder direkt oder indirekt aus den Überresten der Lebewesen, wie zum Beispiel von Schnecken, Muscheln, gesteinsbildenden Steinkorallen und Schwämmen, die Calciumcarbonat zum Aufbau von Außen- oder Innenskeletten abscheiden. Indirekt wird er dadurch gebildet, dass Lebewesen, vor allem phototrophe, CO2 assimilieren und so das Milieu alkalisieren, was zur Ausfällung von Calciumcarbonat führt. Die Größe der Carbonatkristalle liegt zwischen derjenigen von Kreide und Marmor. Große Kalkstein-Vorkommen befinden sich zum Beispiel auf der Schwäbischen und Fränkischen Alb, im Jura, in den Kalkalpen und den Westalpen, im Himalaya und in vielen anderen Gebieten.
Marmor
Marmor ist ein grobkristallines, metamorphes Gestein, das entsteht, wenn Kreide, Kalkstein oder Dolomit unter dem Einfluss hoher Temperaturen und/oder hoher Drücke (über 1000 bar) umkristallisiert werden. Große Marmor-Vorkommen finden sich in Europa beispielsweise in Südtirol (Laas), Österreich (Gummern), Norwegen (Molde) oder im italienischen Carrara, der Heimat des reinweißen Statuario, aus dem Michelangelo seine Skulpturen schuf, sowie auch in Nordamerika.
Darstellung
Synthetisches Calciumcarbonat wird als PCC (englisch precipitated calcium carbonate „gefälltes Calciumcarbonat“) bezeichnet – im Unterschied zu GCC (engl. ground calcium carbonate „gemahlenes Calciumcarbonat“). PCC kann auf verschiedene Arten hergestellt werden. Bekannte Prozesse sind die Fällung mit Kohlendioxid, das Kalk-Soda-Verfahren und der Solvay-Prozess, bei dem PCC als Nebenprodukt der Ammoniak-Herstellung anfällt.
Die Fällung mit Kohlendioxid ist der am häufigsten eingesetzte Prozess, insbesondere in den On-site-Anlagen der Papierindustrie. Sauberer Kalkstein beziehungsweise Branntkalk wird zunächst zum Calciumhydroxid (Kalkmilch) gelöscht und anschließend als dünne Suspension dem Reaktionsbehälter zugeführt. Dort leitet man so lange Kohlendioxid ein, bis das Calciumhydroxid vollständig zu Calciumcarbonat umgesetzt ist. Die Reaktionsdauer kann durch den Verlauf des pH-Wertes beurteilt und gesteuert werden.
Die Fällung erfolgt bei einem Feststoffgehalt von etwa 20 %. Über die Prozessführung (Temperatur, Druck, Zeit, Konzentration) können unterschiedliche Kristallformen (Kristallmorphologien) und Kornverteilungen erzeugt („gezüchtet“) werden. Bevorzugt wird die rhomboedrische oder skalenoedrische Kristallform. Weil mit hochreinen Ausgangsprodukten gearbeitet werden kann, sind die PCCs besonders weiß und haben auch Vorteile bezüglich der Opazität. Inzwischen erzeugen große Papierfabriken PCC in einem „Verbund“, indem sie Kohlenstoffdioxid, das bei der Verbrennung in Kraftwerken in Form von Rauchgasen entsteht, durch Bindung an Calciumhydroxid wieder rückgewinnen. Dies stellt jedoch keinen Beitrag zur Reduzierung der Kohlenstoffdioxid-Konzentration in der Atmosphäre (Klimawandel) dar, weil bei der zuvor notwendigen Herstellung von Kalkhydrat natürlicher Kalkstein gebrannt werden muss, wobei wieder CO2 freigesetzt wird.
Eine außergewöhnliche Calciumcarbonat-Lagerstätte gibt es im französischen Villeau, wo ein fossiler Calciumcarbonat-Niederschlag seit über 30 Millionen Jahren nie verfestigt wurde, sondern locker geblieben ist und so in seiner Zusammensetzung und Struktur dem künstlich gefällten PCC gleicht.[7]
Beim Kalk-Soda-Verfahren entsteht Calciumcarbonat als Nebenprodukt bei der Herstellung der Ätzalkalien Natriumhydroxid und Kaliumhydroxid.
Vaterit fällt besonders aus übersättigten Lösungen in Form mikroskopisch kleiner Kristalle aus. Monohydrocalcit kann durch Entwässerung unter ständigem Absaugen des Wassers des Hexahydrates oder durch Additive, wie z. B. Magnesium, direkt in einem Temperaturbereich von 0 bis 40 °C synthetisiert werden. Ikait konnte erstmals 1865 von Pelouze durch Einleiten von Kohlendioxid in eine wässrige Calciumoxid/Zucker-Lösung hergestellt werden. Es kann auch durch Zugabe einer Natriumcarbonatlösung in eine eisgekühlte Calciumchloridlösung hergestellt werden. Das Zermahlen von Ikait führt zu einer Abgabe des Kristallwassers, wodurch neben Calcit auch eine beträchtliche Menge an Vaterit entsteht.[9]
Amorphes Calciumcarbonat ist nach der Stufenregel von Ostwald bei der Kristallisation von Calciumcarbonat die erste Phase, die ausfällt. Es enthält eingeschlossenes und interstitielles Wasser, jedoch kann der Gehalt an Wasser variieren und wandelt sich im Weiteren in wässrigen Lösungen zu einer der wasserfreien polymorphen Phasen des Calciumcarbonats um. Verschiedene Arten von Additiven können ACC stabilisieren, jedoch kann stabilisiertes ACC auch ohne die Hilfe von Zusätzen erhalten werden, wenn es bei hoher Übersättigung gefällt wird. ACC, das frei von Zusätzen ist und aus äquilibrierten, leicht übersättigten (metastabilen) wässrigen Calciumcarbonatlösungen mithilfe eines plötzlichen Wechsels in ein schlechtes Lösungsmittel für Calciumcarbonat ausgefällt wurde (z. B. durch „Abschrecken“ in Ethanol).[10] ACC wurde erstmals von Johnston et al. durch Mischen konzentrierter Lösungen von Calciumchlorid und Natriumcarbonat hergestellt. Später wurde eine Methode gefunden, wodurch beim Einleiten von Kohlendioxid in eine gesättigte Calciumhydroxidlösung zunächst amorphes Calciumcarbonat entsteht, das dann weiter zu Calcit kristallisiert.[9]
Eigenschaften
Physikalische Eigenschaften

Calciumcarbonat kommt in mehreren wasserfreien und auch zwei Hydrat-Modifikationen sowie weiteren amorphen Formen vor. Alle sind in reiner Form farb- und geruchlose Feststoffe. Calciumcarbonat zerfällt ab ungefähr 600 °C in Calciumoxid und Kohlendioxid, wobei die genaue Zerfallstemperatur vom vorliegenden CO2-Partialdruck abhängt.
Die bei Normalbedingungen thermodynamisch stabilste und damit weitaus häufigste Calciumcarbonat-Modifikation ist das Calcit. Wie alle nichtkubischen, lichtdurchlässigen Minerale hat es die besondere Eigenschaft der Doppelbrechung, also einen einfallenden Lichtstrahl in zwei polarisierte Lichtstrahlen zu zerlegen, die verschieden stark gebrochen werden. Calcit kristallisiert bei Normalbedingungen in einer trigonalen Struktur in der Raumgruppe R3c (Raumgruppen-Nr. 167). Zudem existieren noch eine Hochtemperaturmodifikation (985 °C bei Normaldruck) mit der Raumgruppe R3m (Nr. 160) und mehrere Hochdruckmodifikationen (Calcit II–Calcit V). Bei Raumtemperatur entsteht Calcit II bei 1,70 GPa, der dann bei 2,15 GPa in Calcit III übergeht. Calcit III ist bei Raumtemperatur bis 6,16 GPa stabil und wandelt sich erst bei einer Temperaturerhöhung auf 345 °C in Aragonit um.[9]
Aragonit kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe Pmcn (Nr. 62, Stellung 5). Die Calciumionen liegen annähernd auf den Positionen einer hexagonal dichtesten Packung, die durch Stauchung entlang der sechszähligen Achse verzerrt wird. Aragonit ist trocken und bei Raumtemperatur über einen unbestimmten Zeitraum stabil. Dagegen wandelt er sich in Lösung langsam in Calcit um, dessen Morphologie bei der Umwandlung von Aragonit abhängig von den Bedingungen ist. Findet die Transformation in Lösung statt, so erhält man rhomboedrische Kristalle, während die nadelförmige Struktur des Aragonits bestehen bleibt, wenn die Umwandlung durch Erhitzen erfolgt. Die Aragonit-Calcit-Transformation ist irreversibel und findet nicht bei einer bestimmten Temperatur statt. Beim Erhitzen auf 400 °C dauert die Umwandlung zu Calcit ungefähr drei Stunden, während sie bei 470 °C nur wenige Minuten dauert. Der gesamte Umwandlungsbereich liegt zwischen 387 und 488 °C. Geologisch mineralisierter Aragonit tendiert nicht dazu, sich zwischen 10 und 90 °C umzuwandeln, während sich synthetisch hergestellter Aragonit in Lösung nahe 90 °C in Calcit umwandelt.[9] Aragonit ist jedoch die stabilste Phase des Calciumcarbonats oberhalb 70 °C und 1013 hPa und bei extremen Drücken.[8]
Vaterit ist die instabilste wasserfreie kristalline Form des Calciumcarbonat. Er ist im trockenen Zustand über einen langen Zeitraum stabil, wandelt sich dagegen bei Kontakt mit Wasser aufgrund von Auflösung und anschließender Rekristallisation in Calcit um. Daher ist es schwierig, Vaterit aus wässrigen Lösungen zu erhalten. Die Phasenumwandlungstemperatur zu Calcit ist abhängig von den jeweiligen Synthesebedingungen und liegt im Bereich von 320 bis 460 °C. Er kristallisiert in einer hexagonalen Kristallstruktur mit der Raumgruppe P63/mmc (Nr. 194).[9]
Monohydrocalcit, das Monohydrat von Calciumcarbonat, kristallisiert in einer der beiden trigonalen Kristallstrukturen mit der Raumgruppe P3121 (Nr. 152) oder P3221 (Nr. 154). Es ist instabil und kristallisiert innerhalb weniger Stunden, beim Befeuchten mit Wasser sofort, in die wasserfreie Phase Calcit um. Eine Temperaturerniedrigung und eine Erhöhung des hydrostatischen Druckes stabilisieren es. Eine Rückbildung zum Hexahydrat Ikait ist nicht zu beobachten.[9]
Das Ikait als Hexahydrat von Calciumcarbonat kristallisiert in der monoklinen Raumgruppe C2/c (Nr. 15). Die Struktur enthält diskrete CaCO3-Ionenpaare, die jeweils von einer Hülle aus 18 Wassermolekülen umgeben sind. Es ist bei Atmosphärendruck über 0 °C instabil, bei Drücken von 6 bis 7 kbar jedoch auch bei Raumtemperatur stabil. Es existiert zwar teilweise bei höheren Temperaturen, beginnt jedoch bei über 5 °C eine Umwandlung zu Calcit, die auch bei erneuter Temperaturerniedrigung nicht mehr aufgehalten werden kann. Löslichkeitsbestimmungen zeigen, dass Ikait im Vergleich zu Aragonit und Calcit löslicher ist und seine Löslichkeit im Gegensatz zu den wasserfreien Polymorphen mit sinkender Temperatur abnimmt.[9]
Als amorphes Calciumcarbonat (ACC) werden Modifikationen von Calciumcarbonat bezeichnet, die weder diskrete Röntgen- noch Elektronenbeugungsreflexe liefern. Es enthält bis zu einem Molekül Wasser pro Carbonat-Ion. Es ist instabil, wobei niedrige Fällungstemperaturen bei der Herstellung die amorphe Phase stabilisieren, während ein Temperaturanstieg zu einer schnellen Kristallisation führt. Auch eine stark alkalische Mutterlösung oder die Verwendung geeigneter Additive bei der Fällung, wozu vor allem Magnesium, Phosphate und eine Reihe organischer Substanzen gehören, stabilisieren ACC. Das Kristallisationsprodukt hängt von den Bedingungen ab. So bildet sich im Bereich von 14 bis 30 °C innerhalb von 3 bis 6 Stunden Vaterit und Calcit, während von 60 bis 80 °C in 17 bis 22 Stunden Aragonit und Calcit entstehen. Im dazwischen liegenden Temperaturbereich (40–50 °C) bilden sich alle drei kristallinen wasserfreien Phasen. In Gegenwart organischer Substanzen wie Aminen, Aminosäuren und Carbonsäuren wandelt sich ACC dagegen in Vaterit um. Dabei sind Ethylendiamin und Natriumaspartat die besten Additive für die Vateritbildung.[9]
| Modifikation | Calcit | Aragonit | Vaterit | Monohydro- calcit |
Ikait | ACC |
|---|---|---|---|---|---|---|
| Formel | CaCO3 | CaCO3 | CaCO3 | CaCO3·H2O | CaCO3·6H2O | CaCO3 |
| Kristall- system |
trigonal | ortho- rhombisch |
hexagonal | trigonal | monoklin | - |
| Raumgruppe | R3c (Nr. 167) | Pmcn (Nr. 62, Stellung 5) | P63/mmc (Nr. 194) | P31 (Nr. 144) | C2/c (Nr. 15) | - (amorph) |
| Gitter- konstanten Å |
a = 4,991 c = 17,062 γ = 120° |
a = 4,959 b = 7,964 c = 5,738 |
a = 4,130 c = 8,490 γ = 120° |
a = 10,5536 c = 7,5446 γ = 120° |
a = 8,792 b = 8,312 c = 11,021 β = 110,53° |
- |
| Dichte g·cm−3 |
2,71 | 2,93 | 2,65 | 2,43 | 1,83 | |
| Stabilität | stabil | stabil oberhalb 70 °C |
metastabil unterhalb 10 °C |
Wasserabgabe ab 60–80 °C |
stabil unter 0 °C |
bei Wasserentzug instabil |
Chemische Eigenschaften
Wie alle Carbonate ist auch Calciumcarbonat empfindlich gegenüber Säuren. Auf dieser einfachen Reaktion beruht die gebräuchlichste Erkennungsmethode für Carbonatgesteine. Tropft man etwas Salzsäure auf einen Kalkstein, wird Kohlenstoffdioxid frei und lässt die Flüssigkeit aufbrausen.[7]
Diese Säureempfindlichkeit machte sich der Sage nach auch der karthagische Feldherr Hannibal zunutze, als er 218 vor Christus mit seinen Elefanten die Alpen überquerte. Um den Tieren das Klettern im Fels zu erleichtern, befahl er seinen Soldaten, große Mengen Essig auf das kompakte Kalkgestein zu schütten, worauf das Gestein „chemisch“ verwitterte und die Soldaten mühelos Stufen für die Elefanten in den Fels brechen konnten.[7]
Calciumcarbonat selbst ist in reinem Wasser kaum löslich. Die Löslichkeit beträgt gerade einmal 14 Milligramm pro Liter, wobei das Carbonat-Ion als Hydrogencarbonat-Ion in Lösung geht.
Bei Anwesenheit von gelöstem Kohlenstoffdioxid steigt die Löslichkeit jedoch um mehr als das Hundertfache. Auf diesem Effekt beruht die Verwitterung von Kalkgestein, wobei sich das leicht lösliche Calciumhydrogencarbonat bildet.[7]
Wegen seiner Löslichkeit ist Calciumhydrogencarbonat ein Bestandteil der meisten natürlichen Gewässer, je nach Gestein in unterschiedlichen Konzentrationen. Die Konzentration von Calciumcarbonat im Wasser wird in Deutschland mit „Grad deutscher Härte“ (1 °dH = 10 mg CaO/Liter Wasser oder 17,85 mg CaCO3/Liter oder 0,18 mmol/l) angegeben. In Frankreich wird die Maßeinheit „Grad französischer Härte“ benutzt, wobei 1 °fH = 0,1 mmol Ca2+/l oder Mg2+Ionen entspricht. In der Schweiz wird entweder die direkte Angabe über mmol/l oder die französische Härte verwendet.
Der Umkehrung dieses Lösevorgangs, der Ausfällung, verdanken die meisten natürlichen Vorkommen von Calciumcarbonat ihre Entstehung. Da die Löslichkeit des Calciumcarbonats proportional zur Menge des gelösten Kohlendioxids und damit dem Gehalt an Kohlensäure ist, wird sie von den gleichen Faktoren bestimmt, die auch die Konzentration des Kohlendioxids (gemessen als Partialdruck) bestimmt. Der komplizierte Mechanismus, der an manchen Wasserläufen sichtbar ist, so etwa bei den Kalkterrassen in Pamukkale (Türkei), wird durch das Kalk-Kohlensäure-Gleichgewicht beschrieben. Dabei steigt die Löslichkeit von Kohlendioxid mit zunehmendem Druck und sinkender Temperatur. Wenn Wasser zum Beispiel durch die feinen Rinnen (Diaklasen) eines Kalkgesteins oder eines calciumhaltigen vulkanischen Gesteins fließt, steht es unter Druck und kann dadurch sehr viel mehr Calciumcarbonat lösen. Erreicht dieses Wasser dann das Freie, gleichen sich der Wasserdruck und die Temperatur an den Atmosphärendruck und die Umgebungstemperatur an. Das Kohlendioxid entweicht, das Calciumcarbonat fällt aus und bildet die typischen Kalkablagerungen. Auf diese Weise entstehen unter anderem Travertine (Begriff, der trotz Unterschiede oft synonym je nach Region und Sprache auch für Kalksinter oder Kalktuff verwendet wird), mehr oder weniger poröse Kalkgesteine. Ähnliche Vorgänge (Druckänderungen) laufen an Stromschnellen und Wasserfällen von Flüssen ab, wobei sich ebenfalls Travertine bilden. Neben dem Kohlendioxidgehalt bestimmt auch die vorhandene Wassermenge das Gleichgewicht zwischen gelöstem und ungelöstem Calciumcarbonat. Sinkt der Wasseranteil, entsteht zunächst eine übersättigte Lösung, aus der dann Calciumcarbonat ausfällt. Dies kann in der Natur durch Verdunsten bzw. Verdampfen oder durch Ausfrieren auftreten. Das bekannteste Beispiel für die Fällung von Calciumcarbonaten durch Verdunstung ist die Bildung von Tropfsteinen in den Karsthöhlen von Kalkgesteinen, den Stalaktiten und Stalagmiten. Auf der Verschiebung des Löslichkeits-Gleichgewichtes (Ausfall von Calciumcarbonat durch Temperaturerhöhung) beruht unter anderem auch die Bildung von Kesselstein in Heizkesseln, an Durchlauferhitzern und ähnlichen Geräten. Auch Lösungsvorgänge als Bildung von Strukturen sind in der Natur anzutreffen, die sich zum Beispiel in Form von Styolithen (einige Millimeter bis Zentimeter lange Vorsprünge oder Säulchen, die im Inneren von Kalkgesteinsbanken als unregelmäßige, gerippte Ebenen auftreten) zeigen.[7]
Ähnliche Vorgänge sind in der Tiefsee zu beobachten. Die Calcit- und Aragonit-Kompensationstiefe bezeichnet die Tiefe im Meer, unterhalb der sich Calcit und Aragonit vollständig auflöst. Ursache ist die Zunahme der Kohlendioxidkonzentration im Wasser mit zunehmender Meerestiefe.
Auch durch andere saure Bestandteile der Luft sowie durch Nitrifikation im Boden wird Calciumcarbonat gelöst. In der Luft enthaltene Schwefeloxide bilden in wässriger Umgebung Schwefelsäure (H2SO4). Diese verwandelt Kalk in Calciumsulfat (CaSO4) oder Gips (CaSO4 · 2 H2O). Calciumsulfat ist mit etwa 2 g/l zwar ebenfalls wenig wasserlöslich, aber besser löslich als Calciumcarbonat, was zu einem langsamen Auswaschen von Kalkoberflächen durch Feuchtigkeit führt.
Verwendung
Natürliches Calciumcarbonat (Kalkstein) wird in großen Mengen als Rohstoff für die Baustoff-Industrie, als Zuschlagstoff in der Stahlindustrie, als mineralischer Dünger, als Futterkalk und als mineralischer Füllstoff in diversen industriellen Anwendungen verwendet (z. B. in Papieren, Farben, Lacken, Putzen, Kunststoffen und Rückseitenbeschichtungen von Teppichen). Insgesamt werden jährlich über fünf Milliarden Tonnen Kalkgestein abgebaut.
Baustoff
Das Haupteinsatzgebiet ist die Herstellung von Zement (Calciumsilicat, Calciumaluminat) und Branntkalk.
Durch Brennen von Kalk entsteht Branntkalk. Aus diesem wird durch Löschen mit Wasser Kalkhydrat (Calciumhydroxid Ca(OH)2, gelöschter Kalk) hergestellt. Mit dem Kohlenstoffdioxid der Luft reagiert er wiederum zu Kalk und schließt den technischen Kalkkreislauf. Kalkhydrat und Kalk eignen sich als Putz oder Wandbeschichtungen wie dem Tadelakt. Die ersten Entdecker dieses Phänomens waren die Römer, die im großen Stile Kalkbrennanlagen betrieben.
Füllstoff
Nach dem weltweit verkauften Volumen ist Calciumcarbonat der wichtigste Füllstoff.[14] Obgleich mehr als fünf Prozent der Erdkruste aus Calciumcarbonat-Gesteinen besteht, sind nur wenige Lagerstätten für die Gewinnung von Füllstoffen geeignet, die möglichst weiß sein sollen. Der größte industrielle Anwender von weißen Calciumcarbonaten ist mit einer Menge von über 10 Millionen Tonnen (weltweit) pro Jahr die Papierindustrie, danach folgen die Kunststoff- und die Baustoff-Industrie (Putze und Farben) mit insgesamt nochmals 15 Millionen Tonnen pro Jahr. Für den Einsatz in der Papierindustrie, vor allem als Streichfarbe, werden in Europa insbesondere Lagerstätten in Frankreich, Italien, Deutschland, Norwegen und Österreich abgebaut, wobei das Mineral durch Nassmahlung zerkleinert und als Slurry (teilweise per Tankschiff) in den Handel kommt.
Landwirtschaft
Beim Bodengefüge werden über den Calciummagnesiumcarbonat-Gehalt der pH-Wert und dadurch die strukturellen Eigenschaften, die biotische Aktivität sowie die Speicherfähigkeit und Umsetzung der Nährstoffe im Boden beeinflusst. Das macht den pH-Wert zur wichtigsten Kenngröße für die Bewirtschaftung aller Bodentypen. Dabei spielt eine ausreichende Kalkversorgung mit „freiem“, nicht an Bodenpartikel gebundenem Calciumcarbonat eine bedeutende Rolle. Durch Kalkung wird versucht, einer Bodenversauerung entgegenzuwirken und die Bodenfruchtbarkeit zu erhalten oder zu verbessern. Calciumcarbonat dient so seit Jahrhunderten zur Verbesserung der Bodenfruchtbarkeit in der Landwirtschaft.[7] Die Bestimmung des Calciumcarbonatgehaltes im Boden erfolgt durch Zusetzung von 10%iger Salzsäure und Bewertung der auftretenden Reaktion, wie einer Schaumbildung.[15]
Lebensmittelzusatzstoff
In Deutschland wurde Calciumcarbonat durch die Farbstoff-Verordnung ab 1959 als Lebensmittelfarbstoff für die Verwendung in Lebensmitteln zugelassen.[16] Zur Übernahme der Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in nationales Recht wurde die Farbstoff-Verordnung 1966 angepasst und für Calciumcarbonat die E-Nummer E 170 aufgenommen.[17] Ab 1978 wurde die Verwendung in Deutschland durch die Zusatzstoff-Zulassungsverordnung geregelt. Durch die Verordnung (EG) Nr. 1333/2008, die am 20. Januar 2009 in Kraft trat, ist die Verwendung von Calciumcarbonat als Lebensmittelzusatzstoff im ganzen EWR einheitlich geregelt.[18] E 170 ist in Gruppe I und zusammen mit anderen Farbstoffen, wie Riboflavine, Zuckercouleur oder Carotin in Gruppe II: Lebensmittelfarbstoffe ohne Höchstmengenbeschränkung einsortiert und kann somit ohne Mengenbegrenzung (quantum satis) verwendet werden.[18] Calciumcarbonat wird in Lebensmitteln neben der Verwendung als Farbstoff auch als Füllstoff, Säureregulator, Trennmittel oder Rieselhilfe eingesetzt.[19] Im Speisesalz ist es als Rieselhilfe enthalten. Calciumcarbonat wird gebrochen und/oder gemahlen und kommt stückig oder als Mehl in den Handel.
Weitere Einsatzbereiche
Calciumcarbonat fand früher auch als Tafelkreide Verwendung, insbesondere in Frankreich als sogenannte Champagnerkreide, die aus Kreidegestein besteht, einem chemisch sehr reinen Calciumcarbonat. Etwa 55 Prozent der in Deutschland verkauften Kreide besteht heute aus Gips (Calciumsulfat).[20]
Für einige Anwendungen sind natürliche Calciumcarbonate nicht optimal, so dass hier synthetische Calciumcarbonate verwendet werden. Mit der Bezeichnung Hydro-Calcit wird synthetisches Calciumcarbonat in der Wassertechnik zur Entsäuerung von Wässern mit „aggressiver Kohlensäure“ verwendet. Dieses Verfahren gilt als eines der ältesten Entsäurerungsverfahren.[21]
Zusammen mit Magnesiumcarbonat wird Calciumcarbonat in Medikamenten zur Magensäureregulation (Antazida) eingesetzt.
Siehe auch
- Kalkseife
- Kesselstein
- Tropfstein
- Technischer Kalkkreislauf, mit den Kreislaufstoffen Calciumcarbonat (dieser Artikel), Calciumoxid und Calciumhydroxid
- Kalkablagerung
- Liste der E-Nummern
- Liste der Lebensmittelzusatzstoffe
Literatur
- Temple C. Patton: Pigment Handbook. S. 109 bis 128, John Wiley & Sons, ISBN 0-471-67123-1.
- Lothar Göttsching und Casimir Katz (Hrsg.): Papierlexikon. Gernsbach 1999, ISBN 3-88640-080-8.
- Wolfgang Tegethoff: Calciumcarbonat. ISBN 3-7643-6424-6.
Einzelnachweise
- Eintrag zu E 170: Calcium carbonate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- Eintrag zu CALCIUM CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Januar 2020.
- Eintrag zu Calciumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Dezember 2019. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 471-34-1 bzw. Calciumcarbonat), abgerufen am 2. November 2015.
- Datenblatt Calciumcarbonat (PDF) bei Merck, abgerufen am 5. August 2008.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Wolfgang F. Tegethoff: Calciumcarbonat Von der Kreidezeit ins 21. Jahrhundert. Springer-Verlag, 2013, ISBN 978-3-0348-8259-0, S. 3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Holger Nebel, Dissertation, Kontrollierte Fällung von CaCO3 in einem modular aufgebauten Kristallisationsreaktor, 2008, urn:nbn:de:hbz:465-20081222-080244-7
- Markus Neumann: Synthese und Charakterisierung von Calciumcarbonat-Phasen und Calciumphosphat-basierter Knochenersatzmaterialien, Dissertation, Uni Duisburg-Essen, abgerufen am 1. Januar 2016
- Julyan H. E. Cartwright, Antonio G. Checa, Julian D. Gale, Denis Gebauer, C. Ignacio Sainz-Díaz: Die Polyamorphie von Calciumcarbonat und ihre Bedeutung für die Biomineralisation: Wie viele amorphe Calciumcarbonat-Phasen gibt es?. In: Angewandte Chemie. 124, 2012, S. 12126, doi:10.1002/ange.201203125.
- Wissenschaft-Online-Lexika: Eintrag zu Knochen im Kompaktlexikon der Biologie. abgerufen am 3. August 2011.
- Ingrid Schönfelder, Peter Schönfelder: Der Kosmos Heilpflanzenführer. Franckh-Kosmos Verlags- & Company KG, 2019, ISBN 978-3-440-16504-1, S. 366 (books.google.de).
- W. V. Boynton, D. W. Ming, S. P. Kounaves, S. M. Young, R. E. Arvidson, M. H. Hecht, J. Hoffman, P. B. Niles, D. K. Hamara, R. C. Quinn, P. H. Smith, B. Sutter, D. C. Catling, R. V. Morris: Evidence for calcium carbonate at the Mars Phoenix landing site. In: Science. 325, 2009, S. 61–64, PMID 19574384.
- Marktstudie Füllstoffe. Ceresana Research 2007.
- David L. Rowell: Bodenkunde Untersuchungsmethoden und ihre Anwendungen. Springer-Verlag, 2013, ISBN 978-3-642-59093-1, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- BGBl. 1959 I S. 756 vom 19. Dezember 1959
- BGBl. 1966 I S. 74 vom 20. Januar 1966
- Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe.
- CLASS NAMES AND THE INTERNATIONAL NUMBERING SYSTEM FOR FOOD ADDITIVES CXG36-1989. (PDF) In: Codex Alimentarius. FAO, 2019, abgerufen am 25. Dezember 2020.
- Compakt Handbuch Chemie 1993, ISBN 3-8174-3560-6, S. 387.
- Johann Mutschmann, Fritz Stimmelmayr: Taschenbuch der Wasserversorgung. Springer-Verlag, 2007, ISBN 978-3-8348-9079-5, S. 263 (eingeschränkte Vorschau in der Google-Buchsuche).

