Cadmiumiodid
Cadmiumiodid, CdI2, ist eine chemische Verbindung des Cadmiums mit Iod. Es kristallisiert in einer Schichtstruktur im hexagonalen Kristallsystem. Die Cadmiumiodid-Struktur ist namensgebend für eine Reihe weiterer Verbindungen, die in der gleichen Struktur kristallisieren.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
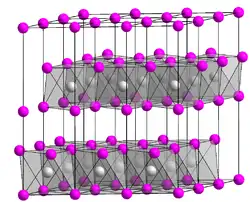 | ||||||||||||||||
| _ Cd2+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cadmiumiodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | CdI2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis dunkelbraune, glänzende, geruchlose hexagonale Blättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 366,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,67 g·cm−3 (30 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
796 °C[1] | |||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1850 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
aufgehoben, da cancerogen[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Die Darstellung von Cadmiumiodid gelingt aus den Elementen bei erhöhter Temperatur.
Weiterhin kann es auch durch Auflösen von Cadmium oder Cadmiumcarbonat in Iodwasserstoffsäure und anschließender Kristallisation dargestellt werden. Dabei entsteht ein Hydrat, das mit Thionylchlorid entwässert und so zum wasserfreien Cadmiumiodid umgesetzt werden kann.[3]
Ebenfalls möglich ist die Herstellung durch Reaktion von Cadmiumsulfat mit Kaliumiodid.[4]
Eigenschaften
Cadmiumiodid bildet an Luft stabile, weiß glänzende, hexagonale Plättchen, die bedingt durch die Schichtstruktur leicht spaltbar sind.[5]
Cadmiumiodid kristallisiert in einer hexagonalen Kristallstruktur in der Raumgruppe P63mc (Raumgruppen-Nr. 186) mit den Gitterparametern a = 425 pm und c = 1367 pm sowie zwei Formeleinheiten pro Elementarzelle[6] (4H-Struktur nach der Ramsdell-Klassifikation[7]) oder in einer geringfügig weniger stabilen trigonalen Struktur mit der Raumgruppe P3m1 (Nr. 164) und den Gitterparametern a = 424,4 pm und c = 685,9 pm (2H-Struktur).[8] Dabei bilden die Iodidionen eine hexagonal-dichteste Kugelpackung, in der jede zweite Oktaederlückenschicht vollständig mit Cadmiumionen Cd2+ besetzt ist. Die Cadmiumionen sind oktaedrisch von sechs Iodidionen umgeben, wobei jedes Iodidion die Spitze einer trigonalen Pyramide mit drei Cadmiumionen als Grundfläche bildet (Koordination = 6:3). Es ergeben sich einzelne Cadmiumiodidschichten, die nur durch schwache Van-der-Waals-Kräfte zusammengehalten werden. In einer der Cadmiumiodidstrukturen kristallisieren vor allem Bromide und Iodide, aber auch manche Sulfide, Selenide oder Telluride wie Magnesiumbromid, Calciumiodid, Eisen(II)-iodid, Zinn(IV)-sulfid oder Titan(IV)-sulfid.[9] Neben den beiden erwähnten Formen sind über 250 weitere Polytypen von Cadmiumiodid bekannt, die sich in der Abfolge der Schichten unterscheiden.[10]
Eine relativ neu entdeckte Modifikation des Cadmiumiodids sind die gut charakterisierten Nanopartikel, die CdI2 bei der Bestrahlung mit Elektronen bildet, wobei Nanoröhren und Fulleren-artige Strukturen entstehen.[11]
Verbindungen des CdI2-Typs
Cadmiumiodid gehört wie viele andere Halogenide und Hydroxide zweiwertiger Metalle oder Sulfide und Telluride vierwertiger Metalle zum CdI2-Strukturtyp, die alle eine Kristallstruktur der beiden einfachsten Polytypen aufweisen:
Verwendung
Cadmiumiodid findet als Reagenz zum Nachweis von Alkaloiden und Salpetriger Säure sowie bei der Herstellung von Leuchtfarben und Elektrolyse-Cadmium Verwendung. Es wird auch bei photographischen Verfahren wie der Ferrotypie eingesetzt.[5]
Sicherheitshinweise
Cadmiumiodid ist giftig beim Einatmen und Verschlucken, besitzt chronische Toxizität und wirkt krebserregend in Tierversuchen. Die letale Dosis LD50 beträgt bei Mäusen 166 mg/kg. Als niedrigste bekannte tödliche Dosis bei oraler Aufnahme durch den Menschen (LDLo) werden 81 mg/kg angegeben. Außerdem ist die Öko-Giftigkeit von Cadmiumiodid sehr hoch, insbesondere für Wasserorganismen, zumal es in Gewässern langfristige Schäden hervorrufen kann.[12]
Einzelnachweise
- Eintrag zu Cadmiumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Cadmium iodide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1490.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1043.
- Eintrag zu Cadmiumiodid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- P. Villars, K. Cenzual: Structure types. Part 4: Space Groups (189) - (174). In: Landolt-Börnstein - Group III Condensed matters, Springer, Berlin 2006.
- L.S. Ramsdell: Studies on silicon carbide. In: American Mineralogist, 32, 1947, S. 64–82, PDF.
- Y.M. DeHaan: Structure refinements, thermal motion and Madelung constants of cadmium iodide- and cadmium hydroxide-type layer structures. In: National Bureau of Standards (U.S.), Special Publication, 1969, S. 233–236.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 7. Auflage. 2007, de Gruyter, ISBN 978-3-11-018903-2, S. 138.
- H. Kaur: Growth and formation of polytypes in crystals of cadmium iodide. In: Archives of Applied Science Research, 6(1), 2014, S. 64–66.
- R. Popovitz-Biro, N. Sallacan, R. Tenne: CdI2 nanoparticles with closed-cage (fullerene-like) structures. In: J. Mater. Chem. 2003, 13, S. 1631–1634, doi:10.1039/b302505e.
- Eintrag zu Cadmium iodide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)


