Calciumgluconat
Calciumgluconat ist das Calciumsalz der Gluconsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
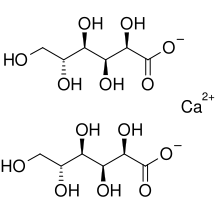 | ||||||||||||||||||||||
| Strukturformel ohne Kristallwasser | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumgluconat-Monohydrat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C12H22CaO14 · H2O | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 448,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
30 g·l−1 in Wasser (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Calciumgluconat wird als Säureregulator in der chemischen Industrie aber auch in der Lebensmittelindustrie verwendet. Es wird Lebensmitteln als Komplexbildner, Säureregulator oder Stabilisator zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 578 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Wegen seiner guten Resorptionseigenschaften ist Calciumgluconat u. a. in der Form des besser löslichen Doppelsalzes Calciumlactatgluconat Bestandteil vieler Calciumpräparate und wird in diätischen Lebensmitteln verwendet. Calciumgluconat hat einen Calciumgehalt von 9 % und eine Löslichkeit in Wasser von 35 g/L bei 25 °C. Ein weiteres Einsatzgebiet ist die Verwendung als so genannter Rieselhilfsstoff.
In der Notfallmedizin kommt Calciumgluconat als Antidot zum Einsatz. Hier wird es beispielsweise lokal bei Verätzungen und systemisch bei Vergiftungen mit der sehr giftigen und ätzenden Flusssäure bzw. Fluorwasserstoff (HF)[4] und Fluoriden[5] eingesetzt. Wirksamer Bestandteil dabei sind die Calciumionen (Ca2+), die in wässriger Calciumgluconatlösung vorliegen. Die Calciumionen verbinden sich mit den freien Fluoridionen (F−) im Körper, die für die schädliche Wirkung der Flusssäure verantwortlich sind, unter Bildung des unlöslichen Calciumfluorids (CaF2) und machen sie somit unschädlich. Außerdem sorgt das Calciumgluconat dafür, dass sich der Calciumspiegel, der aufgrund der Reaktion von körpereigenem Calcium mit Fluoridionen gesunken ist, wieder normalisiert. Notfalls können als Erste-Hilfe-Maßnahme auch andere calciumhaltige Mittel verabreicht werden; beispielsweise kann es helfen, Milch zu trinken, um damit die Resorption der Fluoridionen zu hemmen.[6] Calciumgluconat ist ein Antidot von Magnesium, weshalb es bei intravenöser Verabreichung von Magnesium bereitgehalten werden soll.[7]
In der Veterinärmedizin wird Calciumgluconat meist zur Therapie hypokalzämischer Zustande genutzt. Diese treten besonders häufig in akuter Form bei Milchkühen um den Geburtszeitpunkt herum auf und werden dann als Milchfieber, Kalbefieber oder Gebärparese bezeichnet.
Zur Prävention der Osteoporose trägt eine vermehrte Calcium-Aufnahme von etwa 1 g/Tag bei (Basistherapie DVO).
Calciumgluconat wird auch zur Soforttherapie einer Hyperkaliämie eingesetzt, um der K+-bedingten Depolarisation, besonders am Herzen, entgegenzuwirken. Dabei müssen die Kontraindikationen, Hypercalcämie und Therapie mit Herzglykosiden beachtet werden. Die Dosierung beträgt 10 ml Calciumgluconat 10 %, die Wirkung ist kurzfristig (30 Minuten).[8]
Einzelnachweise
- Eintrag zu CALCIUM GLUCONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu E 578: Calcium gluconate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- Datenblatt Calciumgluconat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Flußsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. November 2013.
- Eintrag zu Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. November 2013.
- Jürgen Stein (Hrsg.): Praxishandbuch klinische Ernährung und Infusionstherapie. Springer 2003, ISBN 978-3-642-55896-2, S. 120, eingeschränkte Vorschau in der Google-Buchsuche.
- Magnesium Verla® i.v. 50% Infusionslösungskonzentrat patienteninfo-service.de abgerufen am 2. August 2018.
- Innere Medizin – Herold – Kapitel Hyperkaliämie.