Calciumhydroxid
Calciumhydroxid (auch: gelöschter Kalk, Löschkalk, (Weiß)Kalkhydrat, Hydratkalk) ist das Hydroxid des Calciums.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
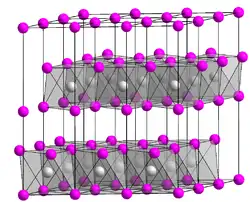 | |||||||||||||||||||
| _ Ca2+ _ OH− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumhydroxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | Ca(OH)2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, geruchloser Feststoff[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 74,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Calciumhydroxid entsteht unter starker Wärmeentwicklung (exotherme Reaktion) beim Versetzen von Calciumoxid mit Wasser.[6] Diesen Vorgang nennt man auch Kalklöschen. Die Wärmeentwicklung ist so stark, dass das Wasser zum Teil auch verdampft (umgangssprachlich als „Rauchen“ bezeichnet).
Einen Überblick über die Umwandlungsprozesse zwischen verschiedenen Calciumverbindungen (technischer Kalkkreislauf) gibt folgendes Schaubild:
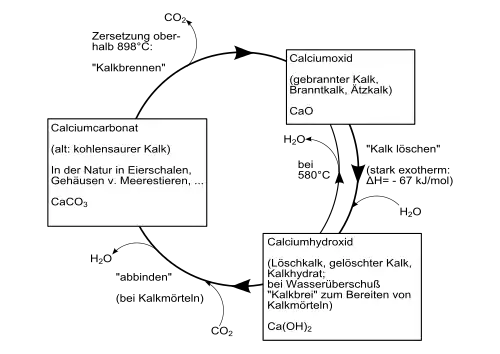
Weiterhin ist die Darstellung durch Reaktion von wässrigen Calciumsalzlösungen mit Alkalilaugen möglich (zum Beispiel Calciumnitrat mit Kaliumhydroxid).[6]
Calciumhydrid oder Calcium selbst reagiert mit Wasser heftig unter Bildung von Calciumhydroxid und Wasserstoff.[7]
Eigenschaften

Calciumhydroxid ist ein farbloses Pulver, das sich nur wenig in Wasser löst. Die Löslichkeit ist temperaturabhängig und sinkt bei steigender Temperatur: 1860 mg/l bei 0 °C; 1650 mg/l bei 20 °C und 770 mg/l bei 100 °C.[8] Bei 580 °C zersetzt es sich, wobei Calciumoxid und Wasser entstehen.[4] Calciumhydroxid besteht aus trigonalen Kristallen mit dem Polytyp 2H der Kristallstruktur vom Cadmiumiodid-Typ (Raumgruppe P3m1 (Raumgruppen-Nr. 164), a = 3,584, c = 4,896 Å).[6]
Obwohl nur recht schwer löslich, reagiert Calciumhydroxid stark basisch: Der pH-Wert einer gesättigten Lösung liegt bei 11–12,6.[9]
Verwendung
Bauwesen
Der Haupteinsatzzweck von Calciumhydroxid ist die Zubereitung von Mörtel im Bauwesen.[4] Es findet dort unter dem Namen Weißkalkhydrat Verwendung (DIN 1060). Kalkputze bestehen aus Mischungen von Calciumhydroxid und Sand. Letzterer kann auch in Form von gemahlenem Kalkstein beigefügt werden. Auch wird Calciumhydroxid vermehrt Asphaltmischgut zur Verbesserung der Haltbarkeit der fertigen Asphaltschicht zugesetzt.[10]
Beim Aushärten von Portlandzement entsteht Calciumhydroxid. Portlandzement wird überwiegend zur Herstellung von Stahlbeton verwendet. Die alkalische Wirkung des Calciumhydroxids im Beton verhindert solange das Rosten des Bewehrungsstahls, bis es durch Kohlensäure (oder auch andere saure Bestandteile des Regenwassers beispielsweise) neutralisiert wird.
In Verbindung mit Natron- und Schmierseife wird gelöschter Muschelkalk zu Tadelakt verarbeitet, einem hydrophoben Kalkputz für Nassräume.
Kalk wird zur Verbesserung der Tragfähigkeit von Baugrund eingesetzt. Ein Boden mit zu hohem Wassergehalt und daraus resultierender geringer Tragfähigkeit, schlechter Verdichtbarkeit kann durch das Untermischen von 2–4 % MA Kalk verbessert werden. Der Kalk bindet einen Teil des Wassers und verbessert so unter anderem die Plastizität, die Verdichtbarkeit und die Tragfähigkeit. Deshalb ist die Bodenverbesserung mit Kalk ein Verfahren zur sofort erreichbaren Verbesserung der Einbaufähigkeit und Erleichterung der Ausführung von Bauarbeiten.
Landwirtschaft und Lebensmittel
Die antiseptische, ätzende Wirkung, die das Wachstum von Krankheitserregern und Schimmelpilzen behindert, ist der Grund, warum früher gelöschter Kalk zum Desinfizieren von Ställen (das „Kalken“ der Ställe) benutzt wurde.
In der Lebensmittelindustrie wird es als Säureregulator Lebensmitteln zugesetzt und ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 526 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Eine weitere Verwendung findet Calciumhydroxid als Pflanzenschutzmittel im Obstbau. Hier wird es zum Beispiel als Fungizid (ein Mittel gegen Pilzbefall, etwa Baumkrebs) eingesetzt.
Weißanstrich auf die Rinde von Bäumen und Sträuchern wird in der Baumpflege gegen Sonnenbrandschäden sowie unter Umständen gegen Moosbewuchs, Algen, Flechten, Pilzbefall und andere Krankheiten angewendet. Der Auftrag erfolgt idealerweise zwischen Oktober und Januar durch Spritzen oder Streichen, direkt auf den Stamm des Baumes oder Strauches.
Chemie und Industrie
Gelöschter Kalk wird alternativ zu Kalkstein in der Rauchgasentschwefelung eingesetzt, da es mit Schwefelsäure Calciumsulfat (Gips) bildet. Die Einsatzmenge ist hierbei etwa 1,8-fach geringer als für Kalkstein. Der entstehende Gips hat einen Weißgrad von 80 % und kann kommerziell weiterverwendet werden. Durch seine hohe Reaktivität werden geringere Verbrauchmengen benötigt. Nachteil ist der gegenüber Kalkstein höhere Preis.
Kalkwasser ist die (nahezu) gesättigte Lösung von Calciumhydroxid und dient als klare Flüssigkeit zum Nachweis von Kohlenstoffdioxid durch Bildung von Calciumcarbonat, welches ausfällt und die Lösung trübt.
Suspensionen in Wasser sind:
- Fettkalk (Sumpfkalk): eine cremig-steife Masse – Baustoff: Kalkmörtel
- Kalkmilch: eine weißliche, milchartige Flüssigkeit, die sich zu Sumpfkalk und Kalkwasser entmischt – Kalkfarbe, Neutralisation von Säuren, Entcarbonisierung, Rauchgasentschwefelung
Calciumhydroxid dient als Zwischenprodukt zur Herstellung von Chlorkalk und Natronlauge aus Soda.[4]
Medizin und Lebensmittel
Weiterhin wird es als Medikament in der Zahnmedizin verwendet, vor allem zur Desinfektion von Wurzelkanälen und Kavitäten und zur Anregung der Dentin-Neubildung.
Es ist Bestandteil des Atemkalks, welches in Narkosegeräten oder Tauchgeräten mit Rückatmung zum Eliminieren von Kohlenstoffdioxid aus der Ausatemluft verwendet wird.
Sicherheitshinweise
Gebrannter (ungelöschter) Kalk (Calciumoxid, Branntkalk) und gelöschter Kalk sind reizend, Kontakt mit den Augen kann zu ernsten Augenschäden führen. Eine wässrige Calciumhydroxid-Lösung ist alkalisch und schwach ätzend. Ungelöschter Kalk kann unter Wasserzufuhr aufgrund Hitzeentwicklung Brände verursachen.
Historisches
Die exotherme Reaktion des Löschkalks galt von der Antike bis in die Frühe Neuzeit als eines der größten alltäglichen Rätsel und fand die unterschiedlichsten Erklärungen: Während der Kirchenvater Augustinus von Hippo (354–430) in seinem „Gottesstaat“ (21, 4) das Phänomen als eine Art Gottesbeweis ansieht, bemühten sich die Naturphilosophen das Phänomen nach ihren jeweiligen Vorstellungen zu deuten.[11] Als prominente Beispiele sind zu nennen:
Seneca der Jüngere und die Stoa
Entsprechend der stoischen Kosmologie deutete der römische Philosoph Seneca der Jüngere († 65 n. Chr.) das Kalklöschen entsprechend der Vier-Elemente-Lehre des Aristoteles. Das Calciumoxid ist für ihn nach dem Brennen eine Art „feuriger Stein“, welcher die Hitze an das ihn durchdringende Wasser abgibt.[12]
Vitruv und die antike Baustoffkunde
Der antike Baumeister Vitruv formuliert im 2. Buch seiner um 30 vor Chr. verfassten „Zehn Bücher über Architektur“ eine dem Verständnis seiner Zeit entsprechende Baustoffkunde. Dort bemüht er sich im 2. und 5. Abschnitt auch um eine schlüssige Erklärung des Kalklöschens. Hierfür verbindet er die griechische Atomistik eines Demokrit und Epikur mit den geometrischen Materiemodellen eines Pythagoras zu einer gänzlich eigenen Materietheorie: Für Vitruv besteht die Welt sowohl aus „Atomen“ und Vakuum (nach Demokrit/Epikur) als auch aus vier Elementen, die jedoch (nach Pythagoras) geometrische Körper sind. Daher sind für ihn die „Atome“ mit den Pythagoreischen Körpern identisch und bewegen sich im leeren Raum. Beim Kalkbrennen verlassen den als Gitterstruktur aus Pythagoreischen Körpern gedachten Kalkstein die „Wasser- und Luftatome“, so dass „Löcher“ entstehen. Vitruv erklärt so den Gewichtsverlust beim Brennen. „Feueratome“ dagegen werden eingelagert. Beim Löschen dringen „Wasseratome“ durch die „Löcher“ in den Kalkbrocken ein und das eingelagerte „Feuer“ entweicht. Da das Material an sich unverändert bleibt, geschieht die Haftung des Sandes im Mörtel allein durch die so entstandenen Poren. Während diese Erklärung für die reine Baupraxis ausreichte, gab die Inkompatibilität der von Vitruv kombinierten Systeme – die Atomistik kennt keine geometrisch unterschiedlichen, bausteinartigen „Atomkörper“ – gerade den sich auf ihn berufenden Architekturtheoretikern der Renaissance, wie Cesare Cesariano und Daniele Barbaro, zusätzliche Rätsel auf.[13][14]
Scaliger und Cardano
Im 16. Jahrhundert führen zwei der größten Universalgelehrten ihrer Zeit, Julius Caesar Scaliger und Gerolamo Cardano, über mehrere Jahre und Buchpublikationen hinweg, eine Fehde über die exakte Beschaffenheit der Welt. Während Gerolamo Cardano die Materie als unendliches Kontinuum ansah, das lediglich von Ort zu Ort in seiner „Dichte“ variierte, vertrat Scaliger die Ansicht, das „Vakuum“ sei für den Kosmos bestimmend und die Ursache aller Bewegung. In seinem gegen den Widersacher gerichteten Hauptwerk De subtilitate ad Cardanum (1557) legt Scaliger dieses Materieverständinis einleitend (Exercitatio, 5,8–9) an nichts anderem dar als am „Rätsel des Löschkalks“: Da beim Kalklöschen der Kalkbrocken Wasser in sich aufnimmt, können seine Poren nur „Vakuum“ enthalten, da „Luft“ nicht vor diesem nach oben entweichen könne, da sie sofort an andere „Luft“ stieße und so blockiert würde.[15]
Einzelnachweise
- Eintrag zu CALCIUM HYDROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Februar 2020.
- Eintrag zu E 526: Calcium hydroxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Datenblatt Calciumhydroxid (PDF) bei Merck, abgerufen am 4. April 2012.
- Eintrag zu Calciumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1305-62-0 bzw. Calciumhydroxid), abgerufen am 2. November 2015.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II. Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 926.
- Roland Pfestorf, Heinz Kadner: Chemie: Ein Lehrbuch für Fachhochschulen. ISBN 978-3-81711783-3, S. 368.
- Taschenbuch Chemische Substanzen, 3. Auflage. Harri Deutsch, Frankfurt a. M., 2007.
- Dr-Luthardt.de: pH-Wert und Löslichkeitsprodukt von Calciumhydroxid, abgerufen am 21. November 2019.
- Beitrag aus asphalt 4/2010 auf schaeferkalk.de: Kalkhydrat im Asphalt., Abgerufen am 28. Februar 2017.
- Felix Henke/Laura Thiemann, Vitruv über Stuck und Putz – die relevanten Passagen der ‚decem libri de architectura‘, in: Firmitas et Splendor. Vitruv und die Techniken des Wanddekors, hrsg. von Erwin Emmerling, Andreas Grüner et al., München 2014 (Studien aus dem Lehrstuhl für Restaurierung, Technische Universität München, Fakultät für Architektur) ISBN 978-3-935643-62-7, S. 13–125, dort S. 55.
- Thomas Reiser: Das Kalklöschen nach antiken und rinascimentalen Materietheorien. Anmerkungen zu Vitruv 2, 2 und 2, 5. Von Cesariano und Barbaro zur Fehde Scaligers mit Cardano, in: Firmitas et Splendor (2014), S. 299–319, dort S. 303–304.
- Felix Henke/Laura Thiemann, Vitruv über Stuck und Putz – die relevanten Passagen der ‚decem libri de architectura‘, in: Firmitas et Splendor. Vitruv und die Techniken des Wanddekors, hrsg. von Erwin Emmerling, Andreas Grüner et al., München 2014 (Studien aus dem Lehrstuhl für Restaurierung, Technische Universität München, Fakultät für Architektur) ISBN 978-3-935643-62-7, S. 13–125, dort S. 57–59
- Thomas Reiser: Das Kalklöschen nach antiken und rinascimentalen Materietheorien. Anmerkungen zu Vitruv 2, 2 und 2, 5. Von Cesariano und Barbaro zur Fehde Scaligers mit Cardano, in: Firmitas et Splendor (2014), S. 299–319, dort S. 306–312.
- Thomas Reiser: Das Kalklöschen nach antiken und rinascimentalen Materietheorien. Anmerkungen zu Vitruv 2, 2 und 2, 5. Von Cesariano und Barbaro zur Fehde Scaligers mit Cardano, in: Firmitas et Splendor (2014), S. 299–319, dort S. 314–317.


