Natriumchlorid
Natriumchlorid (auch Kochsalz genannt) ist das Natriumsalz der Salzsäure mit der chemischen Formel NaCl – nicht zu verwechseln mit Natriumchlorit (NaClO2), dem Natriumsalz der Chlorigen Säure.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| _ Na+ _ Cl− | ||||||||||||||||||||||
| Kristallsystem | ||||||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | |||||||||||||||||||||
| Gitterparameter |
a = 564,00 pm[1] | |||||||||||||||||||||
| Koordinationszahlen |
Na[6], Cl[6] | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Natriumchlorid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | NaCl | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 58,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
1461 °C[3] | |||||||||||||||||||||
| Löslichkeit |
gut in Wasser (358 g·l−1 bei 20 °C)[3], löslich in Methanol (1,31 g/100 g) und Ethanol (0,065 g/100 g bei 25 °C)[5] | |||||||||||||||||||||
| Brechungsindex |
1,55 (500 nm)[7] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
3.000 mg·kg−1 (LD50, Ratte, oral)[3] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Natriumchlorid ist für Menschen und Tiere der wichtigste Mineralstoff. Der Körper eines erwachsenen Menschen enthält etwa 150–300 g[8] Kochsalz und verliert davon täglich 3–20 Gramm, die ersetzt werden müssen. Dafür wurde es schon in vorgeschichtlicher Zeit gewonnen und blieb lange Zeit ein teures Handelsgut.
Vorkommen
Natriumchlorid ist in der Natur in großer Menge vorhanden, größtenteils gelöst im Meerwasser mit einem Gehalt von ca. 3 %, insgesamt 3,6 · 1016 Tonnen,[9] außerdem als Mineral Halit mit einem Gehalt von bis zu 98 % in den häufigen Steinsalzlagerstätten, die in erdgeschichtlicher Zeit in austrocknenden Meeresbuchten sedimentierten. Die insgesamt unter Deutschland vorkommenden Lagerstätten werden auf ein Volumen von 100.000 Kubikkilometer geschätzt.[10]
Steinsalzschichten sind plastisch und werden deshalb von geologischen Prozessen, denen sie unterliegen, vielfach verformt, u. a. zu leichter abbaubaren Salzstöcken und Salzkissen. Wenn eine Salzlagerstätte im Gebirge an die Oberfläche austritt, kann sogar ein Salzgletscher entstehen.
Gewinnung

Natriumchlorid wird in großem Umfang aus den beiden Hauptvorkommen Steinsalz und Meersalz gewonnen. Salz aus oberirdischen Lagerstätten, z. B. Salzseen, hat nur geringe Bedeutung. Die Weltsalzproduktion betrug 2006 über 250 Millionen Tonnen, die Anteile an Stein- und Meersalz werden auf ca. 70 % bzw. 30 % geschätzt. Die sechs größten Produzenten des Jahres 2006 mit zusammen über 60 % der Produktion sind in der unten stehenden Tabelle angegeben. China steigerte seine Produktion in den letzten Jahren erheblich, die USA hatten noch bis 2005 die größte Förderung. Die EU produziert insgesamt ähnliche Mengen wie die USA.
In Salzbergwerken, unter denen Tagebaue heute von quantitativ geringer Bedeutung sind, wird Steinsalz entweder bohrend-sprengend, schneidend oder nass abgebaut. In den ersten beiden Fällen wird das noch unter Tage mit Brechern zerkleinerte Material in verschiedenen Korngrößen zu Tage gefördert. Beim nassen Abbau wird ebenso wie bei der ausschließlich von über Tage betriebenen Bohrlochsolung das Salz mittels Bohrspülwerken, historisch auch in Sinkwerken, in Wasser gelöst und als gesättigte Sole von 26,5 % zu Tage gefördert. Dies erlaubt auch die Nutzung stark verunreinigter Vorkommen. Bei natürlichem Wasserdurchtritt durch salzführende Schichten kann auch Sole zu Tage treten, die meistens jedoch nicht gesättigt ist. Solche Solequellen waren die ersten vom Menschen im Binnenland genutzten Salzvorkommen. Die Konzentration der Sole wurde früher durch Wasserverdunstung in Gradierwerken erhöht, heute wird bergmännisch trocken abgebautes Salz zugesetzt. Aus der gereinigten Sole wird durch Eindampfen Siedesalz großer Reinheit erzeugt. Heute geschieht dies mittels in Kaskaden angeordneter geschlossener Vakuumverdampfer, wodurch ein Großteil der eingesetzten Wärme zurückgewonnen wird. In klimatisch geeigneten Gebieten wird zunehmend auch Sonnenenergie zur Verdunstung genutzt, das Verfahren ist vergleichbar dem der Meersalzgewinnung.
Die Gewinnung von Salz aus Meerwasser ist nur in Küstengebieten mit hoher Sonneneinstrahlung bei gleichzeitig geringen Niederschlägen wirtschaftlich. Das Meerwasser wird hierzu durch flache Beckenkaskaden (Salzgärten) geführt, in denen die Salzkonzentration durch natürliche Verdunstung zunimmt. Schließlich wird das ausgefällte Salz zusammengeschoben und getrocknet, nur für die teure Speisesalzqualität (französisch fleur de sel, „Blume des Salzes“) wird es an der Oberfläche schwimmend abgeschöpft. Auch in Salzgärten kann Sole entnommen werden.
Die vier Grundprodukte der Salzindustrie sind Sole, Steinsalz, Meersalz und Siedesalz. Für die USA schätzte der U.S. Geological Survey für 2007 mittlere Preise ab Werk von 10 USD/t für Sole, 25 USD/t für Steinsalz, 57 USD/t für Salz aus solarer Verdunstung und 150 USD/t für Siedesalz.[11]
| Rang | Land | Produktion
(in Mio. t) |
|---|---|---|
| 1 | Volksrepublik China | 68,0 |
| 2 | Vereinigte Staaten | 42,0 |
| 3 | Indien | 29,0 |
| 4 | Deutschland | 13,0 |
| 5 | Kanada | 13,0 |
| 6 | Australien | 12,0 |
| 7 | Chile | 9,5 |
| 8 | Mexiko | 9,0 |
| 9 | Brasilien | 7,5 |
| 10 | Niederlande | 7,0 |
Eigenschaften


Natriumchlorid bildet farblose Kristalle, die eine kubische Natriumchlorid-Struktur ausbilden. Sie sind, im Gegensatz zu vielen anderen Kristallen, nicht doppelbrechend. Hierbei ist jeder Natrium- sowie jeder Chlorkern oktaedrisch vom jeweils anderen Kern umgeben. Eine hexagonale Struktur kann in dünner Schicht auf einer Diamantoberfläche erzeugt werden.[13] Es ist sehr gut wasserlöslich, wobei die Löslichkeit nur wenig temperaturabhängig ist.[5]
| Löslichkeit in Wasser in Abhängigkeit von der Temperatur[5] | ||||||||||||
| Temperatur | in °C | 0 | 20 | 40 | 60 | 80 | 100 | |||||
| Löslichkeit | in g/100 g Wasser | 35,76 | 35,92 | 36,46 | 37,16 | 37,99 | 39,12 | |||||
| in Ma% | 26,34 | 26,43 | 26,71 | 27,09 | 27,53 | 28,12 | ||||||
| max. Massenkonzentration | in g·l−1 | 318,5 | 317,1 | 318,2 | 320,5 | 323,3 | 327,9 | |||||
| Dichte | in g·cm−3 | 1,2093 | 1,1999 | 1,1914 | 1,1830 | 1,1745 | 1,1660 | |||||
Entsprechend dem Raoultschen Gesetz kommt es bei wässrigen Lösungen zu einer Dampfdruckerniedrigung gegenüber reinem Wasser. Der Effekt verstärkt sich mit steigender Natriumchloridkonzentration bzw. Temperatur.[5] Die gesättigte Lösung siedet bei 108,7 °C.[5]
| Dampfdruck wässriger Natriumchloridlösungen[5] | ||||||||||||
| Konzentration in Ma% | 5 | 10 | 15 | 20 | 25 | |||||||
| Dampfdruck in kPa | 0 °C | 0,59 | 0,57 | 0,55 | 0,51 | 0,47 | ||||||
| 20 °C | 2,26 | 2,18 | 2,09 | 1,97 | 1,81 | |||||||
| 40 °C | 7,13 | 6,88 | 6,58 | 6,20 | 5,72 | |||||||
| 60 °C | 19,26 | 18,58 | 17,78 | 16,76 | 15,33 | |||||||
| 80 °C | 45,75 | 44,16 | 42,49 | 39,97 | 37,09 | |||||||
| 100 °C | 97,89 | 94,43 | 90,44 | 85,52 | 79,67 | |||||||
Der Quotient aus dem Dampfdruck einer wässrigen Natriumchloridlösung und dem Dampfdruck reinen Wassers ist die relative Gleichgewichtsfeuchte bei der betreffenden Konzentration und Temperatur. Wegen der Dampfdruckerniedrigung ist die relative Gleichgewichtsfeuchte in der Luft über der Lösung geringer als 100 %.
Solange in einer gesättigten Lösung ungelöster Bodensatz vorhanden ist, hält die Lösung ihre Konzentration und damit die Gleichgewichtsfeuchte konstant. Eine solche gesättigte Lösung eignet sich daher beispielsweise zur Erzeugung eines Feuchtefixpunkts zur Kalibrierung von Hygrometern. Wird nämlich die Umgebungsfeuchte über die Gleichgewichtsfeuchte hinaus erhöht, herrscht an der Flüssigkeitsoberfläche Übersättigung und Luftfeuchtigkeit kondensiert, bis die relative Umgebungsfeuchte wieder auf den Gleichgewichtswert gesunken ist. Die damit verbundene Verdünnung der Lösung wird dadurch kompensiert, dass ein Teil des ungelösten Bodensatzes in Lösung geht.
| Relative Gleichgewichtsfeuchte über gesättigten Natriumchloridlösungen[14] | ||||||||||||
| Temperatur | 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | |||
| relative Feuchte | 75,51 % | 75,67 % | 75,47 % | 75,09 % | 74,68 % | 74,43 % | 74,50 % | 75,06 % | 76,29 % | |||
Ist der Feuchtenachschub aus der Umgebungsluft ausreichend groß, kann so schließlich der gesamte Bodensatz aufgezehrt werden. Die relative Gleichgewichtsfeuchte über einer gesättigten Lösung ist daher auch die Deliqueszenzfeuchte bei der betreffenden Temperatur: Ein Natriumchloridkristall zerfließt in Luft mit einer relativen Feuchte über etwa 75 %.
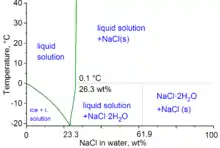
Bei einem Gehalt von 23,4 % Natriumchlorid in wässriger Lösung bildet es ein eutektisches Gemisch. Dieses erstarrt am eutektischen Punkt von −21,3 °C homogen und ohne Entmischung.[4] Diese Lösung wird Kryohydrat genannt. Unterhalb von 0,15 °C wird ein stabiles Dihydrat NaCl·2H2O gebildet.[5] Das Salz löst sich sehr gut in wässriger Ammoniaklösung. Bei tieferen Temperaturen kann ein Pentaammoniaksolvat NaCl·5NH3 in Form von farblosen Nadeln ausfallen.[5] Es sind auch Additionsverbindungen mit Harnstoff, Glucose und Sucrose bekannt.[5]
Die wässrige Lösung sowie die Schmelze leiten auf Grund der (elektrolytischen bzw. thermischen) Dissoziation von Natriumchlorid in seine Ionen elektrischen Strom. Die Leitfähigkeit der Schmelze steigt mit der Temperatur. Reines kristallines Natriumchlorid ist dagegen praktisch nicht leitfähig.[5]
Temperaturabhängigkeit der elektrischen Leitfähigkeit der Natriumchloridschmelze[5] Temperatur in °C 800 850 900 1000 1100 Elektrische Leitfähigkeit σ in S·m−1 3,58 3,75 3,90 4,17 4,39
Die Standardbildungsenthalpien und Entropien sind in folgender Tabelle gegeben.[16]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0solid
ΔfH0liquid
ΔfH0gas−411,12 kJ·mol−1[16]
−385,92 kJ·mol−1[16]
−181,42 kJ·mol−1[16]als Feststoff
als Flüssigkeit
als Gas, 1 barEntropie S0solid
S0liquid
S0gas72,11 J·mol−1·K−1[16]
95,06 kJ·mol−1[16]
229,79 kJ·mol−1[16]als Feststoff
als Flüssigkeit
als Gas, 1 barSpezifische Wärmekapazität cp 0,85 J·g−1·K−1[5] bei 25 °C Schmelzenthalpie ΔfH 520 J·g−1[5] beim Schmelzpunkt
Verwendung

Als Speisesalz ist Natriumchlorid ein wichtiger Bestandteil der menschlichen Ernährung. Es wird zum Würzen von fast allen Speisen benutzt. Seit der Zeit der Industrialisierung spielt jedoch mengenmäßig die industrielle Verwendung die weitaus größere Rolle. Je nach der Anwendung werden unterschiedliche Zusatzstoffe beigemischt.
Nach der Verwendung wird unterschieden zwischen Industriesalz als Rohstoff der chemischen Industrie, Auftausalz für den winterlichen Straßendienst, Gewerbesalz für die verschiedensten industriellen und gewerblichen Zwecke und Speisesalz zum menschlichen Genuss. Die Anteile dieser Verwendungen sind für Deutschland und die USA in der folgenden Tabelle angegeben:
| Industriesalz | Auftausalz | Gewerbesalz | Speisesalz | unbekannt | |
|---|---|---|---|---|---|
| Deutschland | 80 % | 12 % | 5 % | 3 % | 0 % |
| USA (2007) | 39 % | 37 % | 12 %* | 3 % | 9 % |
*weiter differenziert in 7 % (nichtchemische) industrielle, 3 % agrarische Verwendung und 2 % Regeneriersalz
Industriesalz
Als Industriesalz wird nur das in der chemischen Grundstoffindustrie eingesetzte Natriumchlorid bezeichnet. Es handelt sich um Steinsalz, bei entsprechenden lokalen Marktverhältnissen, wie etwa in Indien, auch um Meersalz sowie in großem Umfang um Sole, die teilweise in Pipelines transportiert wird. Für die USA wird der Soleanteil mit 90 % angegeben. Es ist ein vielseitiger Rohstoff der chemischen Industrie und Grundlage für viele Produkte, wobei die Produktion zu wichtigen Grundstoffen im Wesentlichen mit zwei verschiedenen Verfahren beginnt:
- Chloralkali-Elektrolyse mit den Produkten Wasserstoff, Chlor und Natronlauge, die einerseits durch die Chlorchemie, andererseits durch Verwendung des Natriumhydroxids weiterverarbeitet werden.
- Solvay-Verfahren mit den Produkten Natriumcarbonat (Soda) und Natriumhydrogencarbonat (Natron). Soda wird u. a. beim Schmelzen von Quarzsand als Glasrohstoff sowie zur Herstellung von Farbstoffen und Wasch- und Reinigungsmitteln benötigt. Natron dient als Back- und Feuerlöschpulver, zu Medikamenten und als Futterzusatz.
Weitere bedeutende Folgeprodukte sind Kunststoffe, medizinische Präparate und Schädlingsbekämpfungsmittel.
Auftausalz
Steinsalz wird im Winter bei mäßigen Frosttemperaturen als Auftausalz (Streusalz) verwendet, teilweise mit Zusätzen zur Erhaltung der Rieselfähigkeit. In Deutschland wurde Auftausalz eingefärbt, um dessen Verwendung in der Zubereitung von Lebensmitteln zu unterbinden. Mit der Abschaffung der Salzsteuer zum 1. Januar 1993 wurde dies jedoch hinfällig. Vor dem Streuen wird zur Erzeugung von besser geeignetem Feuchtsalz auch Sole zudosiert.
Gewerbesalz
Als Gewerbesalz wird praktisch alles gewerblich, technisch oder industriell verwendete Salz bezeichnet, das nicht in eine der drei anderen Kategorien fällt. Salz zum Zweck der Nahrungsmittelkonservierung zählt, obwohl in geringer Menge verzehrt, zum Gewerbesalz. Das Spektrum des Gewerbesalzes ist daher sehr groß und reicht von grobem ungereinigten Steinsalz bis zu hochreinem Natriumchlorid und sterilen Zubereitungen für chemische, pharmazeutische und medizinische Zwecke. Je nach Verwendung sind außerdem unterschiedlichste Zusätze zugefügt.
Viehhaltung
Dem Futter von Nutztieren wie Rindern, Schafen und Ziegen wird Viehsalz beigemengt (ungereinigtes, vergälltes Steinsalz, gegebenenfalls mit anderen Mineralsalzen als Zusatz). Dies steigert ihren Appetit und trägt zur allgemeinen Gesundheit bei.[17]
Bekannt sind auch Salzlecksteine, die in zoologischen Gärten, in der Viehwirtschaft, der Haus- und Heimtierhaltung sowie für Wildtiere verwendet werden.
Konservierung
Salz wird traditionell zur Konservierung von Lebensmitteln wie Fleisch (Pökeln, Suren), Fisch (etwa Salzhering), Gemüse (Sauerkraut) usw. verwendet. Dabei entzieht das Salz durch osmotische Wirkung dem Gut die Feuchtigkeit. So wird die Grundlage Wasser für schädliche Organismen entzogen, aber auch Keime und Krankheitserreger abgetötet.
Nitritpökelsalz besteht aus einer Mischung aus Kochsalz und Natriumnitrat, Natriumnitrit oder Kaliumnitrat.
Das Einlegen von Gemüse (etwa Salzgurken, Oliven) in Salzlake nutzt den keimtötenden Effekt.
Käse wird vor der Reifung in Salzwasser vorbereitet und während der Reifung mit einer Salzlake gepflegt, damit die Kruste trocken bleibt.
Physikalisch/Chemische Anwendungen
Salz wird als Regeneriersalz zur Wasserenthärtung in Geschirrspülmaschinen und Wasseraufbereitungsanlagen verwendet. In Kältemischungen wird es mit Wasser versetzt.
Auch bei der Lederverarbeitung und in der Färberei ist Salz ein unverzichtbarer Rohstoff.
Bei der Herstellung von Geschirr und anderer Keramik wird durch Zugabe von feuchtem Salz unter hoher Temperatur die traditionelle Salzglasur erzeugt. Dabei verbindet sich das Natrium-Ion des in der Ofenatmosphäre dissoziierten Kochsalzes mit den Silikaten des Tons zu einer dauerhaften Glasur. Das Salz ist allerdings bei den Anwendungstemperaturen (1.200 °C und höher) aggressiv und beschädigt das Ofeninnere (die feuerseitige Wärmedämmung), die deshalb öfter ausgewechselt werden muss.
Die ionisierende Wirkung des Salzes wird in der Metallverarbeitung eingesetzt.
Medizin
In der modernen Medizin wird eine 0,9%ige Lösung von Natriumchlorid in Wasser (isotonische Kochsalzlösung) als Trägerlösung für Medikamente verwendet.[18]
In der Antike und im Mittelalter galten Medikamente auf Salzbasis als wirksame Heilmittel. Die Haut Neugeborener wurde zu deren Stärkung mit Salz abgerieben. Es wurde in Wundverbänden, Pflastern, Salben, Pudern und Bädern eingesetzt. Besondere Bedeutung maß man der trocknenden und wärmenden Wirkung des Salzes bei.
Das Salz wurde im Mittelalter auch zur äußerlichen Behandlung von Geschwüren und Wunden benutzt, da es als zusammenziehend, reinigend und lindernd galt.[19]
Man streute Salz in Wunden, um Entzündungen zu verhindern – eine mitunter sehr schmerzhafte Prozedur, die in einer entsprechenden Redewendung („Salz in offene Wunden streuen“) Einzug in die deutsche Sprache gefunden hat.[20] Reines Salz zerstört über Osmose alle Zellen – also auch krankmachende Mikroorganismen wie Bakterien und Pilze, allerdings die Zellen des Verwundeten ebenso. Diese Art der Desinfektion ist also zweischneidig wie das ebenso praktizierte Ausbrennen von Wunden. Der gleiche Wirkmechanismus verhinderte, dass in Kochsalz konservierte Lebensmittel verdarben – also von Mikroorganismen zersetzt wurden.
Noch heute werden Solebäder als Heilmittel eingesetzt. Kuraufenthalte am Meer oder in salzhaltiger Luft bei Salinen und früher auch in Salzbergwerken dienen der Behandlung von Atemwegserkrankungen. Wo dies nicht möglich oder zu teuer ist, werden Inhalationsgeräte eingesetzt, bei denen Salz-Aerosol eingeatmet wird.
Kochsalzlösung wird auch zur Nasenspülung und zum Gurgeln verwendet. Für die Nasenspülung verwendet man isotonische Kochsalzlösung, da normales Wasser aufgrund der Osmose die Schleimhäute aufquellen lassen würde.
Infrarot-Optik
Kristallines Natriumchlorid ist für Licht mit Wellenlängen zwischen 0,21 und 25 µm ausreichend transparent, um es für optische Elemente zu verwenden.[21] Aus Natriumchlorid werden daher Linsen, Prismen und Fenster hergestellt, die für den sichtbaren Bereich sowie im nahen bis hinein ins mittlere Infrarot geeignet sind. Aufgrund der Wasserlöslichkeit von Natriumchlorid werden optische Elemente aus diesem Material durch Luftfeuchtigkeit beschädigt. Dies lässt sich jedoch verhindern, wenn ihre Temperatur über der Umgebungstemperatur gehalten wird. Aus diesem Grund sind in die verwendeten Halterungen oft Heizungen integriert. Natriumchlorid-Fenster werden häufig als Brewster-Fenster für leistungsstarke, gepulste CO2-Laser verwendet, aber auch in anderen Bereichen.[22] In der Infrarotspektroskopie wird es als Träger für Untersuchungsproben zu Tabletten gepresst.
Chemische Analytik
Natriumchlorid ist Urtitersubstanz nach Arzneibuch zur Einstellung von Silbernitrat-Maßlösungen. Um eine Maßlösung mit Natriumchlorid herzustellen, muss es zuerst getrocknet werden.
Speisesalz
Kochsalz ist für den Menschen lebensnotwendig (siehe physiologische Bedeutung). Früher war Kochsalz sehr kostbar. Die Zubereitung von Speisen wird vereinfacht und durch die Funktion als Gewürz im Geschmack verbessert. Die letale Dosis, die zu einer Hypernatriämie führt, wird beim Erwachsenen mit 0,5 bis 5 Gramm je Kilogramm Körpergewicht angegeben.[3]
Heute ist das im Handel erhältliche Salz oft jodiert, also mit lebensmittelverträglichen Iodverbindungen versetzt und soll einem möglichen Jodmangel vorbeugen. Im Handel wird es als Jodsalz bezeichnet. Daneben sind Speisesalz-Kristalle zur Erhaltung der Rieselfähigkeit meist mit einem Trennmittel umhüllt.
Es sind auch Produkte mit Zusätzen von Natriumfluorid (zur Verbesserung der Zahngesundheit) sowie Folsäure im Handel.
Weblinks
Einzelnachweise
- W.T.Barrett, W.E.Wallace: Studies of NaCl-KCI Solid Solutions. I. Heats of Formation, Lattice Spacings, Densities, Schottky Defects and Mutual Solubilities. In: Journal of the American Chemical Society 76(2), 1954, S. 366–369, doi:10.1021/ja01631a014.
- Eintrag zu SODIUM CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Natriumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Juli 2015. (JavaScript erforderlich)
- Eintrag zu Natriumchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Oktober 2016.
- G. Westphal, G. Kristen, W. Wegener, P. Ambatiello, H. Geyer, B. Epron, C. Bonal, G. Steinhauser, F. Götzfried: Sodium Chloride, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a24_317.pub4.
- V.P. Sachanyuk, G.P. Gorgut, V.V. Atuchin, I.D. Olekseyuk, O.V. Parasyuk: The Ag2S–In2S3–Si(Ge)S2 systems and crystal structure of quaternary sulfides Ag2In2Si(Ge)S6. In: Journal of Alloys and Compounds. Band 452, Nr. 2, S. 348–358, doi:10.1016/j.jallcom.2006.11.043 (angegeben als 1074 K).
- RefractiveIndex.INFO: Refractive index of NaCl (Sodium chloride).
- Spektrum Lexikon der Chemie: Natriumchlorid. Abgerufen am 14. Januar 2017.
- Werner Gwosdz: Salz-Gemeinschaftsunternehmen esco. Hannover: Bundesanstalt für Geowissenschaften und Rohstoffe, 2002 (Commodity Top News 16).
- von Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie - Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner. John Wiley & Sons, 2013, ISBN 978-3-527-64958-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- U.S. Geological Survey: Mineral Commodity Summaries, January 2008: Salt.
- United States Geological Survey: Salt World Production and Reserves.
- Kseniya A. Tikhomirova, Christian Tantardini, Ekaterina V. Sukhanova, Zakhar I. Popov, Stanislav A. Evlashin*, Mikhail A. Tarkhov, Vladislav L. Zhdanov, Alexander A. Dudin, Artem R. Oganov, Dmitry G. Kvashnin, Alexander G. Kvashnin: Exotic Two-Dimensional Structure: The First Case of Hexagonal NaCl in J. Phys. Chem. Lett. 11 (2020) 3821–3827, doi:10.1021/acs.jpclett.0c00874.
- L. Greenspan: Humidity Fixed Points of Binary Saturated Aqueous Solutions. Journal of Research of the National Bureau of Standards – A. Physics and Chemistry, Vol. 81A, No. 1, 1977 (PDF 8,5 MB)
- vergl. meereisportal.de - Phasendiagramm von Meereis
- Chase, M.W., Jr., NIST-JANAF Themochemical Tables, Fourth Edition, J. Phys. Chem. Ref. Data, Monograph 9, 1998, 1-1951.
- Jean-Francois Bergier, J. Grube: Die Geschichte vom Salz. Campus Verlag, 1989, ISBN 3-593-34089-5.
- M. D. Stoneham, E. L. Hill: Variability in post-operative fluid and electrolyte prescription. In: The British Journal of Clinical Practice. Band 51, Nr. 2, März 1997, S. 82–84, PMID 9158250.
- Heinrich Ebel: Der Herbarius communis des Hermannus de Sancto Portu und das Arzneibüchlein des Claus von Metry: Textübertragungen aus den Codices Bibl. Acad. Ms. 674, Erlangen, und Pal. Germ. 215, Heidelberg. Zwei Beiträge zur Erkenntnis des Wesens mittelalterlicher Volksbotanik. (Mathematisch-naturwissenschaftliche Dissertation, Berlin 1939) Würzburg 1940 (= Texte und Untersuchungen zur Geschichte der Naturwissenschaften, 1), S. 57 mit Anmerkung 63.
- Jean-Francois Bergier, J. Grube: Die Geschichte vom Salz. Campus Verlag, 1989, ISBN 3-593-34089-5, S. 144 ff.
- John H. Moore, Christopher C. Davis, Michael A. Coplan: Building Scientific Apparatus. 3. Auflage, Westview Press, Boulder,CO 2002, ISBN 0-8133-4006-3, S. 222.
- John H. Moore, Christopher C. Davis, Michael A. Coplan: Building Scientific Apparatus. 3. Auflage, Westview Press, Boulder,CO 2002, ISBN 0-8133-4006-3, S. 227.
