Fibrinogen
Das Fibrinogen ist ein Glykoprotein, das in der Leber von Wirbeltieren gebildet und ins Blutplasma ausgeschüttet wird. Fibrinogen (Gerinnungsfaktor I) wird bei der Blutgerinnung durch die Serinprotease Thrombin (Faktor IIa) und Calcium (Faktor IV) in Fibrin umgewandelt, das als „Substrat der Gerinnung“ zusammen mit zellulären Elementen des Blutes, namentlich den Thrombozyten, den Thrombus bildet.
| Fibrinogen | ||
|---|---|---|
| ||
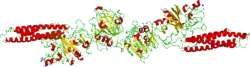
| kristallographische Struktur eines menschlichen Fibrinfragments mit 2 Liganden[1] | ||
| Masse/Länge Primärstruktur | 3410 = 2*(831+447+427) Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterohexamer 2α+2β+2γ | |
| Isoformen | α-1, α-2; γ-A, γ-B | |
| Bezeichner | ||
| Gen-Name(n) | FGA, FGB, FGG | |
| Arzneistoffangaben | ||
| ATC-Code | B02BB01 B02BC10 | |
| Wirkstoffklasse | Gerinnungsfaktor | |
Fibrinogen setzt sich aus drei Untereinheiten (α, β, γ) zusammen. Mutationen im FGA-, FGB- oder FGG-Gen können Fibrinogenmangel verursachen; Mutationen in FGA können außerdem familiäre Amyloidose Typ 8 hervorrufen.[2]
Struktur
Fibrinogen ist ein Proteinkomplex, ein aus je zwei α-, β- und γ-Untereinheiten bestehendes Hexamer. Die Untereinheiten sind über Disulfidbrücken so miteinander verbunden, dass der Amino-Terminus aller Untereinheiten das Zentrum des Komplexes, die so genannte E-Domäne bildet, von der die einzelnen Monomere als Coiled-Coil-Struktur wegführen. Die Carboxyl-Termini an der Außenseite werden D-Domäne genannt, so dass die vereinfachte Schreibweise lautet: D-coil-E-coil-D (siehe Abbildung).
Es können Heteropolymere mit Fibronectin gebildet werden. Etwa ein Drittel der α-Untereinheiten sind phosphoryliert.[2]
Funktion
Thrombozytenaggregation
Die Aktivierung von Thrombozyten führt zu einer Konformationsänderung des Rezeptors Integrin αIIbβ3, der daraufhin Fibrinogen mit hoher Affinität zu binden imstande ist. Eine Quervernetzung der Blutplättchen durch Fibrinogen ist die Folge.[3]
Fibrin-Synthese
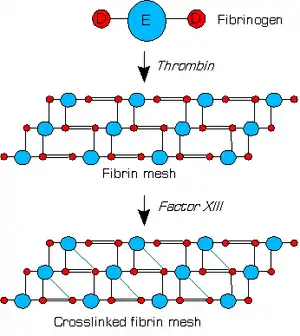
Fibrinogen ist die Ausgangssubstanz für die Erzeugung des Thrombus. Es liegt ständig im Blut gelöst vor. Bei einer Verletzung wird ein kaskadenartiger, mehrfach rückgekoppelter und an der Oberfläche der aktivierten Thrombozyten ablaufender Prozess der Aktivierung der im Plasma zirkulierenden prokoagulatorischen Faktoren ausgelöst, an dessen Ende die Bildung des zentralen Enzyms Thrombin steht. Dieses schneidet die D-Domänen des Fibrinogen-Hexamers ab (die kleinmolekularen Abspaltungsprodukte heißen Fibrinopeptid A und B). Die so freigesetzten Fibrinmonomere polymerisieren spontan zum wasserunlöslichen Fibrin-Blutgerinnsel. Erst durch weitere kovalente Quervernetzung mittels Faktor XIIIa entsteht der stabile Thrombus.[2]
Fibrinogenmangel
Die Normwerte für Fibrinogen liegen im menschlichen Körper zwischen 150 und 450 mg/dl, in der Schwangerschaft physiologisch bedingt bis 600 mg/dl. Als Akute-Phase-Protein kann es bei Entzündungsprozessen in kurzer Zeit auf über 1000 mg/dl ansteigen. Die Fibrinogenbestimmung erfolgt im Rahmen der Standard-Gerinnungstests koagulometrisch mit der Bestimmung nach Clauss, abgeleitet aus dem Quickwert oder in Vollblut durch Thromboelastometrie.[4]
Hereditäre Fibrinogensynthesestörungen
Extrem selten (Prävalenz < 1:1.000.000) ist der angeborene Fibrinogenmangel (Afibrinogenämie bzw. Hypofibrinogenamie), der oftmals bereits bei der Geburt zu schweren hämorrhagischen Störungen führt. Die etwas häufigeren abnormalen Fibrinogenfunktionen (Dysfibrinogenämien) hingegen sind meist klinisch unauffällig; Blutungssymptome treten hier nur ausnahmsweise auf.[5]
Erworbene Fibrinogenmangelzustände
Verdünnung, Verlust oder Verbrauch sind im klinischen Alltag die Hauptursachen für einen erworbenen Fibrinogenmangel. Im Rahmen einer reaktiven oder therapeutischen Hyperfibrinolyse kann das Fibrinogen infolge erhöhten Umsatzes unter kritische Werte absinken. Erworbene Synthesestörungen treten bei schweren Lebererkrankungen oder einer Asparaginasetherapie auf. Auch perioperativ (z. B. in der Herz- und Neurochirurgie), bei geburtshilflichen Komplikationen und bei Verbrennungen und Schockzuständen mit massivem Blutverlust kann es zu ausgeprägten Fibrinogenmangelzuständen kommen, ebenso während einer disseminierten intravasalen Koagulation (DIC) bei Sepsispatienten.
Bei Massivtransfusionen ist zu beachten, dass Fibrinogen als erster Prokoagulationsfaktor in den kritischen Bereich (< 100 mg/dl) abfällt.[6]
Therapie des Fibrinogenmangels
Es gibt ausreichend Hinweise, dass bei Blutungen die möglichst frühzeitige Korrektur eines Fibrinogenmangels oder einer Fibrinogen-Polymerisationsstörung sehr wichtig ist; diese kann mittels Infusionen von gefrorenem Frischplasma (GFP), Kryopräzipitat (fibrinogenreiche Plasmafraktion) oder Fibrinogenkonzentraten erfolgen. Die Plasmakonzentration des Fibrinogens sollte dabei in den Referenzbereich von mindestens 100 bis 150 mg/dl angehoben werden.[7] Bei hyperfibrinolytischen Prozessen müssen diese zunächst durch Anwendung von Antifibrinolytika gestoppt werden.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Fibrinogen. (engl.)
- D'Eustachio/reactome: fibrinogen → fibrin monomer + 2 fibrinopeptide A + 2 fibrinopeptide B
Einzelnachweise
- PDB 1FZC; S. J. Everse, G. Spraggon, L. Veerapandian, M. Riley, R. F. Doolittle: Crystal structure of fragment double-D from human fibrin with two different bound ligands. In: Biochemistry. Band 37, Nr. 24, Juni 1998, S. 8637–8642, doi:10.1021/bi9804129, PMID 9628725.
- UniProt P02671, UniProt P02675, UniProt P02679
- Goldhaber, Colman, Clowes (Hrsg.): Hemostasis and Thrombosis: Basic Principles and Clinical Practice. Lippincott Williams & Wilkins, 2006, ISBN 0-7817-4996-4, S. 826.
- T. Lang, K. Johanning, H. Metzler, S. Piepenbrock, C. Solomon, N. Rahe-Meyer, K. A. Tanaka. The effects of fibrinogen levels on thromboelastometric variables in the presence of thrombocytopenia. In: Anesth Analg. 2009; 108, S. 751–758, PMID 19224779.
- S. S. Acharya, D. M. Dimichele. Rare inherited disorders of fibrinogen. In: Haemophilia. 2008; 14, S. 1151–1158, PMID 16684009.
- Querschnitts-Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten. 4. Auflage. 2009.
- D. Fries, P. Innerhofer, W. Schobersberger: Time for changing coagulation management in trauma-related massive bleeding. In: Curr Opin Anaesthesiol. Band 22, Nr. 2, April 2009, S. 267–274, doi:10.1097/ACO.0b013e32832678d9, PMID 19390253 (wkhealth.com).