Calciumsulfat
Calciumsulfat ist eine chemische Verbindung aus der Gruppe der Calciumverbindungen und Sulfate, dessen Dihydrat als Gips bekannt ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
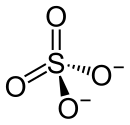 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Calciumsulfat | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | CaSO4 | ||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[3] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
2,96 g·cm−3[3] | ||||||||||||
| Schmelzpunkt |
Der Stoff zersetzt sich beim Erhitzen (Zersetzungstemperatur bei 1450 °C)[3] | ||||||||||||
| Löslichkeit |
Schwer löslich in Wasser (ca. 2,4 g·l−1 bei 20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
| ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
Calciumsulfat kommt natürlich in Form der Minerale Anhydrit CaSO4, Gips Ca[SO4]·2H2O (Dihydrat) und Bassanit Ca[SO4]·½H2O (Hemihydrat) in Evaporiten vor.
Calciumsulfat-Modifikationen
- α-Halbhydrat (CaSO4 • ½ H2O) entsteht in einem geschlossenen Gefäß (Autoklav) unter Nassdampfatmosphäre beziehungsweise drucklos in Säuren und wässrigen Salzlösungen. Es ist Ausgangsstoff für härtere Gipse (Typ III, IV und V) und benötigt weniger Wasser, aber mehr Zeit zum Abbinden.
- β-Halbhydrat (CaSO4 • ½ H2O) entsteht beim Brennen in einem offenen Gefäß unter normaler Atmosphäre. Beim Vermischen mit Wasser erfolgt innerhalb von Minuten eine Hydratation zum Dihydrat. Es ist Ausgangsstoff für die weicheren Gipse.
Im Fall von α- und β-Halbhydrat handelt es sich nicht um unterschiedliche Modifikationen, sondern um unterschiedliche Kristallinitätszustände der Halbhydratstruktur.
- Anhydrit III (CaSO4 • x H2O; 0<x<0,5) entsteht bei Temperaturen bis 300 °C aus dem Halbhydrat. Bei Vorhandensein von Wasser, auch Luftfeuchtigkeit, bildet sich sehr schnell Halbhydrat.
- Anhydrit IIs (CaSO4) entsteht bei Temperaturen zwischen etwa 300 bis 500 °C, das s steht für „schwerlöslich“. Beim Vermischen mit Wasser erfolgt die Hydratation innerhalb von Stunden und Tagen.
- Anhydrit IIu (CaSO4) bildet sich bei Temperaturen von 500 bis 700 °C aus dem Anhydrit IIs, das u steht dabei für „unlöslich“.
- Anhydrit I (CaSO4) ist die Hochtemperaturmodifikation des CaSO4, sie bildet sich bei 1180 °C.
Gewinnung und Darstellung
Es fällt als Dihydrat bei vielen Abwasserreinigungsverfahren, wenn es um die Neutralisation von sulfathaltigen Prozessabwässern oder schwefelsauren Beizen geht, und in großen Mengen auch bei der Rauchgasentschwefelung zusammen mit Calciumsulfit an.[5]
Weil Calciumsulfat bei vielen chemischen Prozessen (in der Regel in Form von Gips) als Sekundärprodukt entsteht, beispielsweise bei der Citronensäureherstellung, erübrigt sich eine gezielte industrielle Herstellung im größeren Stil. Der bei der Herstellung von Phosphorsäure entstehende sogenannte Phosphorgips ist u. a. mit Uran verunreinigt und ein Problemabfall. Der klassische Prozess ist die Fällung aus schwefelsaurem Wasser mit Kalkmilch oder Kalkstein:
In der Lebensmittelindustrie entsteht Calciumsulfat als Nebenprodukt bei der Herstellung von Weinsäure.
Eigenschaften
Calciumsulfat ist ein weißer geruchloser Feststoff, der schwer löslich in Wasser ist und sich ab einer Temperatur von etwa 1450 °C zersetzt,[3][6] wobei Calciumoxid und Schwefeltrioxid entstehen.[7] Die Kristallwasserabspaltung des Dihydrats erfolgt bei 125–130 °C, die des Halbhydrats bei Temperaturen größer als 163 °C.[3] Calciumsulfat ist in mineralhaltigem Quell-, Trink- und Leitungswasser gelöst und bildet zusammen mit Calciumchlorid und den entsprechenden Salzen des Magnesiums die permanente (bleibende) Wasserhärte. Es kristallisiert aus wässriger Lösung bei Raumtemperatur als Dihydrat (Gips) aus. Dieses kristallisiert monoklin in der Raumgruppe A2/a (Raumgruppen-Nr. 15, Stellung 2) mit den Gitterparametern a = 6,52 Å; b = 15,18 Å; c = 6,29 Å und β = 127,4° sowie 4 Formeleinheiten pro Elementarzelle.[8] Das Halbhydrat Bassanit kristallisiert monoklin in der Raumgruppe I2 (Nr. 5, Stellung 3) mit den Gitterparametern a = 12,04; b = 6,93; c = 12,67 und β = 90,27°[9] sowie 12 Formeleinheiten pro Elementarzelle[10].
Verwendung
Das Hauptanwendungsgebiet der Calciumsulfat-Phasen liegt im Baustoffsektor (siehe Verwendung von Gips).
In Lebensmitteln
In Deutschland wurde Calciumsulfat ab 1959 durch die Farbstoff-Verordnung als Lebensmittelfarbstoff sowie die Allgemeine Fremdstoff-Verordnung als allgemeiner Lebensmittelzusatzstoff für die Verwendung in Lebensmitteln zugelassen.[11][12] Bei der Übernahme der Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in nationales Recht wurde die Farbstoff-Verordnung 1966 angepasst und dabei Calciumsulfat gestrichen.[13] Ab 1978 wurde die Verwendung von Calciumsulfat in Lebensmitteln in Deutschland einheitlich durch die Zusatzstoff-Zulassungsverordnung geregelt. 1995 wurde Calciumsulfat dann als Lebensmittelzusatzstoff mit der E-Nummer E 516 in der EU zugelassen.[14] Durch die Verordnung (EG) Nr. 1333/2008, die am 20. Januar 2009 in Kraft trat, ist die Verwendung von Calciumsulfat als Lebensmittelzusatzstoff im ganzen EWR einheitlich geregelt.[15]
Calciumsulfat wird in Lebensmitteln allgemein als Trägerstoff, sowie als Festigungsmittel, Mehlbehandlungsmittel, Komplexbildner und Stabilisator verwendet.[16] Es wird als Gerinnungsmittel bei der Herstellung von Tofu eingesetzt.[17][18] E 516 ist in Gruppe I einsortiert und kann somit in Lebensmitteln im EWR ohne Mengenbegrenzung (quantum satis) verwendet werden. Auch bei der Verwendung als Trägerstoff gibt es keine Mengenbeschränkung.[15]
Als Trocknungsmittel

Anhydriertes Calciumsulfat wird außerdem traditionell als preisgünstiges und vielseitig einsetzbares Trocknungsmittel in Chemielaboren verwendet, wobei Cobalt(II)-chlorid als Indikator für den Wassergehalt zugesetzt sein kann. Beim Trocknen organischer Lösungsmittel ist Calciumsulfat allerdings nur mäßig effektiv: 1 g Calciumsulfat bindet weniger als 0,05 g Wasser (Calciumchlorid bis zu 0,2 g), sodass Calciumsulfat zum Trocknen relativ „nasser“ Lösungsmittel-Wasser-Gemische nicht gut oder nur zum Vortrocknen geeignet ist.[19]
Einzelnachweise
- Eintrag zu E 516: Calcium sulphate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu CALCIUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Calciumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7778-18-9 bzw. Calciumsulfat), abgerufen am 2. November 2015.
- Heinz M. Hiersig: Lexikon Produktionstechnik, Verfahrenstechnik. S. 805, ISBN 978-3-18-401373-8
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-54.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. Walter de Gruyter, Berlin, S. 628.
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 393.
- American Mineralogist Crystal Structure Database - Bassanite (englisch, 2001)
- handbookofmineralogy.org - Mineraldatenblatt Bassanite (englisch, PDF 65,8 kB)
- BGBl. 1959 I S. 756 vom 19. Dezember 1959
- BGBl. 1959 I S. 742 vom 19. Dezember 1959
- BGBl. 1966 I S. 74 vom 20. Januar 1966
- Aufgenommen durch die Richtlinie 95/2/EG des Europäischen Parlaments und des Rates vom 20. Februar 1995 über andere Lebensmittelzusatzstoffe als Farbstoffe und Süßungsmittel
- Verordnung (EG) Nr. 1333/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe.
- CLASS NAMES AND THE INTERNATIONAL NUMBERING SYSTEM FOR FOOD ADDITIVES CXG36-1989. (PDF) In: Codex Alimentarius. FAO, 2019, abgerufen am 25. Dezember 2020.
- E 516 - Calciumsulfat. In: das-ist-drin.de. snoopmedia GmbH, abgerufen am 22. Februar 2020.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. John Wiley & Sons, Weinheim 2013, ISBN 978-3-527-33019-5, S. 550 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Burfield: Desiccant efficiency in solvent and reagent drying. 9. A reassessment of calcium sulfate as a drying agent. In: The Journal of Organic Chemistry. Band 49, Nr. 20, 1984, S. 3852–3854, doi:10.1021/jo00194a043.

