Hydrogencarbonate
Hydrogencarbonate, auch saure Carbonate oder veraltet Bicarbonate, sind die Salze der Kohlensäure, die durch einfache Neutralisation dieser Säure mit einer Base entstehen. Oft wird auch das Anion dieser Salze, das Hydrogencarbonat-Ion (HCO3−), verkürzt als Hydrogencarbonat (oder Bicarbonat) bezeichnet. Wird durch weitere Basen-Zugabe auch die zweite Säurefunktion (Carboxygruppe) neutralisiert, so erhält man Carbonate.
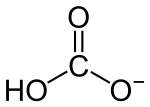
Infolgedessen haben gelöste Hydrogencarbonat-Ionen aufgrund ihres Potenzials, sowohl jeweils ein Proton abzugeben (Protonendonator) als auch wieder aufzunehmen (Protonenakzeptor), eine wichtige physiologische Bedeutung als Bestandteil des Kohlensäure-Bicarbonat-Systems und somit kapazitativ größtem Anteil der Blutpuffer-Systeme bei der Regulation des Säure-Basen-Haushaltes von Säugetieren.
Wichtige Hydrogencarbonate sind das Natriumhydrogencarbonat (Natron, Bullrich-Salz – NaHCO3), das Ammoniumhydrogencarbonat (Hirschhornsalz – NH4HCO3) und das Calciumhydrogencarbonat („Carbonathärte“ des Wassers – Ca(HCO3)2).
Eigenschaften von Hydrogencarbonaten
Der Aggregatzustand ist wie bei Carbonaten fest, weil zwischen den Hydrogencarbonat-Ionen und Kationen Ionenbindungen vorliegen und sich dadurch regelmäßige Ionengitter formieren. Hydrogencarbonate sind farblos und erscheinen in Pulverform weiß, soweit nicht das Kation eine Farbe einbringt. Hydrogencarbonate sind geruchlose Stoffe. Die meist löslichen Hydrogencarbonate bilden mit Wasser elektrisch leitfähige Lösungen, weil sie neben den Kationen frei bewegliche, hydratisierte Hydrogencarbonat-Anionen bilden. Hydrogencarbonat ist amphoter.
Zersetzung: Oberhalb einer Temperatur von 50 °C zerfällt Hydrogencarbonat; unter anderem entstehen Wasser und Kohlenstoffdioxid.
Die Hydrogencarbonate der Erdalkalimetalle (Calcium, Magnesium, Barium, Strontium) sind zwar in Wasser gut löslich, stehen aber über das Dissoziationsgleichgewicht der Kohlensäure in Beziehung zu den entsprechenden Carbonaten, die durchweg schwer löslich sind. Um das Löslichkeitsprodukt der Carbonate nicht zu überschreiten, muss der pH-Wert hinreichend niedrig sein, was durch die Anwesenheit einer Mindestkonzentration an freier Kohlensäure, somit an gelöstem Kohlendioxid, gewährleistet ist. Diese bezeichnet man als zugehörige Kohlensäure. Entweicht sie aus dem Wasser oder wird sie in Seen durch Photosynthese verbraucht, so scheiden sich die Carbonate teilweise in kristalliner Form ab (Kesselstein, Seekreide)
Es ist folglich (unter normalen Bedingungen) nicht möglich, die Hydrogencarbonate der Erdalkalien als Feststoff herzustellen. Beim Einengen der Lösungen werden immer die Carbonate gebildet.
Reaktionen von Hydrogencarbonaten
Hydrogencarbonationen reagieren als eine schwache Base mit Wasser zu Hydroxidionen und unbeständiger Kohlensäure. Hierbei stellt sich ein chemisches Gleichgewicht ein, das überwiegend auf der linken Seite liegt, da der pKB-Wert von Hydrogencarbonationen mit 7,48 relativ groß ist.
Bei Zugabe einer stärkeren Säure wie z. B. Salzsäure zu Hydrogencarbonaten reagieren diese als schwache Base zu Kohlenstoffdioxid und Wasser:
Diese Reaktion ist mit organischen Säuren für Brausepulver von Bedeutung.
Mit Calciumionen stellt sich ein Gleichgewicht mit schwerlöslichem Calciumcarbonat ein:
Dieses Gleichgewicht verschiebt sich beim Erwärmen stark auf die rechte Seite und ist für die Bildung von Kesselstein von Bedeutung. Beim Einleiten von Kohlenstoffdioxid in eine Calciumcarbonatsuspension verschiebt sich das Gleichgewicht unter Auflösen von Calciumcarbonat nach links.
Vorkommen und Verwendung von Natriumhydrogencarbonat
Natriumhydrogencarbonat kommt als Mineral (Nahcolith) u. a. in den USA vor. Es findet in der Lebensmitteltechnik z. B. als Back- und Brausepulver Verwendung. In der Medizin wird es gegen Sodbrennen eingesetzt („Bullrichsalz“®). Natriumhydrogencarbonat ist auch Bestandteil von Feuerlöschpulver.
Herstellung von Natriumhydrogencarbonat
- Natriumcarbonat, Kohlenstoffdioxid und Wasser reagieren zu Natriumhydrogencarbonat.
Diese Reaktion muss unter Kühlung ablaufen.
Verwendung von Ammoniumhydrogencarbonat
Hirschhornsalz wird beim Backen von Lebkuchen verwendet und zerfällt zu Ammoniak (NH3), Wasser und Kohlenstoffdioxid. Das im Handel erhältliche Salz besteht zumeist aus einer Mischung von Ammoniumhydrogencarbonat, Ammoniumcarbonat und Ammoniumcarbaminat.
Siehe auch
Literatur
- Arnold F Holleman; Egon Wiberg; Nils Wiberg, Lehrbuch der anorganischen Chemie, Walter de Gruyter & Co., Berlin, New York 2007, Aufl. 102, ISBN 978-3-11-017770-1